鿔(拼音:ɡē,注音:ㄍㄜ,粤拼:go1,音同“哥”;英语:Copernicium),是一种人工合成的化学元素,其化学符号为Cn,原子序数为112。鿔是一种放射性极强的超重元素及锕系后元素,所有同位素的半衰期都很短,非常不稳定,其最长寿的已知同位素为285Cn,半衰期为28秒。鿔不出现在自然界中,只能在实验室内以粒子加速器人工合成。截至目前,科学家用不同的核反应共合成出了75个鿔原子。除了基础科学研究之外,鿔没有任何实际应用。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名称·符号·序数 | 鎶(Copernicium)·Cn·112 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 12 ·7·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | [285] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Rn] 5f14 6d10 7s2 2, 8, 18, 32, 32, 18, 2 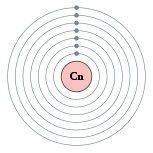 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 重离子研究所(1996年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 液体(预测)[1][2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 23.7 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 357+112−108 K,84+112−108 °C,183+202−194 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸气压 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 4, 2, 1, 0 (预测[3][4][5]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:1154.9 kJ·mol−1 第二:2170.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 147 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 122 pm (预测[6]) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密排
(预测)[7] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 54084-26-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:[[鎶的同位素]]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在元素周期表中,鿔位于d区,是第7周期、第12族的成员。鿔和金的化学反应显示,它是一种极易挥发的金属,在标准状况下可能是挥发性液体甚至气体,并似乎具有稀有气体的属性,和同族的汞相似,完全具有12族中的最重元素的应有属性。
计算显示,鿔的某些性质和第12族中较轻的同系物锌、镉和汞有较大的差异。最显著的不同就是鿔会在失去7s电子层前先失去两个6d层的电子。因此,根据相对论效应,鿔会是一种过渡金属。通过计算,科学家还发现鿔能呈稳定的+4氧化态,而汞则仅能在极端条件下呈+4态,锌和镉则不能呈+4态。科学家也精确地预测了鿔从游离态到化合态所需的能量。
位于德国达姆施塔特重离子研究所(GSI),由西格・霍夫曼和维克托・尼诺夫领导的研究团队在1996年首次合成出鿔。其名称得自提出日心说的波兰天文学家尼古拉·哥白尼。
| 外部视频链接 | |
|---|---|
超重元素[a]的原子核是在两个不同大小的原子核[b]的聚变中产生的。粗略地说,两个原子核的质量之差越大,两者发生反应的可能性就越大。[17]由较重原子核组成的物质会作为靶子,被较轻原子核的粒子束轰击。两个原子核只能在距离足够近的时候,才能聚变成一个原子核。原子核(全部都有正电荷)会因为静电排斥而相互排斥,所以只有两个原子核的距离足够短时,强核力才能克服这个排斥力并发生聚变。粒子束因此被粒子加速器大大加速,以使这种排斥力与粒子束的速度相比变得微不足道。[18]不过,只是靠得足够近不足以使两个原子核聚变:当两个原子核逼近彼此时,它们通常会在一起约10−20秒后裂变(产物不需要和反应物相同),而非形成单独的原子核。[18][19]如果聚变发生了,两个原子核产生的一个原子核会处于激发态[20],被称为复合原子核,非常不稳定。[18]为了达到更稳定的状态,这个暂时存在的原子核可能会直接核裂变,[21]或是放出一些带走激发能量的中子。如果这些激发能量不足以使中子被放出,复合原子核就会放出γ射线。这个过程会在原子核碰撞后的10−16秒发生,并创造出更稳定的原子核。[21]联合工作团队(JWP)定义,化学元素的原子核只有10−14秒内不进行放射性衰变,才能被识别出来,这个值大约是原子核得到它的外层电子,显示其化学性质所需的时间。[22][c]
粒子束穿过目标后,会到达下一个腔室——分离室。如果反应产生了新的原子核,它就会被这个粒子束携带。[24]在分离室中,新产生的原子核会从其它核素(原本的粒子束和其它反应产物)中分离,[d]并转移到半导体探测器中,在这里停止原子核。这时标记撞击探测器的确切位置、能量和到达时间。[24]这个转移需要10−6秒的时间,意即这个原子核需要存活这么长的时间才能被检测到。[27]衰变被记录后,这个原子核被再次记录,并测量位置、衰变能量和衰变时间。[24]
原子核的稳定性源自于强核力,但强核力的作用距离很短,随着原子核越来越大,强核力对最外层的核子(质子和中子)的影响减弱。同时,原子核会被质子之间,范围不受限制的静电排斥力撕裂。[28]超重元素[29]的主要衰变方式——α衰变和自发裂变都是这种排斥引起的。[e]α衰变由发射出去的α粒子记录,在实际衰变之前很容易确定衰变产物。如果这样的衰变或一系列连续衰变产生了一个已知的原子核,则可以很容易地确定反应的原始产物。[f](衰变链中的所有衰变都必须在同一个地方发生。)[24] 已知的原子核可以通过它经历的衰变的特定特征来识别,例如衰变能量(或更具体地说,发射粒子的动能)。[g]然而,自发裂变会产生各种分裂产物,因此无法从其分裂产物确定原始核素。[h]
尝试合成超重元素的物理学家可以获得的信息是探测器收集到的信息:粒子到达探测器的位置、能量和时间,以及粒子衰变的信息。物理学家分析这些数据并试图得出结论,确认它确实是由新元素引起的,而非由不同的核素引起的。如果提供的数据不足以得出创造出来的核素确实是新元素的结论,并且对观察到的影响没有其他解释,就可能在解释数据时出现错误。[i]
发现
位于德国达姆施塔特重离子研究所(GSI),由西格·霍夫曼和维克托·尼诺夫领导的研究团队在1996年首次合成出鿔元素。他们在重离子加速器中用高速运行的70锌原子束轰击208铅目标体,获得一颗半衰期仅为0.24毫秒的277Cn原子(另一颗被击散)。制取该元素的核反应方程式为:
2002年重离子研究所重复相同的实验,再次得到一个鿔原子。2004年,日本一家研究机构也合成出了两个鿔原子[41]。
名称
国际纯化学与应用化学联盟(IUPAC)在经过长期验证后,于2009年6月正式承认第112号元素的合成,并随后邀请霍夫曼领导的团队为112号元素提出一个永久名称。2009年7月17日,该团队提议将112号元素命名为Copernicium,缩写Cp,以纪念著名天文学家哥白尼(Copernicus)。他们称,将其命名为Cp的原因,是由哥白尼所提出的日心说与化学中的原子结构(卢瑟福模型)有很多相似之处。
Cp这个名称当时未获得IUPAC的正式承认。IUPAC在此后6个月的时间内进行审议,听取科学界的意见,并于2010年1月公布审议的结果。[42]2009年9月,《自然》杂志上的一篇文章[43]指出符号Cp曾用于镥元素(Lutetium)的旧称(Cassiopeium),现在在配位化学中亦用于指环戊二烯(茂,Cyclopentadiene)配位体。根据目前IUPAC对元素的命名规则,新元素的提议名称是不得与其他元素名称或符号重复的。考虑到上述情况,为了避免歧义,IUPAC已把提议中的符号Cp改为Cn(Copernicium)。[44]
2010年2月19日,德国重离子研究所正式宣布,经国际纯粹与应用化学联合会确认,由该所人工合成的第112号化学元素从即日起获正式名称“Copernicium”,相应的元素符号为“Cn”。[45]
在台湾,此元素之中文名称由国立编译馆化学名词审议委员会和中国化学会名词委员会开会讨论后决定命名为鿔[46]。
中华人民共和国全国科学技术名词审定委员会于2012年1月确定了鿔(读音同“哥”)的简体中文名称,获国家语言文字工作委员会批准后进入国家规范用字。[47][48]
目前已知的鿔同位素共有7个,质量数分别为277和281-286,此外鿔-285还有已知但未确认的亚稳态。[49]鿔的同位素全部都具有极高的放射性,半衰期极短,非常不稳定,且较重的同位素大多比较轻的同位素来的稳定,其中最长寿的同位素为鿔-285,半衰期为28秒。除了鿔-285外,其他寿命较长的同位素有鿔-283(半衰期4秒)和未经证实的鿔-285m(15秒)及鿔-286(8.45秒),剩下的同位素半衰期皆短于1秒。大多数鿔同位素主要发生α衰变,有些则会发生自发裂变,此外鿔-283也有几率发生电子捕获。[50]
根据预测,更重的未发现同位素鿔-291和鿔-293可能具有相对极长的半衰期,长达数十年以上,因为理论上它们预计位于稳定岛的中心附近,并且有机会在超新星的R-过程中生成,并在宇宙射线中检测到,尽管它们的含量大约仅为铅的10-12倍。[51]
核合成
诸如鿔等超重元素都是在粒子加速器中用离子轰击轻元素,诱导核聚变反应而产生的。大部分鿔的同位素可用这种方式直接合成,但一些较重的则只发现于更重元素的衰变产物中。[52]
核聚变反应根据所涉及的能量被分为“热聚变”和“冷聚变”。在热核聚变反应中,高能量的轻离子加速撞向质量高的目标体(多数用锕系元素),从而产生高激发能(约40至50 MeV)的复核,并可能释放3至5个中子。[52]在冷聚变反应中,产生的原子核激发能(约10至20 MeV)相对较低,这降低了发生裂变反应的概率。原子核冷却到基态时,只释放一个或两个中子,因此产物的中子数可较高。[53]此处所说的冷聚变反应有别于在室温条件下发生的核聚变反应(见冷聚变)。[54]
1996年重离子研究所首次进行合成鿔的冷核聚变反应,并报告检测到两个277Cn的衰变链。
2000年,他们撤回了这项发现。在2000年重复进行的反应中,他们又合成了一个鿔原子。他们在2002年试图测量1n激发能时,因70Zn束失败而未能取得结果。日本理化学研究所于2004年证实了277Cn的发现。他们进一步发现了两个277Cn原子,并确认了整个衰变链的衰变数据。
277Cn合成成功后,重离子研究所在1997年使用68Zn进行了反应,以研究同位旋(富含中子)对化学产量的影响。
科学家发现,用62Ni和64Ni离子合成𫟼同位素时能提高产量,因此开启了这项实验。由于没有检测到275Cn的衰变链,所以截面限制在1.2 pb。
1990年,一些初步迹象显示,用能量为几个GeV的质子照射钨目标体后,形成了鿔的同位素。重离子研究所和耶路撒冷大学因此合作研究了下列反应。
他们探测到一些自发裂变活动和12.5 MeV能量的α衰变,并将两者的源头指向辐射俘获产物272Cn或1n蒸发残留物271Cn。要证实这些结论,需要进行更多的研究。
1998年,俄罗斯杜布纳Flerov核研究实验室(FLNR)开始了一个研究项目:使用钙-48核的热聚变反应来合成超重元素。1998年3月,他们声称已经达到以下反应:
(x=3,4)
新合成的283Cn自发裂变成较轻的核素,半衰期约为5分钟。[55]
该产物的半衰期足够长,所以科学家首次开始针对鿔进行化学气态实验。2000年,杜布纳的Yuri Yukashev重复实验,但未能证实任何半衰期为5分钟的自发裂变。2001年重复的实验中,自发裂变产生的八块碎片积累于低温部分,这表明鿔具有类似氡的属性。不过,现在有些科学家高度怀疑这些结果的由来。为了确认鿔的合成,同一个团队在2003年1月成功地重复了反应,证实了衰变模式和半衰期。他们还能够计算出自发裂变活动质量的估值,约为285。这有助证实该同位素的发现。[56]
美国劳伦斯伯克利国家实验室团队在2002年进行反应时无法检测到任何自发裂变,计算的截面限制在1.6 pb。[57]
2003至2004年,杜布纳的团队使用了“杜布纳天然气填充反冲分离器”(DGFRS)重复进行了反应。这一次,283Cn以9.53 MeV进行α衰变,半衰期约为4分钟。研究人员也在4n通道中观察到282Cn(释放出4个中子)。[57]
2003年,德国重离子研究所也参与寻找长度为5分钟的自发裂变活动。和杜布纳团队的结果相似,他们也能够在低温部分探测到七块自发裂变碎片。然而,这些自发裂变事件之间并无关联,因此不是鿔原子核直接自发裂变产生的。这使科学家质疑鿔的化学特性是否真的和氡相似。[58]在杜布纳团队公布283Cn的不同衰变属性后,重离子研究所团队在2004年9月重复进行实验。他们无法检测到任何自发裂变事件,并计算出检测一个事件的截面限制,约为1.6 pb。
2005年5月,重离子研究所进行了物理实验,探测到单个283Cn原子进行了短半衰期的自发裂变,这意味着存在未知的自发裂变分支。[59]然而,杜布纳一开始已观察到数次直接的自发裂变事件,但他们假定没有探测到母核的α衰变。这些结果表明实际并不存在这个母核的α衰变事件。
2006年,保罗谢尔研究所和Flerov核研究实验室联合进行实验,以研究鿔的化学性质。实验证实了283Cn的新衰变数据。他们在287Fl的衰变产物中观测到两个283Cn原子。实验表明,鿔具有12族典型的属性,是化学性质不稳定的金属。
重离子研究所的小组在2007年1月成功地重现了他们的物理实验,并检测到三个283Cn原子,终于确认了283Cn的确是经α衰变和自发裂变的。[60]
长度为5分钟的自发裂变活动至今尚待证实。它可能源自一种同核异构体:283bCn。其产量收到了具体生产方式的影响。
Flerov核研究实验室小组于2004年研究了这个反应。他们无法检测到任何鿔原子,计算的截面限制为0.6 pb。该小组认为,这表明中子质量数会影响复核的蒸发残渣的产量。
| 蒸发残留 | 观测到的鿔同位素 |
|---|---|
| 285Fl | 281Cn[61] |
| 294Og, 290Lv, 286Fl | 282Cn[62] |
| 291Lv, 287Fl | 283Cn[63] |
| 292Lv, 288Fl | 284Cn[64] |
| 293Lv, 289Fl | 285Cn[65] |
科学家也曾在𫓧的衰变产物中观察到鿔。𫓧目前有五种已知的同位素,全都会经α衰变成为鿔原子,质量数介乎281至285。其中质量数281、284和285的鿔同位素迄今只出现在𫓧的衰变产物中。𫓧本身也是𫟷或鿫的衰变产物。至今已知的其他元素都不会衰变成鿔。
例如,2006年5月,杜布纳小组(联合核研究所)确定282Cn是鿫的α衰变链的最终产物。该产物经过自发裂变成为较轻的核素。[62]
于1999年科学家声称合成了293Og,报告指出281Cn以10.68MeV能量进行α衰变,半衰期为0.9毫秒。[66]报告在2001年遭撤回。293Og终于在2010年被合成,其衰变特性不符合此前的数据。
推算的化学属性
鿔是6d系的最后一个过渡金属,是元素周期表中12族最重的元素,位于锌、镉和汞下面。科学家预测,鿔与其他较轻的12族元素在属性上有显著差异。由于7s电子轨道的稳定加上相对论效应,6d轨道较不稳定性,因此Cn2+离子的电子排布很可能是[Rn]5f146d87s2,这和同族元素是不同的。在水溶液中,鿔很可能形成+2和+4氧化态,后者更稳定。在较轻的12族元素里,+2氧化态是最常见的,而只有汞能呈+4氧化态,但极少见。唯一一个已知的四价汞化合物(四氟化汞,HgF4)也只能在极端条件下存在。[67] 类似的鿔化合物CnF4、CnO2预计将更加稳定。双原子离子Hg2+2中汞具有+1态,但是Cn2+2离子预计将不稳定,甚至不存在。[68]
实验化学
鿔有基态电子排布为[Rn]5f146d107s2,所以根据构造原理,鿔应该属于周期表的12族。因此,它的属性应表现为汞的较重同系物,可与金等贵金属形成二元化合物。鿔的化学实验主要研究鿔在不同温度下在金箔表面的吸附作用,从而计算出吸附焓值。由于7s轨道电子相对稳定,鿔表现出类似氡的属性。实验同时形成了汞和氡的放射性同位素,这使科学家能够比较这些元素的吸附特性。
最初的化学实验使用了238U(48Ca,3n)283Cn反应。实验检测到目标同位素的自发裂变,半衰期为5分钟。分析数据表明,鿔的挥发性比汞高,并似乎具有稀有气体的属性。然而,由于未能确定283Cn同位素的发现,因此科学家对这些化学实验结果是持着疑问的。2006年4月至5月,Flerov核研究实验室和保罗谢尔研究所的联合团队在联合核研究所进行了𫓧的合成实验:242Pu(48Ca,3n)287Fl,并在衰变产物中对283Cn进行研究。该实验明确探测到两个283Cn原子,并发现鿔和金会产生弱金属-金属键。这意味着鿔是具高挥发性的汞同系物,明确属于12族。
2007年4月,科学家重复进行了这条反应,又合成了三个283Cn原子。该实验证实了鿔的吸附特性,结果表示鿔完全具有12族中的最重元素的应有属性。[4]
- ^ 在核物理学中,如果一个元素有高原子序,就可以被称为重元素。82号元素铅就是重元素的例子。“超重元素”这一词通常指原子序大于103的元素(尽管也有其它的定义,例如原子序大于100[12]或112。[13]有时这一词和锕系后元素是同义词,将超重元素的上限定在还未发现的超锕系元素的开始。)[14](那个元素的)“超重同位素”和“超重核素”顾名思义——分别是(那个元素的)高质量同位素和高质量的核素。
- ^ 2009年,由尤里·奥加涅相引领的团队在JINR发表了他们通过对称的136Xe + 136Xe反应,尝试合成钅黑的结果。他们未能在这个反应中观察到单个原子,因此对截面设置了上限,即核反应概率的度量为2.5 pb。[15]作为比较,发现钅黑的反应208Pb + 58Fe的截面约为20 pb(进一步来说,为19+19-11 pb),符合发现者的预测。[16]
- ^ 这个值也标志着普遍接受的复合原子核寿命上限。[23]
- ^ 这种分离是基于产生的原子核会比未反应的粒子束更慢地通过目标。分离器中包含电场和磁场,它们对运动粒子的影响会因粒子的特定速度而被抵消。[25]飞行时间质谱法和反冲能量的测量也有助于这种分离,两者结合可以估计原子核的质量。[26]
- ^ 不是所有放射性衰变都是因为静电排斥力导致的。举个例子,β衰变是弱核力导致的。[30]
- ^ 由于原子核的质量不是直接测量的,而是根据另一个原子核的质量计算得出的,因此这种测量称为间接测量。直接测量也是有可能的,但在大多数情况下,它们仍然无法用于超重原子核。[31]2018年,LBNL首次直接测量了超重原子核的质量,[32]它的质量是根据转移后原子核的位置确定的(位置有助于确定其轨迹,这与原子核的质荷比有关,因为转移是在有磁铁的情况下完成的)。[33]
- ^ 如果在真空中发生衰变,那么由于孤立系统在衰变前后的总动量必须保持守恒,衰变产物也将获得很小的速度。这两个速度的比值以及相应的动能比值与两个质量的比值成反比。衰变能量等于α粒子和衰变产物的已知动能之和。[34]这些计算也适用于实验,但不同之处在于原子核在衰变后不会移动,因为它与探测器相连。
- ^ 自发裂变是由苏联科学家格奥尔基·弗廖罗夫发现的。[35]LBL的科学家们认为自发裂变的信息不足以声称合成元素,他们认为对自发裂变的研究还不够充分,无法将其用于识别新元素,因为很难确定复合原子核是不是仅喷射中子,而不是质子或α粒子等带电粒子。[23]因此他们更喜欢通过连续的α衰变将新的同位素与已知的同位素联系起来。[35]
- ^ 举个例子,1957年,元素102在瑞典斯德哥尔摩省斯德哥尔摩的诺贝尔物理研究所被错误地鉴定。[36]早先没有关于该元素发现的明确声明,所以由它的瑞典、美国和英国发现者命名为nobelium。后来证明这个元素的鉴定是错误的。[37]第二年,RL无法重现瑞典的结果,而是宣布他们合成了该元素,这一说法后来也被驳回。[37] JINR坚持认为他们是第一个发现该元素的人,并为新元素建议命名为joliotium,[38]而这个名称也没有被接受(JINR后来认为元素102的命名是仓促的)。[39]这个名称是在IUPAC对元素发现优先权的裁决的书面答复中提出的,该裁决于1992年9月29日签署。[39]但由于其广泛使用,“nobelium”这个名称仍然保持不变。[40]
- ^ Soverna S 2004, 'Indication for a gaseous element 112,' in U Grundinger (ed.), GSI Scientific Report 2003, GSI Report 2004-1, p. 187, ISSN 0174-0814
- ^ Mewes, J.-M.; Smits, O. R.; Kresse, G.; Schwerdtfeger, P. Copernicium is a Relativistic Noble Liquid. Angewandte Chemie International Edition. 2019. doi:10.1002/anie.201906966.
- ^ 3.0 3.1 3.2 3.3 3.4 Hoffman, Darleane C.; Lee, Diana M.; Pershina, Valeria. Transactinides and the future elements. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- ^ 4.0 4.1 H. W. Gäggeler. Gas Phase Chemistry of Superheavy Elements (PDF). Paul Scherrer Institute: 26–28. 2007. (原始内容 (PDF)存档于2012-02-20).
- ^ 5.0 5.1 Fricke, Burkhard. Superheavy elements: a prediction of their chemical and physical properties. Recent Impact of Physics on Inorganic Chemistry. 1975, 21: 89–144 [4 October 2013]. doi:10.1007/BFb0116498. 引用错误:带有name属性“BFricke”的
<ref>标签用不同内容定义了多次 - ^ Chemical Data. Copernicium - Cn, Royal Chemical Society
- ^ Gaston, Nicola; Opahle, Ingo; Gäggeler, Heinz W.; Schwerdtfeger, Peter. Is eka-mercury (element 112) a group 12 metal?. Angewandte Chemie. 2007, 46 (10): 1663–6 [5 November 2013]. doi:10.1002/anie.200604262.
- ^ Soverna S 2004, 'Indication for a gaseous element 112,' 互联网档案馆的存档,存档日期2007-03-29. in U Grundinger (ed.), GSI Scientific Report 2003, GSI Report 2004-1, p. 187, ISSN 0174-0814
- ^ Eichler, R.; Aksenov, N. V.; Belozerov, A. V.; Bozhikov, G. A.; Chepigin, V. I.; Dmitriev, S. N.; Dressler, R.; Gäggeler, H. W.; et al. Thermochemical and physical properties of element 112. Angewandte Chemie. 2008, 47 (17): 3262–6 [5 November 2013]. doi:10.1002/anie.200705019.
- ^ Chart of Nuclides. Brookhaven National Laboratory
- ^ Wakhle, A.; Simenel, C.; Hinde, D. J.; et al. Simenel, C.; Gomes, P. R. S.; Hinde, D. J.; et al , 编. Comparing Experimental and Theoretical Quasifission Mass Angle Distributions. European Physical Journal Web of Conferences. 2015, 86: 00061. ISSN 2100-014X. doi:10.1051/epjconf/20158600061
 (英语).
(英语).
- ^ Krämer, K. Explainer: superheavy elements. Chemistry World. 2016 [2020-03-15]. (原始内容存档于2021-05-15) (英语).
- ^ Discovery of Elements 113 and 115. Lawrence Livermore National Laboratory. [2020-03-15]. (原始内容存档于2015-09-11) (英语).
- ^ Eliav, E.; Kaldor, U.; Borschevsky, A. Electronic Structure of the Transactinide Atoms. Scott, R. A. (编). Encyclopedia of Inorganic and Bioinorganic Chemistry. John Wiley & Sons: 1–16. 2018. ISBN 978-1-119-95143-8. doi:10.1002/9781119951438.eibc2632 (英语).
- ^ Oganessian, Yu. Ts.; Dmitriev, S. N.; Yeremin, A. V.; et al. Attempt to produce the isotopes of element 108 in the fusion reaction 136Xe + 136Xe. Physical Review C. 2009, 79 (2): 024608. ISSN 0556-2813. doi:10.1103/PhysRevC.79.024608 (英语).
- ^ Münzenberg, G.; Armbruster, P.; Folger, H.; et al. The identification of element 108 (PDF). Zeitschrift für Physik A. 1984, 317 (2): 235–236 [20 October 2012]. Bibcode:1984ZPhyA.317..235M. doi:10.1007/BF01421260. (原始内容 (PDF)存档于7 June 2015) (英语).
- ^ Subramanian, S. Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist. Bloomberg Businessweek. [2020-01-18]. (原始内容存档于2019-12-11) (英语).
- ^ 18.0 18.1 18.2 Ivanov, D. Сверхтяжелые шаги в неизвестное [Superheavy steps into the unknown]. nplus1.ru. 2019 [2020-02-02]. (原始内容存档于2020-04-23) (俄语).
- ^ Hinde, D. Something new and superheavy at the periodic table. The Conversation. 2017 [2020-01-30]. (原始内容存档于2020-03-17) (英语).
- ^ Nuclear Reactions (PDF): 7–8. [2020-01-27]. (原始内容存档 (PDF)于2020-11-30). Published as Loveland, W. D.; Morrissey, D. J.; Seaborg, G. T. Nuclear Reactions. Modern Nuclear Chemistry. John Wiley & Sons, Inc. 2005: 249–297. ISBN 978-0-471-76862-3. doi:10.1002/0471768626.ch10 (英语).
- ^ 21.0 21.1 Krása, A. Neutron Sources for ADS. Faculty of Nuclear Sciences and Physical Engineering (Czech Technical University in Prague). 2010: 4–8. S2CID 28796927 (英语).
- ^ Wapstra, A. H. Criteria that must be satisfied for the discovery of a new chemical element to be recognized (PDF). Pure and Applied Chemistry. 1991, 63 (6): 883 [2021-11-28]. ISSN 1365-3075. doi:10.1351/pac199163060879. (原始内容存档 (PDF)于2021-10-11) (英语).
- ^ 23.0 23.1 Hyde, E. K.; Hoffman, D. C.; Keller, O. L. A History and Analysis of the Discovery of Elements 104 and 105. Radiochimica Acta. 1987, 42 (2): 67–68 [2021-11-28]. ISSN 2193-3405. doi:10.1524/ract.1987.42.2.57. (原始内容存档于2021-11-27) (英语).
- ^ 24.0 24.1 24.2 24.3 Chemistry World. How to Make Superheavy Elements and Finish the Periodic Table [Video]. Scientific American. 2016 [2020-01-27]. (原始内容存档于2020-04-21) (英语).
- ^ Hoffman, Ghiorso & Seaborg 2000,第334页.
- ^ Hoffman, Ghiorso & Seaborg 2000,第335页.
- ^ Zagrebaev, Karpov & Greiner 2013,第3页.
- ^ Beiser 2003,第432页.
- ^ Staszczak, A.; Baran, A.; Nazarewicz, W. Spontaneous fission modes and lifetimes of superheavy elements in the nuclear density functional theory. Physical Review C. 2013, 87 (2): 024320–1. ISSN 0556-2813. doi:10.1103/physrevc.87.024320
 (英语).
(英语).
- ^ Beiser 2003,第439页.
- ^ Oganessian, Yu. Ts.; Rykaczewski, K. P. A beachhead on the island of stability. Physics Today. 2015, 68 (8): 32–38 [2021-11-28]. ISSN 0031-9228. OSTI 1337838. doi:10.1063/PT.3.2880. (原始内容存档于2021-11-28) (英语).
- ^ Grant, A. Weighing the heaviest elements. Physics Today. 2018. doi:10.1063/PT.6.1.20181113a (英语).
- ^ Howes, L. Exploring the superheavy elements at the end of the periodic table. Chemical & Engineering News. 2019 [2020-01-27]. (原始内容存档于2021-11-28) (英语).
- ^ Beiser 2003,第433页.
- ^ 35.0 35.1 Robinson, A. E. The Transfermium Wars: Scientific Brawling and Name-Calling during the Cold War. Distillations. 2019 [2020-02-22]. (原始内容存档于2021-11-28) (英语).
- ^ Nobelium - Element information, properties and uses | Periodic Table. Royal Society of Chemistry. [2020-03-01]. (原始内容存档于2021-03-08) (英语).
- ^ 37.0 37.1 Kragh 2018,第38–39页.
- ^ Kragh 2018,第40页.
- ^ 39.0 39.1 Ghiorso, A.; Seaborg, G. T.; Oganessian, Yu. Ts.; et al. Responses on the report 'Discovery of the Transfermium elements' followed by reply to the responses by Transfermium Working Group (PDF). Pure and Applied Chemistry. 1993, 65 (8): 1815–1824 [7 September 2016]. doi:10.1351/pac199365081815. (原始内容存档 (PDF)于25 November 2013) (英语).
- ^ Commission on Nomenclature of Inorganic Chemistry. Names and symbols of transfermium elements (IUPAC Recommendations 1997) (PDF). Pure and Applied Chemistry. 1997, 69 (12): 2471–2474 [2021-11-28]. doi:10.1351/pac199769122471. (原始内容存档 (PDF)于2021-10-11) (英语).
- ^ 第112号化学元素得到确认. 基础科学研究快报. 2009-06-30: 6.
- ^ New element named 'copernicium'. BBC News. 2009-07-16 [2009-08-05].
- ^ Juris Meija. The need for a fresh symbol to designate copernicium. Nature. 2009, 461 (7262): 341. PMID 19759598. doi:10.1038/461341c.
- ^ Tatsumi, K; Corish, J. NAME AND SYMBOL OF THE ELEMENT WITH ATOMIC NUMBER 112 (For Peer Review Only (PDF).
- ^ IUPAC News: Element 112 is Named Copernicium.
- ^ 雙語詞彙、學術名詞暨辭書資訊網. 国家教育研究院. [2013-06-17].
- ^ 语言文字信息管理司. 全国科学技术名词审定委员会公布112号元素的中文名称. 中华人民共和国教育部. [2020-11-06].
- ^ 全国科学技术名词审定委员会公布112号元素的中文名称. 中国科技术语. 2011-10-27, 13 (5): 62–62.
- ^ Hofmann, S.; Heinz, S.; Mann, R.; Maurer, J.; Khuyagbaatar, J.; Ackermann, D.; Antalic, S.; Barth, W.; Block, M.; Burkhard, H. G.; Comas, V. F.; Dahl, L.; Eberhardt, K.; Gostic, J.; Henderson, R. A.; Heredia, J. A.; Heßberger, F. P.; Kenneally, J. M.; Kindler, B.; Kojouharov, I.; Kratz, J. V.; Lang, R.; Leino, M.; Lommel, B.; Moody, K. J.; Münzenberg, G.; Nelson, S. L.; Nishio, K.; Popeko, A. G.; et al. The reaction 48Ca + 248Cm → 296116* studied at the GSI-SHIP. The European Physical Journal A. 2012, 48 (5): 62. Bibcode:2012EPJA...48...62H. S2CID 121930293. doi:10.1140/epja/i2012-12062-1.
- ^ Holden, N. E. Table of the Isotopes. D. R. Lide (编). CRC Handbook of Chemistry and Physics 85th. CRC Press. 2004. Section 11. ISBN 978-0-8493-0485-9.
- ^ Zagrebaev, Karpov & Greiner 2013,第1–15页.
- ^ 52.0 52.1 Barber, Robert C.; Gäggeler, Heinz W.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich. Discovery of the element with atomic number 112 (IUPAC Technical Report). Pure and Applied Chemistry. 2009, 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- ^ Armbruster, Peter & Munzenberg, Gottfried. Creating superheavy elements. Scientific American. 1989, 34: 36–42.
- ^ Martin Fleischmann. Electrochemically induced nuclear fusion of deuterium. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 10 April 1989, 261 (2): 301–308. doi:10.1016/0022-0728(89)80006-3.
- ^ Oganessian; Yeremin, A.V.; Gulbekian, G.G.; Bogomolov, S.L.; Chepigin, V.I.; Gikal, B.N.; Gorshkov, V.A.; Itkis, M.G.; Kabachenko, A.P.; et al. Search for new isotopes of element 112 by irradiation of 238U with 48Ca. Eur. Phys. J. A. 1999, 5 (1): 63–68. Bibcode:1999EPJA....5...63O. doi:10.1007/s100500050257.
- ^ Yu Ts Oganessian; et al. Second Experiment at VASSILISSA separator on the synthesis of the element 112. Eur. Phys. J. A. 2004, 19 (1): 3–6. Bibcode:2004EPJA...19....3O. doi:10.1140/epja/i2003-10113-4.
- ^ 57.0 57.1 W. Loveland, K. E. Gregorich, J. B. Patin, D. Peterson, C. Rouki, P. M. Zielinski, and K. Aleklett. Search for the production of element 112 in the 48Ca+238U reaction. Phys. Rev. C. 2002, 66 (4): 044617. Bibcode:2002PhRvC..66d4617L. arXiv:nucl-ex/0206018
 . doi:10.1103/PhysRevC.66.044617.
. doi:10.1103/PhysRevC.66.044617.
- ^ S. Soverna. Indication for a gaseous element 112 (PDF) 2003. GSI Scientific Report: 187. 2003. (原始内容 (PDF)存档于2007-03-29).
- ^ S. Hofmann; et al. Search for Element 112 Using the Hot Fusion Reaction 48Ca + 238U (PDF) 2005. GSI Scientific Report: 191. 2005. (原始内容 (PDF)存档于2012-03-03).
- ^ S. Hofmann; et al. The reaction 48Ca + 238U -> 286112* studied at the GSI-SHIP. Eur. Phys. J. A. 2007, 32 (3): 251–260. Bibcode:2007EPJA...32..251H. doi:10.1140/epja/i2007-10373-x.
- ^ Public Affairs Department. Six New Isotopes of the Superheavy Elements Discovered: Moving Closer to Understanding the Island of Stability. Berkeley Lab. October 26, 2010 [April 25, 2011].
- ^ 62.0 62.1 Oganessian, Yu. Ts.; et al. Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions. Physical Review C. 2006, 74 (4): 044602. Bibcode:2006PhRvC..74d4602O. doi:10.1103/PhysRevC.74.044602.
- ^ Yeremin, A. V.; Oganessian, Yu. Ts.; Popeko, A. G.; Bogomolov, S. L.; Buklanov, G. V.; Chelnokov, M. L.; Chepigin, V. I.; Gikal, B. N.; Gorshkov, V. A. Synthesis of nuclei of the superheavy element 114 in reactions induced by 48Ca. Nature. 1999, 400 (6741): 242. Bibcode:1999Natur.400..242O. doi:10.1038/22281.
- ^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G.; Bogomolov, S. Synthesis of superheavy nuclei in the 48Ca+244Pu reaction: 288114. Physical Review C. 2000, 62 (4): 041604. Bibcode:2000PhRvC..62d1604O. doi:10.1103/PhysRevC.62.041604.
- ^ Oganessian, Yu. Ts.; Utyonkov, V.; Lobanov, Yu.; Abdullin, F.; Polyakov, A.; Shirokovsky, I.; Tsyganov, Yu.; Gulbekian, G.; Bogomolov, S. Measurements of cross sections for the fusion-evaporation reactions 244Pu(48Ca,xn)292−x114 and 245Cm(48Ca,xn)293−x116. Physical Review C. 2004, 69 (5): 054607. Bibcode:2004PhRvC..69e4607O. doi:10.1103/PhysRevC.69.054607.
- ^ Ninov, Viktor; et al.. Observation of Superheavy Nuclei Produced in the Reaction of 86Kr with 208Pb. Physical Review Letters. 1999, 83 (6): 1104–1107. Bibcode:1999PhRvL..83.1104N. doi:10.1103/PhysRevLett.83.1104.
- ^ Wang, Xuefang; Andrews, Lester; Riedel, Sebastian; Kaupp, Martin. Mercury is a Transition Metal: The First Experimental Evidence for HgF4. Angewandte Chemie. 2007, 119 (44): 8523–8527. doi:10.1002/ange.200703710.
- ^ Haire, Richard G. Transactinide elements and future elements. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006: 1675. ISBN 1-4020-3555-1.
- 元素鿔在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 鿔(英文)
- 元素鿔在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素鿔在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 鿔(英文)





 (x=3,4)
(x=3,4)



