| 此条目尚未参照元素专题之格式编写。 |
碘(拼音:diǎn,注音:ㄉㄧㄢˇ,粤拼:din2;英语:Iodine;源于拉丁语:ἰώδης ,直译为深紫罗兰色),是一种化学元素,其化学符号为I,原子序数为53,原子量为126.90447 u。碘是最重的非人造且稳定的卤素,在标准状况下为有光泽的紫黑色固态非金属。碘会在摄氏114度时融化成深紫黑色液体;在摄氏184度时挥发成深紫罗兰色气体。碘元素在1811年首次被法国化学家贝尔纳·库尔图瓦发现,两年后约瑟夫·路易·盖-吕萨克因“带有深紫色光泽”性质而以希腊语 ἰώδης (深紫罗兰色)命名碘为 “iodine”。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
带金属光泽的紫灰色,蒸汽为紫色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 碘(Iodine)·I·53 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 卤素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 17 ·5·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 126.90447 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d10 5s2 5p5 2, 8, 18, 18, 7 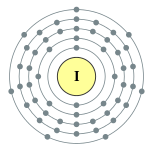 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 伯纳·库图瓦(1811年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 伯纳·库图瓦(1811年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 4.933 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 386.85 K,113.7 °C,236.66 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 457.4 K,184.3 °C,363.7 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相点 | 386.65 K(113 °C),12.1 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 819 K,11.7 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (I2) 15.52 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | (I2) 41.57 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | (I2) 54.44 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压((正交))
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 7, 5, 3, 1, -1 (强酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.66(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:1008.4 kJ·mol−1 第二:1845.9 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 139±3 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 198 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 正交 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (0 °C)1.3×107 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 0.449 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 7.7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7553-56-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:碘的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
碘元素以许多氧化态出现,包括碘离子(I-)、碘酸根(IO3-)和各种过碘酸离子。碘是丰度最低的非人造卤素,在地壳中丰度排名第61。碘亦是人体必需的元素中原子序最大的,是合成甲状腺素的必要成分,碘缺乏影响了将近二十亿人,虽然是造成智能障碍的主因,但可预防。
现今生产碘的主要国家是智利与日本。碘与其化合物主要用在营养品中,因为其原子量高且容易附着在有机化合物上,所以好用于无毒的放射对比物质上。因为碘被人体吸收的专一性,其放射性同位素也被用在甲状腺癌的治疗。此外,在工业上制造醋酸与一些聚合物时,也会使用碘作为催化剂。
碘的矿物较罕见,且大部分浓度够高、足够提供经济上萃取价值的矿床几乎都是碘酸盐。例如碘钙石(Ca(IO3)2)、碘铬钙石(7Ca(IO3)2·8CaCrO4 ),在智利的钙质层中(主要用于制造硝酸钠),这些矿物常以微量杂质存在,它们总共含至少0.02%到至多1%的碘重量百分比。碘酸钠可由钙质层中萃取,再用亚硫酸氢钠还原为碘盐,这个溶液接着与刚萃取出的碘酸盐混合产生归中反应,得到可被过滤出的碘。
物理性质

碘在常温下是紫色固体,会释放出紫色气体。碘会升华,但是这并不代表碘在常压下没有液态(砷是唯一在常压下没有液态的元素),碘升华的原因是其在固态下蒸气压足够大。碘在常压下的熔点为114℃。
在20℃时,碘在水中的溶解度为0.03g/100g。[1]
碘可溶于苯、乙醇、乙醚、氯仿和四氯甲烷。[1]
化学性质
碘可以在氢氧化钠溶液中发生自身氧化还原反应。
3I2 + 6NaOH → 5NaI + NaIO3 + 3H2O
过量的碘单质还可以和反应产生的碘化钠进一步反应,产生无色的NaI3。所以并不能认为碘与强碱反应产生的无色溶液一定为-1价碘化物和碘酸盐的混合物
碘是一种温和的氧化剂,可以和一些金属反应,如:
也能和一些强还原剂反应,如硫化氢或联氨[2]:
碘和强氧化剂反应,可以被氧化,如:
氯气过量,可以进一步反应,生成三氯化碘:
此外,碘还可以被浓硝酸氧化。
碘有33种同位素,其中只有碘-127是稳定的,其他都具有放射性,因此碘属于单一同位素元素。半衰期小于一天的放射性同位素有27种。
具放射性的碘-131可以用来治疗癌症,例如甲状腺癌。
碘是在1811年被贝尔纳·库尔图瓦(Barnard Courtois)在制造硝酸钾时发现的。碘分子在酸性环境中比较稳定。
英文名称Iodine来自希腊文ιώδης,意为靛色或紫色。日文则音译德文Iod的第一个发音而称之为“沃素(ヨウ素)”。而中文则取英文名称的最后一个音节(dine→典),加上代表固体非金属元素的“石”字部首,命名为“碘”。
主要用途

- 不像氯与氟都各有明显的一个主要用处,碘则有各种重要性不同的用途。约莫一半的碘被转成有机碘化合物,另外15%维持纯碘状态,还有15%被做成碘化钾,此外,有15%被制成其他碘化合物,剩余的5%被用在其他杂项。碘化物的主要用途包括做为催化剂、动物食物添加品、稳定剂、染剂、着色剂、颜料、药品、清洁卫生(碘酒)与照片;其他小众用途为除雾、种云,和在分析化学中的多种用途。
- 碘是生物必须的一种微量营养素,缺乏碘会引致碘缺乏病,影响甲状腺。所以在日常饮食中得不到足够碘的人要补充加碘盐(通常是碘酸钾)。
- 碘酊(又称碘酒,为碘和碘化钾的酒精溶液)、碘仿与及聚维酮碘溶液是多用途的消毒剂。
- 碘-131可用于医学造影及放射治疗,而不少医学显影剂均为含碘的有机化合物。
- 一些国家会向核电厂周边居民发放碘片(碘化钾),在核事故发生四小时内服用,优先占据人体内碘元素的位置,以降低甲状腺吸收放射性同位素碘131,避免诱发癌症。
- 一些摄影用的胶卷用碘化银作为感光材料。
- 碘化银可以作为人工增雨时,用飞机或者火箭布设在云层中的凝结核
- 卤素灯泡中含有碘或溴,以减缓灯丝烧毁的速度。
特殊用途
- 碘遇淀粉,会产生歧化反应,生成物呈蓝色,由此验证淀粉的存在。
- 碘单质是温和的氧化剂,适合用作有机合成,例如卤仿反应。
- 同样道理,碘离子也是种温和的还原剂,能参与桑德迈尔反应。
- 碘能和碳碳双键及三键发生加成反应。油脂化学方面用此反应测量碘价。
- 分析化学上广泛采用碘量法来测定氧化剂和还原剂的当量。
- 由于碘单质的脂溶性较强,碘蒸气可以使隐藏的指纹显露。
- 碘化氮是一种没有实用价值,但偶尔用于科普示范的炸药。
- 液流电池的电解质常含有碘离子。
- 含碘离子的母液或防冻剂能跟蛋白质晶体结合,为X-射线衍射提供相位资讯[3]。
- 四碘汞钾(K2HgI4 ),又称为内斯勒试剂,常用于灵敏的氨斑点试验中。
- Cu2HgI4 常被用于生物碱的沉淀试剂。
- 碘离子与碘酸根离子常用在定量容量分析,例如碘离子滴定中与碘钟反应(以淀粉作为检验碘分子出现的试剂,二者会生成黑蓝色的错合物)
- 在甲基酮的碘仿反应中也会使用到碱性碘水溶液。碘与淀粉的反应也仍用于检验含淀粉的纸印制成之假币。
人类营养问题
碘是人体必需的矿物质,用以制造甲状腺素以调控细胞代谢、神经性肌肉组织发展与成长(特别是在出生胎儿的脑部)[4]。碘缺乏症[5][2](页面存档备份,存于互联网档案馆)是造成可避免性脑损害疾病最常见的因素,全世界估计有五千万人深受影响。根据英国地质学勘查协会(British geological survey)关于IDD((页面存档备份,存于互联网档案馆))的调查:全球碘摄取不足的人口估计有20亿,其中学龄儿童有2亿8千5百万[6];其中呆小症(cretinism)约570万人,脑部损害(brain damage)2600万人,甲状腺肿(Goiter)6亿5500万人[7];这些人口则主要集中于中非、东南亚、中亚、中欧、东欧等地
碘缺乏
怀孕期间严重的碘缺乏会损害胎儿发展,对脑部发育的伤害最为严重,可导致智商明显低落,因为胎儿与新生儿时期神经组织髓鞘化作用最活跃,并且受甲状腺素控制。缺碘严重者造成呆小症(cretinism)、流产、死胎。其他慢性碘缺乏较普遍的影响有神经性肌肉不足、认知低下。初期的临床症状是甲状腺体积增大,因缺碘反而增加甲状腺摄取这血液中的碘的效能,是对缺碘补偿反应,最后会在脖子形成可见的肿块,称甲状腺肿(Goiter),可用触诊或超音波扫描法诊断,这也是世界卫生组织(WHO(页面存档备份,存于互联网档案馆))之国际碘缺乏防治小组所推荐的碘营养评估指标之一。
碘缺乏时会导致TSH升高,这是因为甲状腺素无法合成,又不断利用负回馈机制刺激促甲状腺激素(TSH)分泌所造成。
碘过量
碘过量会有以下症状:甲状腺炎(thyroiditis)、甲状腺肿(Goiter)、甲状腺机能不足或亢进、乳头状甲状腺癌、过敏反应…。碘摄取过量时,甲状腺机能反而受损,初期反应是血中促甲状腺激素(thyroid stimulating hormone,TSH)高于正常值;摄取量高达750 μg/d时,TSH浓度明显上升。由于TSH浓度升高反映甲状腺机能有不足的危险,因此在碘摄取充足条件下,以血浆TSH浓度升高作为碘过量危害之指标,缺碘导致的TSH上升则不列入考虑。
中国对碘营养监测和碘盐质量检测结果显示,多数省级行政区的平均尿碘值已经高于世界卫生组织推荐的适宜水平,因此不缺碘地区特别是沿海的高碘地区要尽量少食用海带(每1000克干海带含碘240mg,而成人每日碘摄取量上限为1mg),紫菜(每1000克干紫菜含碘180mg)等含碘量高的食物,这样可以预防碘过量疾病的发生。[8]
“碘过敏”是接触含碘物质造成过敏的误称,实际上通常是鱼类或贝类过敏,或者是对造影剂、碘酊过敏。从理论角度说,摄入碘盐这样的无机碘不可能导致过敏;事实上也从来都没有一例能够确认是碘元素导致过敏的案例。考虑到造影剂过敏可能会较为危险,医学上一般还是习惯避免在有其他过敏时使用。[9]
人体含量与分布
成人体内约含碘25~36 mg,大部分的碘集中在甲状腺(thyroid)内供合成甲状腺素(thyroxine)之用,正常的情况下约有15~20 mg,但在缺碘的情况下则可能少于20 μg。人体内的甲状腺素由三碘甲状腺原氨酸(T3,triiodothyronine)与四碘甲状腺原氨酸(T4,tetraiodothyronine)组成,其中碘分别占了59%与65%。除了甲状腺外,其余少部分碘则分布于肌肉、皮肤、血液和中枢神经系统等组织中。
吸收、储存与排泄
摄取进体内的碘有的是和氨基酸结合;或是以游离状态如碘酸根(IO3−)以及碘离子(I−)形式存在。碘酸根在人体内可被谷胱甘肽还原成碘离子。碘离子的形式在人体的吸收效率很好,大部分都能在消化道被吸收。而和氨基酸结合以及其他有机形式的碘也能被吸收,但效率较差。吸收之碘以碘离子(I−)状态存在血中,送至甲状腺储存,以用来合成甲状腺素。食物中的甲状腺素T4及T3可直接吸收,因此医药上能直接口服T4,作为缺乏甲状腺素的治疗方式。
因为肾脏没有保留碘离子的机制,多余的碘多从尿液排出,少数从粪便以及汗水排出。
生理与生化功能
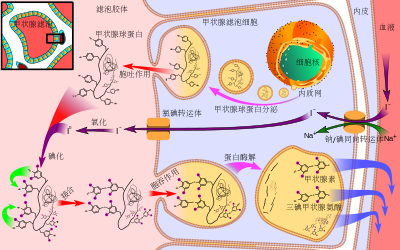
碘最主要的功能即是合成甲状腺素。甲状腺素是一种重要的荷尔蒙,主要功能是促进代谢,刺激组织生长、成熟和分化,加快心跳,增加心输出量等。许多其他荷尔蒙需要协同甲状腺素才能达到有效的作用,例如在幼年发育过程中,生长激素和甲状腺素共同作用才能使幼童正常生长发育。甲状腺素有thyroxine(T4)和triiodothyronine(T3)两种形式,血中以T4浓度较高,但活性以T3较高。另有一种reverse T3(rT3),是不具活性的代谢产物。不同的脱碘酶(5'-deiodinase、5-deiodinase)可将T4转换成T3以及rT3,借此调控甲状腺素在体内的活性。
甲状腺由许多囊泡组成,内充满胶状蛋白质,囊泡外围是一层甲状腺细胞。甲状腺细胞将碘离子经由 钠钾泵,消耗ATP,送到细胞内并氧化成碘(I)。接着碘和甲状腺球蛋白(thyroglobulin)上的酪氨酸残基结合,形成monoiodotyrosine(MIT),再加上一个碘则形成diiodotyrosine(DIT)。在囊泡中,两个DIT偶合形成T4<图>;DIT和MIT偶合则形成T3<图>。此时T4以及T3都还结合在甲状腺球蛋白上,等到要释出的时候,整个复合体会送到甲状腺细胞,甲状腺球蛋白会在细胞中被水解,T4以及T3便可被释放到血液中。血液中,T4和T3大多结合在运输蛋白上,送到目标组织,进入目标细胞的细胞核中,促进或抑制基因表现,达到控制细胞生长代谢的目的。
食物来源
人体所需的碘大部分来自饮食,诸如:海苔、海带、龙虾、贝类、绿色蔬菜、蛋类、乳类、谷类等[10],其中以海带、海藻等食物含碘量最为丰富。预防碘之缺乏可采取食品加碘强化的措施,在食盐中添加适量之碘化钾(potassium iodide)、碘酸钾(potassium iodate)等来补充碘的摄取。世界卫生组织建议每千克食盐可添加20至40毫克碘质。国际食品法典委员会(Codex Alimentarius Commission)的食盐标准中有关碘化食盐(iodinated salt),建议各国卫生当局应评估当地碘质缺乏的情况,以制订食盐中最高及最低的含碘量。WHO/FAO食品添加物联合专家委员会(JECFA(页面存档备份,存于互联网档案馆))评估了碘的安全性,建议碘的暂定每日最高容许摄入量为每公斤体重17 μg。
需要量评估方法
- 尿液碘排泄量:
- 甲状腺体积:
- 甲状腺碘的新陈代谢速率:
- 血浆促甲状腺激素(thyroid stimulating hormone ,TSH)浓度:
建议摄取量
因碘无法长久储存于身体中,故每天皆需摄取少量的碘。建议每天碘的摄取量如下:0~7岁约90μg;7~12岁约120μg;12岁以上约150μg,怀孕及哺乳妇女不仅需要满足自己的机体需要,还要满足胎儿发育所需,如缺碘易造成胎儿生长缓慢、智力异常,故所需摄取量较一般成人高约200μg。
碘的建议摄取量会受碘的吸收量而有所增减,一般而言无机态碘化合物的吸收率通常90%以上。
有些食物含有甲状腺肿素(goitrogens),会干扰甲状腺素合成与利用,例如:树薯中亚麻苦甘(linamarin)代谢生成的硫氰化合物;十字花科植物,如:高丽菜。受污染河井的腐质物、含碘量高之放射显影剂、食品添加物、药物、皮肤或口腔除臭剂、水净化剂等等也可能干扰碘的利用。
碘摄取过量对身体有害,每天1500μg对成人有害,故订有碘的上限摄取量(tolerable upper intake levels,UL)。1~3岁孩童为200μg,4~6岁为300μg,7~9岁为400μg,10~12岁为600μg,13~15岁为800μg,16岁之后则均为1000μg。怀孕期和哺乳期因为对碘耐受力并不改变,故也以1000μg/d为上限摄取量。至于0~12个月婴儿则不订定上限摄取量,因为其碘来源应限于母乳、婴儿配方与日用食物。
- 氢碘酸
- 碘化氢
- 碘酸
- 医疗用碘
- ^ 1.0 1.1 CRC Handbook of Chemistry and Physics 97th Edition. 2016-06-24: 4–66. ISBN 1-4987-5428-7 (英语).
- ^ Glinka, N. L. General Chemistry 2. Mir Publishing. 1981.
- ^ Phase Determination Using Halide Ions (By Miroslawa Dauter and Zbigniew Dauter) [1] (页面存档备份,存于互联网档案馆)
- ^ Gropper SS, Groff JL, et al.(2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 468-473. Wardswirth, ISBN 978-0-534-55986-1
- ^ iodine deficiency disorder. [2018-11-12]. (原始内容存档于2012-10-18).
- ^ 存档副本. [2008-01-03]. (原始内容存档于2015-05-08).
- ^ mailto:www-bgs@bgs.ac.uk, British Geological Survey 1998 - 2017 (c)NERC. British Geological Survey Website - Page not found. www.bgs.ac.uk. [2018-11-12]. (原始内容存档于2018-11-12).
- ^ 中国高碘地方性甲状腺肿的发现历程和分布概况 (PDF). [2018-11-12]. (原始内容存档 (PDF)于2017-01-12).
- ^ UCSF Department of Radiology & Biomedical Imaging, Iodine Allergy and Contrast Administration (页面存档备份,存于互联网档案馆)
- ^ 存档副本. [2008-01-03]. (原始内容存档于2008-01-15).
- 元素碘在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 碘(英文)
- 元素碘在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素碘在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 碘(英文)

