| 此条目需要扩充。 (2018年8月1日) |
钼(拼音:mù,注音:ㄇㄨˋ,粤拼:muk6;英语:Molybdenum),是一种化学元素,其化学符号为Mo,原子序数为42,原子量为95.95 u,是一种银灰色的过渡金属。因为在过去钼矿石往往与铅矿石混淆,因此Molybdenum之名来自新拉丁语 molybdaenum,后者来自古希腊语 Μόλυβδος molybdos,意思是铅。[3]钼矿石在历史上被人们所熟知,但该元素的发现(即从其它金属中区分出来)是在1778年,由卡尔·威廉·舍勒识别。该金属在1781年第一次被彼得·雅各·耶尔姆分离得出。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
金属:灰色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钼(Molybdenum)·Mo·42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 6 ·5·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 95.95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d5 5s1 2, 8, 18, 13, 1 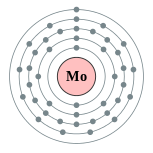 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 卡尔·威廉·舍勒(1778年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 彼得·雅各布·海基尔姆(1781年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 10.28 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 9.33 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 2896 K,2623 °C,4753 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 4912 K,4639 °C,8382 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 37.48 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 598 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 24.06 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 6, 5, 4, 3, 2, 1[1], -1, -2 (强酸性)[来源请求] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.16(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:684.3 kJ·mol−1 第二:1560 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 139 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 154±5 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 体心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)53.4n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 138 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)4.8 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 329 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 126 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 230 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.31 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 5.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 1530 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 1500 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7439-98-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钼的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钼在地球上不以纯金属态存在,而是在矿物中以各种氧化物的形式出现。在单体元素形式中,钼是一种银灰色金属,呈灰口铸铁颜色,是所有元素中熔点排名第六高。它很容易在合金中形成坚硬、稳定的碳化物,因此,世界上大多数的钼(约80%)都被用作钢的添加剂,包括高强度合金和高温合金等。
大多数钼化合物微溶于水,但是当含钼的矿物与氧气和水接触时可以形成钼离子MoO2−4。在工业上,钼化合物(世界上约有14%的产品)被用于高压和高温应用品,如色素或催化剂等。
钼是包括人类在内所有真核生物必须的微量膳食矿物质,是真核生物必需的元素中原子序最大的金属元素。含钼的各种辅因子酶在生物体中具有多样功能。目前,一些细菌在打破大气中氮分子的化学键上最常用的催化剂是含钼酶,能起到生物固氮作用。在细菌和动物中,虽然只有细菌和蓝藻酶会参与到固氮活动中,但已知的含钼酶至少有50种。这些固氮酶含钼的形式与其它含钼酶不同,但都有氧化形式的钼,用以搭配钼辅因子。不过并非所有细菌都用到钼,在一些细菌和古菌中,与钼同族的钨起到类似钼在高等生物中的生理作用。


在18世纪,辉钼矿往往被认为是铅矿。1778年瑞典的卡尔·威廉·舍勒从辉钼矿中提取出了氧化钼,根据舍勒的启发,1781年他的朋友,同是瑞典人的彼得·雅各布·海基尔姆把钼土用“碳还原法”分离出新的金属钼。
物理性质
在纯物质的状态下,钼是银灰色的金属,莫氏硬度为5.5。它的熔点为2,623 °C,沸点为4639°C(4,753 °F),在天然存在的元素中,只有钽,锇,铼,钨和碳有有高于钼的熔点。[4]钼的弱氧化起始于300 °C (572 °F)。在商用金属中,钼是热膨胀系数最低的一种。[5]当钼丝的直径从约50-100 nm减小到10 nm时,钼丝的拉伸强度增加三倍(10 GPa~30 GPa)。[6]
同位素
目前有35种已知的钼同位素,原子量介于83到117之间,其中有四种亚稳态同核异构物(nuclear isomers),天然存在的同位素有七种,其原子量为92, 94, 95, 96, 97, 98, and 100。在天然存在中的七种同位素,只有钼-100是不稳定的。[7]
钼-98是含量最高的同位素,占钼总比例的24.14% 。钼-100拥有1019年的半衰期,并会经过双重β衰变后变成钌-100 ,质量数介于111和117之间的钼同位素都拥有约150ns的半衰期。[7][8]所有钼的不稳定同位素会衰变成铌,锝和钌的同位素。[8]
最常见的同位素应用为钼-99,钼-99为衰变后的产物,它是短寿命伽玛放射性同位素锝-99m的母体同位素,应用于医学成像。[9]于2008年the 代尔夫特理工大学申请了专利,内容为以钼-98为基础生产钼-99。[10]
化合物以及化学性质
钼是一种过渡金属,其电负度为2.16,标准原子量为95.95 g/mol。[11][12]
在室温下,钼不会与氧气或水发生明显反应,在600 °C以上会氧化,并生成三氧化钼。
2 Mo + 3 O2 → 2 MoO3
高温下,三氧化钼具有挥发性并会升华。这可以避免形成连续性的保护性氧化层(氧化层可以保护金属,避免进一步氧化到内部)。[13]
钼有多个氧化态,最稳定存在的为+4和+6。钼化合物的化学性质比较相似于钨而非铬。例如:钼三价与钨三价化合物具有相似的不稳定性,而铬三价化合物则稳定性较好。
钼化合物的最高氧化态为六价,化合物为三氧化钼。常见的硫化物为二硫化钼。[14]
三氧化钼可溶于强碱性的水溶液中,并形成钼酸盐类,钼酸盐的氧化性比铬酸盐较弱,但两者会在低pH值环境下,缩合成氧错离子,像是[Mo7O24]6− and [Mo8O26],多钼酸盐可以加入其他金属离子,形成多金属氧酸盐。[15]
P[Mo12O40]3−为深蓝色化合物,用于磷的光谱检测中。[16]钼的各种氧化价数,可从各种钼的氯化物中见得。[14]
| 氧化物 形态 |
例子[17] |
|---|---|
| −2 | Na2[Mo2(CO)10] |
| 0 | Mo(CO)6 |
| +1 | Na[C6H6Mo] |
| +2 | MoCl2 |
| +3 | Na3[Mo(CN)]6 |
| +4 | MoS2 |
| +5 | MoCl5 |
| +6 | MoF6 |

发展历史
合金
钼主要用于钢铁工业。 0.3%的钼添加剂可提高几种钢种的铸铁强度和耐腐蚀性[18]。耐锈和耐酸的钼钢合金含有0.4至3.5%的钼。表面处理可以提高含钼钢的机械强度[19]。一些快速钢的钼含量也可达到14.5%。钼替代某些钢种的镍。在这种情况下,获得Cr-Mo钢代替Cr-Ni钢。目前,钼还用于生产耐热超级合金。
物质状态的其他应用
化合物应用
MoO3催化剂用于许多有机化学过程,例如重整过程,石油馏分的脱硫[20],邻苯二甲酸酐,马来酸酐和蒽醌等。产生其混合氧化物用作丙烯醛和丙烯酸生产中的催化剂[21][22][23][24]。钼化合物用于颜料,染料,试剂,润滑剂,催化剂,缓蚀剂,陶瓷助剂,微量元素等。产生。硼化钼,碳化物,硅化物具有半导体特性。
钼作为辅酶
钼是大多数生物中的必需元素。事实上,早期的地球海洋缺乏钼可能会对真核生物(包括所有植物和动物)的演化产生强烈影响。
目前已经鉴定出至少50种酶含有钼,主要存在于细菌中。这些酶包括醛氧化酶,亚硫酸氧化酶和黄嘌呤氧化酶。 就功能而言,钼酶催化氧化反应,有时会在调节氮,硫和碳的过程中还原某些小分子。在一些动物和人类中,黄嘌呤氧化酶催化黄嘌呤氧化成尿酸,这是一种嘌呤分解代谢过程。黄嘌呤氧化酶的活性与体内钼的量含成正比。然而,极高浓度的钼反而会抑制嘌呤分解代谢和其他过程。钼的浓度也会影响蛋白质的合成,代谢和生长。
Mo是大多数固氮酶中的组成成分。固氮酶催化大气氮气生产氨:
N2+8H++8e-+16ATP+16H2O→2NH3+H2+16ADP+16Pi
铁钼辅因子的生物合成是一个复杂的过程。
钼酸盐在体内以MoO42−形式运输。
人体新陈代谢与缺乏
钼是必需的微量膳食元素。目前已知哺乳动物含钼酶有四种,酶中的钼以钼喋呤辅因子(Moco)存在,是酶的活性部位。亚硫酸盐氧化酶,黄嘌呤氧化还原酶,醛氧化酶和线粒体酰胺肟还原酶。严重缺乏钼的人的亚硫酸盐氧化酶功能很差,并且很容易对食物中的亚硫酸盐产生毒性反应。人体每公斤体重含有约0.07毫克的钼,肝脏和肾脏中的浓度较高,而脊椎骨中的浓度较低。钼也存在于人的珐琅质中,可能有助于防止牙龈腐蚀。
目前尚未发现钼对人类的急毒性,毒性取决于其化学状态。研究显示,某些钼化合物,对老鼠的半数致死剂量(LD50)低至180 mg / kg,虽然没有人类毒性数据,但动物研究表明,长期摄入超过10毫克/天的钼可引起腹泻,生长迟缓,不孕,出生体重低和痛风;还会影响肺部,肾脏和肝脏。钨酸钠是一种竞争性的钼抑制剂,饮食钨会降低组织中钼的浓度。
从中国北方到伊朗的地理范围内土壤中的钼浓度低导致一般饮食的钼缺乏,此与食道癌的发病率增加有关。与土壤中钼含量较高的美国相比,生活在这些地区的人患食道鳞状细胞癌的风险大约高16倍。
长时间以缺钼的全营养注射剂(静脉输液营养)会造成钼的缺乏。导致血液中的亚硫酸盐和尿酸盐的水平过高,类似钼辅酶缺乏症。据推测,由于这种原因导致的钼缺乏主要发生在成人身上,所以神经系统影响并不像先天性辅助因子缺乏那样明显。
钼是酶系统的重要组成部分,对于某些依赖酶的过程(尤其是铁的代谢)的正常运行是必需的。它支持体内的体内平衡并增强骨骼健康。研究表明,钼可能有助于增强免疫系统。钼还可能有助于诱发安宁和恢复性的睡眠。
疾病
铜-钼拮抗作用
- ^ Molybdenum: molybdenum(I) fluoride compound data. OpenMOPAC.net. [2007-12-10]. (原始内容存档于2011-07-21).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Lide, David R. (编). Molybdenum. CRC Handbook of Chemistry and Physics 4. Chemical Rubber Publishing Company. 1994: 18. ISBN 0-8493-0474-1.
- ^ R., Lide, David. CRC handbook of chemistry and physics. 74th ed. Boca Raton: CRC Press https://www.worldcat.org/oclc/31375983. 1993. ISBN 0849304741. OCLC 31375983. 缺少或
|title=为空 (帮助) - ^ John., Emsley,. Nature's building blocks : an A-Z guide to the elements. Oxford: Oxford University Press https://www.worldcat.org/oclc/46984609. 2001. ISBN 0198503415. OCLC 46984609. 缺少或
|title=为空 (帮助) - ^ Shpak, Anatoly P.; Kotrechko, Sergiy O.; Mazilova, Tatjana I.; Mikhailovskij, Igor M. Inherent tensile strength of molybdenum nanocrystals. Science and Technology of Advanced Materials. August 2009, 10 (4): 045004. ISSN 1468-6996. PMC 5090266
 . PMID 27877304. doi:10.1088/1468-6996/10/4/045004.
. PMID 27877304. doi:10.1088/1468-6996/10/4/045004.
- ^ 7.0 7.1 Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. The Nubase evaluation of nuclear and decay properties. Nuclear Physics A: 3–128. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 8.0 8.1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A. H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Armstrong, John T. (2003). "Technetium". Chemical & Engineering News. Retrieved 2009-07-07
- ^ Wolterbeek, Hubert Theodoor; Bode, Peter "A process for the production of no-carrier added 99Mo". European Patent EP2301041 (A1) ― 2011-03-30. Retrieved on 2012-06-27.
- ^ Wieser, M. E.; Berglund, M. Atomic weights of the elements 2007 (IUPAC Technical Report) (PDF). Pure and Applied Chemistry. 2009, 81 (11): 2131–2156. doi:10.1351/PAC-REP-09-08-03.
- ^ Meija, J.; et al. Current Table of Standard Atomic Weights in Alphabetical Order: Standard Atomic weights of the elements. Commission on Isotopic Abundances and Atomic Weights. 2013. (原始内容存档于2014-04-29).
- ^ Davis, Joseph R. Heat-resistant materials. Molybdenum (ASM International). 1997: 365. ISBN 0-87170-596-6.
- ^ 14.0 14.1 Holleman, Arnold F.; Wiberg, Egon; Wiberg, Nils. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 1096–1104. ISBN 3-11-007511-3.
- ^ Pope, Michael T.; Müller, Achim. Polyoxometalate Chemistry: An Old Field with New Dimensions in Several Disciplines. Angewandte Chemie International Edition. 1997, 30: 34–48. doi:10.1002/anie.199100341.
- ^ Nollet, Leo M. L. (编). Handbook of water analysis. New York, NY: Marcel Dekker. 2000: 280–288. ISBN 978-0-8247-8433-1.
- ^ Schmidt, Max. VI. Nebengruppe. Anorganische Chemie II.. Wissenschaftsverlag. 1968: 119–127 (德语).
- ^ Influence of Mo alloying on pitting corrosion of stainless steels used as concrete reinforcement (PDF). Rev. Esc. Minas.
- ^ Wear and Corrosion Study of Plasma Nitriding F53 Super duplex Stainless Steel (PDF). Mat. Res.
- ^ NATURE OF THE ACTIVE PHASE IN HYDRODESULFURIZATION: MOLYBDENUM CARBIDE SUPPORTED ON ACTIVATED CARBON (PDF). C.T.F Cienc. Tecnol. Futuro.
- ^ The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts. J. Catal. 2014, 311: 369-385.
- ^ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid. J. Catal. 2012, 285: 48-60.
- ^ Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol. ACS Catalysis. 2013, 3(6): 1103-1113.
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts. Berlin. 2011.
- 元素钼在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钼(英文)
- 元素钼在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钼在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钼(英文)
- Lu Le Laboratory 钼金属的介绍

