| 此条目的引用需要进行清理,使其符合格式。 (2019年12月3日) |
氖(拼音:nǎi,注音:ㄋㄞˇ,粤拼:naai5;英语:Neon;旧译氝,讹作氞),是一种化学元素,其化学符号为Ne,原子序数为10,原子量为20.1797 u。氖在标准状态下是一种无色无味的惰性单原子气体[7],其密度是空气的三分之二。它在1898年和氪及氙被发现为三种空气中就有的稀有气体之一,氖是上述三种稀有气体中第二个被发现的,因为它亮红的放射谱线,它马上就被认出是一个新元素。氖这个名字是从希腊文翻译过来的,意思是新的。氖是惰性的,且没有任何不带电的氖的化合物曾被发现。目前所知的氖的化合物仅有离子化合物,而它们是被范德华力束缚在一起的。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
气体:无色;在高压电场发出橙红色光芒 氖的光谱线 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 氖(Neon)·Ne·10 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 稀有气体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 18 ·2·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 20.1797(6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | 1s2 2s2 2p6 2, 8 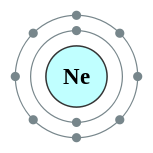 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 预测 | 威廉·拉姆齐(1897年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 威廉·拉姆齐和莫里斯·特拉弗斯[1][2](1898年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 气体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 0.9002 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点时液体密度 | 1.207[3] g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 24.56 K,-248.59 °C,-415.46 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 27.07 K,-246.08 °C,-410.94 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相点 | 24.5561 K(−249 °C),43[4][5] kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 44.4 K,2.76 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 0.335 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 1.71 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 20.786 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 未知 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:2080.7 kJ·mol−1 第二:3952.3 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 58 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 反磁性[6] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 49.1x10-3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速 | (气体,0 °C)435 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 654 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-01-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氖的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在宇宙的核合成的过程中,大量的氖从恒星的氦核作用中产生。虽然氖在宇宙和太阳系中十分常见(氖在宇宙的含量为第5多,仅低于氢、氦、氧和碳),但其在地球上十分稀少,大约只占总空气体积的18.2ppm(大约与其摩尔分数相同),且在地球表面上含量更少。因为氖为高度挥发的物质且无法合成固态的化合物,所以其在地球及其他类地行星都十分稀少。氖会在新生太阳的温暖下从微行星逸散。虽然和前述原因不同,但氖甚至在木星的外层大气略有些消耗。氖也比空气还要轻[8],使其甚至能从地球的大气层逸散。
氖在低电压的氖灯、高电压放电管和霓虹灯下会发出明显的红橙色光[9][10]。氖也应用在等离子管跟冷冻设备中,也有少数的商业用途。它的商业来源主要由液态空气分馏而来。因为空气是唯一的来源,所以氖气较氦气为贵。
氖是第二轻的稀有气体,仅次于氦。它在真空放电管里发出橙红色的光。氖也拥有所有元素中最小的液态温度范围:24.55K到27.05K(-248.45 °C到-245.95 °C,或-415.21°F到-410.71 °F)。在单位体积中,它的制冷能力高出液态氦40倍,比液态氢高三倍。[3]在大多数情况下,它是一种较氦廉价的冷却剂。[11][12]氖是非常典型的气体,非常不容易变成液体或固体,必须要在-248.6°C时才会凝固成固态。氖是一种非常不活泼的元素,几乎不和其他元素相化合,属于 惰性 气体的一种。氖的汽化膨胀比(液体时体积,和在室温一大气压力下,气体时体积的比)为1:1445,是气体中最高的[13]。
在所有稀有气体中,氖的放电在等电压和电流情况下是最强烈的。氖在真空放电管中的颜色为肉眼可见的橙红色,是因许多放射谱线在此范围内所导致。氖亦有一条明亮的绿色谱线,但在一般情况下无法辨识,需以分光器色散后才可看出。[14]
日常生活中有两种常见的氖照明应用。氖灯体积普遍较小,大多在100~250伏特的电压下运作。[15]它们被广泛运用在不断电指示灯和电路测试设备,但发光二极管(LED)如今取代了氖灯在上述应用中的地位。这些简单的氖灯装置是等离子显示器及等离子电视的先驱。[16][17]通常填充氖的霓虹灯在更高的电压下运作(2~15千伏特),而其灯管一般有数米长。[18]灯管经常被塑造成各种形状和文字作为招牌,以及应用在建筑和艺术方面。

氖经常被使用在霓虹灯做广告,散发出显眼的亮橙红色光。虽然其它颜色的霓虹灯经常被称为氖灯,但它们使用不同种类的稀有气体或不同颜色的萤光灯。其它应用有:
- 真空管
- 高压指示器
- 避雷针
- 波频计
- 电视机荧光屏管
- 氦-氖激光:半导体器件制造常用
- 液氖被用作冷却液
- 用于高能物理研究,让氖充满火花室来探测微粒的行径。
- 填充水银灯和钠蒸气灯。
液态和气态氖相对较昂贵,液态氖的价格可超过液态氦的55倍以上。造成氖价格高昂的主因是氖蕴含量的稀少,与氦不同,氖只能从空气中取得。
氖的三相点温度(24.5561 K)在国际实用温标中被定义为一固定值。[19]
氖在1898年被英国化学家威廉·拉姆齐爵士(William Ramsay)和 莫理斯·特拉维斯(Morris Travers)在伦敦发现[20] 。拉姆齐爵士冷凝空气形成液体后,逐渐加热液态空气,使组成空气的物质因沸点不同,沸腾时分离。从1898年的五月底开始,拉姆齐爵士进行了六个星期的实验。实验结果得到了已被发现的氮、氧、氩,并将剩余的气体大致按其丰度分离。剩余气体中,第一个被发现的是氪,在氪被分离后,发现一种在辉光放电下会发出明亮红光的气体。此气体在六月被确定它的存在,被命名为氖,为希腊文中类似拉丁语novum(意为“新的”)[21]的字,此命名由拉姆齐儿子建议。当气态氖在激发态时会放出明亮的红橘色光。特拉维斯后来写到:“来自管子中的赤红色火焰是一个令人难以忘记而且不言而喻的一幕。”[22]
第二种气体和氖一起在报告中被提到,和氩有大约相同的密度但有不同的光谱,拉姆齐和特拉维斯将它命名为metargon。[23] 但是,随后的光谱分析显示metargon其实是混杂一氧化碳的氩气。最后,在1898的九月,这个研究团队用相同的方法发现了氙。[23]
因氖在自然界的含量不高,这点阻碍它在 Moore tubes的应用, Moore tubes为一种使用氮气且在十九世纪早期被商业化的照明。1902之后,乔治·克劳德的公司─法国液空集团生产工业用氖当作他空气液化事业的副产品。在1910的十二月,演示了以密封氖气管为基础的现代霓虹灯。克劳德曾短暂地售出用于室内居家照明的霓虹灯管在1912,克劳德的协会开始销售氖放电管做为一种吸引目光的广告标志,效果比上次成功。氖放电管在1923年被引入美国,由于洛杉矶洛杉矶帕卡德汽车经销商购买了两个大型霓虹灯标志。发光和引人注目的红色使得霓虹灯广告完全不同于竞争对手。[24]霓虹灯的强烈色彩和活力等同于当时的美国社会,暗示著“进步的世纪”,并将城市转变为充满了发光广告和“电子灯板建筑”的令人轰动的新环境。[25][26],虽然霓虹灯亮度高,但市场不大,因为屋主多半不喜欢霓虹灯光的颜色。
氖在对了解原子本质的基础研究上发挥作用:当J.J.汤姆孙在研究阴极射线的组成时,将氖离子流打入电场和磁场中,用照相底片观察它的偏转。汤姆孙观察到有两片分开的光在照相底片上。(如图)汤木生最后做出结论:有些在氖气中的氖原子质量比剩余者高。虽然汤木生当时不太了解这个现象,但这是历史上第一次发现稳定原子的同位素。汤木生的装置则是我们现代质谱仪的简略版。

在标准状态下氖是单原子的气体。在地球大气层中氖非常稀少,只占其65,000分之一。工业使用液化空气冷却分离的方法来生产氖。
氖的稳定同位素可在某些星球中产生。Ne-20可由碳的核聚变反应或恒星核合成中的碳聚变反应产生。此反应需在1亿克氏温度以上的环境下进行,因此只有质量超过太阳三倍以上之星球的核心符合条件。[27][28]
氖在宇宙中大量存在;它是宇宙中总质量第五大的化学元素,排序于氢、氦、氧和碳之后(见化学元素)。[29]氖和氦相同,在地球中相对稀少,因其相对较轻,在极低温时的高蒸气压及安定的化学性质,其性质可避免聚集可压缩的气体及尘云,因而形成了如地球般较小而温暖的固体星球。
氖为单原子气体,因此其分子量会比主要构成地球大气的双原子氮和氧小;填充氖气的气球在空气中将会上升,但速度比氦气球慢。[30]
氖在宇宙中约占1/750;在太阳和原星系中的星云则约占1/600。伽利略号太空船在大气探测中发现即使在木星的高层大气,氖的含量仍约为太阳的十分之一,只占1/6000。这可能代表着就算是从外太阳系带氖到木星的冰雪构成微行星,还是因为温度过高以至于无法维持大气中氖含量(木星上其它更重的稀有气体含量是太阳的数倍)。[31]
氖在地球大气层占体积的1/55000或18.2ppm(约略等于其摩尔分数),或空气质量的1/79000。它在地壳中含量较少。工业上利用低温分馏液态空气的方式制造氖气。[3]
在2015年的8月17日,根据月球大气与粉尘环境探测器(LADEE)的探测结果,NASA的科学家报告在月球散逸层(外气层)侦测到氖。[32]
氖是由低温空气分离设备中的空气产生的。主要由氮气、氖气和氦气组成的气相混合物从高压空气分离塔顶部主冷凝器中取出,并送入侧塔底部进行氖气精馏[33]。然后可以从氦中进一步纯化。
全球约70%的氖由乌克兰所生产[34],作为俄罗斯钢铁生产之副产品[35]。截至2020年,Iceblick公司在乌克兰的敖德萨和俄罗斯首都莫斯科设有工厂,供应全球65%的氖以及15%的氪和氙[36][37]。
2014年,俄罗斯吞并克里米亚后,全球氖的价格上涨了约600%[38],促使一些半导体芯片制造商从俄罗斯和乌克兰的供应商转向中国供应商[39]。2022年,俄罗斯全面入侵乌克兰导致乌克兰的两家氖制造厂的关闭,它们的产量约占全球供应量的一半[38],并可能加剧COVID-19疫情以来的芯片短缺[37][36],这可能会进一步将氖的生产转移到中国[39]。
氖是第一个p区元素的稀有气体,第一个真正符合八隅体的元素。它是惰性的(就像比它轻的同族元素-氦一样),没有发现具有与氖原子形成共价键的中性分子。使用光谱和质谱分析观察到的含氖的离子包括Ne+、(NeAr)+、NeH+和(HeNe)+。氖的水合物很不稳定。[3]固态氖笼型水合物是用冰和氖气在0.35–0.48 GPa和−30 °C环境下所制造出来的。[40] 其中,氖原子并不是和水键结,并且它可自由地穿透这种材料。若要从该笼型水和物中得到氖,可以将它放入真空室好几天,就会得到Ice XVI(水的最不致密晶型)和氖。[41]
常见的鲍林电负性标度是依化学键能量,但这种方法显然不适用于测量惰性的氦和氖。不过,在艾伦电负性标度(Allen electronegativity scale)是以原子能量去定义电负性。其中,Allen定义氖为电负性最高的元素,紧跟在后的是氟和氦。
氖是第二轻的稀有气体。已知的氖的同位素共有11种,包括氖17至氖27,其中有三个稳定同位素:氖-20(90.48%)、氖-21(0.27%)和氖-22(9.25%)。氖-21和氖-22 部分自然存在、部分由核分裂产生 (即由其他带有中子的核素或其他环境中的粒子的核反应产生),它们的丰度变化是已知的。相较之下,氖-20(由恒星的核聚变反应产生的主要原始同位素)不被认为是核分裂产物或放射性核素。地球上氖-20含量变化的原因一直被激烈地争论。[42]
产生氖同位素的主要核反应来自镁-24和镁-25的中子捕获和α衰变,其产物分别是氖-21和氖-22。α衰变主要是从铀衰变系列而来的,而中子则是由α衰变的次级反应产生。这个反应系列导致在含铀岩石中(比如花岗岩)可以观察到较高比例的氖-21和氖-22。[43] 氖-21也可能是由氖-20从自然界吸收一个中子而产生。
此外,在裸露岩层中的同位素分析证实了放射性(宇宙射线)氖-21的生成。这个同位素是由镁、钠、硅和铝的散裂反应产生的。借由分析这三种同位素,可以将宇宙部分的氖与岩浆里的氖和核反应产生的氖区分开来。这表示氖可能可以用来成为测定宇宙中岩石和陨石的暴露时间。[44]
类似于氙,火山气体含有的氖中,氖-20及氖-21的含量相对高于氖-22。这些地幔中的氖同位素含量与大气中的氖不同。氖-20的高含量相异于地球上的其他稀有气体,可能是来自太阳产生的氖。金刚石中氖-20的含量也比较高,进一步说明这个高含量可能确实是来自于地球形成前的太阳系星云。[45][46]。
- ^ Ramsay, William; Travers, Morris W. On the Companions of Argon. Proceedings of the Royal Society of London. 1898, 63 (1): 437–440. doi:10.1098/rspl.1898.0057.
- ^ Neon: History. Softciências. [2007-02-27]. (原始内容存档于2007-03-14).
- ^ 3.0 3.1 3.2 3.3 Hammond, C.R. The Elements, in Handbook of Chemistry and Physics 81st edition (PDF). CRC press. 2000: 19 [2011-03-30]. ISBN 0849304814. (原始内容存档 (PDF)于2008-06-26).
- ^ Preston-Thomas, H. The International Temperature Scale of 1990 (ITS-90). Metrologia. 1990, 27: 3–10 [2011-03-30]. (原始内容存档于2011-04-20).
- ^ Section 4, Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements. CRC Handbook of Chemistry and Physics 85th edition. Boca Raton, Florida: CRC Press. 2005.
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Group 18 refers to the modern numbering of the periodic table. Older numberings described the rare gases as Group 0 or Group VIIIA (sometimes shortened to 8). See also Group (periodic table).
- ^ Wilson, Hugh F.; Militzer, Burkhard, Sequestration of Noble Gases in Giant Planet Interiors, Physical Review Letters, March 2010, 104 (12), Bibcode:2010PhRvL.104l1101W, arXiv:1003.5940
 , doi:10.1103/PhysRevLett.104.121101, 121101.
, doi:10.1103/PhysRevLett.104.121101, 121101.
- ^ Coyle, Harold P. Project STAR: The Universe in Your Hands. Kendall Hunt. 2001: 464. ISBN 978-0-7872-6763-6.
- ^ Kohmoto, Kohtaro. Phosphors for lamps. Shionoya, Shigeo; Yen, William M. (编). Phosphor Handbook. CRC Press. 1999: 940. ISBN 978-0-8493-7560-6.
- ^ NASSMC: News Bulletin. December 30, 2005 [2007-03-05]. (原始内容存档于February 13, 2007).
- ^ Mukhopadhyay, Mamata. Fundamentals of Cryogenic Engineering. 2012: 195. ISBN 9788120330573. (原始内容存档于2017-11-16).
- ^ Handbook of Compressed Gases. Compressed Gas Association. Springer Science & Business Media. 2012-12-06: 82 [8 March 2016]. ISBN 9781461306733.
- ^ Plasma. [2007-03-05]. (原始内容存档于2007-03-07).
- ^ Baumann, Edward. Applications of Neon Lamps and Gas Discharge Tubes. Carlton Press. 1966.
- ^ Myers, Robert L. Display interfaces: fundamentals and standards. John Wiley and Sons. 2002: 69–71. ISBN 978-0-471-49946-6. (原始内容存档于2016-06-29).
Plasma displays are closely related to the simple neon lamp.
- ^ Weber, Larry F. History of the plasma display panel. IEEE Transactions on Plasma Science. April 2006, 34 (2): 268–278. Bibcode:2006ITPS...34..268W. doi:10.1109/TPS.2006.872440. Paid access.
- ^ ANSI Luminous Tube Footage Chart (PDF). American National Standards Institute (ANSI). [2010-12-10]. (原始内容 (PDF)存档于2011-02-06). Reproduction of a chart in the catalog of a lighting company in Toronto; the original ANSI specification is not given.
- ^ The Internet resource for the International Temperature Scale of 1990. [2009-07-07]. (原始内容存档于2009-08-15).
- ^ Ramsay, William, Travers, Morris W. On the Companions of Argon. Proceedings of the Royal Society of London. 1898, 63 (1): 437–440. doi:10.1098/rspl.1898.0057.
- ^ Neon: History. Softciências. [2007-02-27]. (原始内容存档于2007-03-14).
- ^ Weeks, Mary Elvira. Discovery of the Elements: Third Edition (reprint). Kessinger Publishing. 2003: 287. ISBN 978-0-7661-3872-8. (原始内容存档于2015-03-22).
- ^ 23.0 23.1 Ramsay, Sir William. Nobel Lecture – The Rare Gases of the Atmosphere. nobelprize.org. Nobel Media AB. December 12, 1904 [15 November 2015]. (原始内容存档于13 November 2015).
- ^ Mangum, Aja. Neon: A Brief History. New York Magazine. December 8, 2007 [2008-05-20]. (原始内容存档于April 15, 2008).
- ^ Golec, Michael J. Logo/Local Intensities: Lacan, the Discourse of the Other, and the Solicitation to "Enjoy". Design and Culture. 2010, 2 (2).
- ^ Wolfe, Tom. Electro-Graphic Architecture. Architecture Canada. October 1968.
- ^ Clayton, Donald. Handbook of Isotopes in the Cosmos: Hydrogen to Gallium. Cambridge University Press. 2003: 106–107 [2019-12-04]. ISBN 978-0521823814. (原始内容存档于2020-04-06).
- ^ Ryan, Sean G.; Norton, Andrew J. Stellar Evolution and Nucleosynthesis. Cambridge University Press. 2010: 135 [2019-12-04]. ISBN 978-0-521-13320-3. (原始内容存档于2020-04-06).
- ^ Asplund, Martin; Grevesse, Nicolas; Sauval, A. Jacques; Scott, Pat. The Chemical Composition of the Sun. Annual Review of Astronomy and Astrophysics. 2009, 47: 481. Bibcode:2009ARA&A..47..481A. arXiv:0909.0948
 . doi:10.1146/annurev.astro.46.060407.145222.
. doi:10.1146/annurev.astro.46.060407.145222.
- ^ Gallagher, R.; Ingram, P. Chemistry for Higher Tier. University Press. 2001-07-19: 282. ISBN 978-0-19-914817-2.
- ^ Morse, David. Galileo Probe Science Result. Galileo Project. January 26, 1996 [2007-02-27]. (原始内容存档于February 24, 2007).
- ^ Steigerwald, William. NASA's LADEE Spacecraft Finds Neon in Lunar Atmosphere. NASA. 17 August 2015 [18 August 2015]. (原始内容存档于19 August 2015).
- ^ R. Norris Shreve; Joseph Brink. Chemical Process Industries 4th. 1977: 113. ISBN 0-07-057145-7.
- ^ Explained: Why the Russia-Ukraine crisis may lead to a shortage in semiconductors. MSN (The Indian Express) (英语).
- ^ Alper, Alexandra. Exclusive: Russia's attack on Ukraine halts half of world's neon output for chips. Reuters. 2022-03-11 [2022-03-16] (英语).
- ^ 36.0 36.1 Rare Gasses Supplier Known for Innovation. The European Times. 2020.
- ^ 37.0 37.1 Ukraine war flashes neon warning lights for chips, Reuters, 2022-02-25
- ^ 38.0 38.1 Times, Financial. Low on gas: Ukraine invasion chokes supply of neon needed for chipmaking. Ars Technica. 4 March 2022 [13 March 2022] (美国英语).
- ^ 39.0 39.1 Chipmakers see limited impact for now, as Russia invades Ukraine. CNBC. 24 February 2022 (英语).
- ^ Yu, X.; Zhu, J.; Du, S.; Xu, H.; Vogel, S. C.; Han, J.; Germann, T. C.; Zhang, J.; Jin, C.; Francisco, J. S.; Zhao, Y. Crystal structure and encapsulation dynamics of ice II-structured neon hydrate. Proceedings of the National Academy of Sciences of the United States of America. 2014, 111 (29): 10456–61. Bibcode:2014PNAS..11110456Y. PMC 4115495
 . PMID 25002464. doi:10.1073/pnas.1410690111.
. PMID 25002464. doi:10.1073/pnas.1410690111.
- ^ Falenty, Andrzej; Hansen, Thomas C.; Kuhs, Werner F. Formation and properties of ice XVI obtained by emptying a type sII clathrate hydrate. Nature. 2014, 516 (7530): 231. Bibcode:2014Natur.516..231F. PMID 25503235. doi:10.1038/nature14014.
- ^ Dickin, Alan P. Neon. Radiogenic isotope geology. 2005: 303. ISBN 978-0-521-82316-6.
- ^ Resources on Isotopes. Periodic Table—Neon 互联网档案馆的存档,存档日期2006-09-23.. explanation of the nucleogenic sources of Ne-21 and Ne-22. USGS.gov.
- ^ Neon: Isotopes. Softciências. [2007-02-27]. (原始内容存档于2012-11-15).
- ^ Anderson, Don L. Helium, Neon & Argon. Mantleplumes.org. [2006-07-02]. (原始内容存档于2006-05-28).
- ^ 存档副本. [2006-11-12]. (原始内容存档于2019-03-02).
- 元素氖在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 氖(英文)
- 元素氖在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素氖在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 氖(英文)
| 维基共享资源中相关的多媒体资源:氖(分类) |
| 查看维基词典中的词条“neon”。 |

