钯(拼音:bǎ,注音:ㄅㄚˇ,粤拼:baa2;英语:Palladium),是一种化学元素,其化学符号为Pd,原子序数为46,原子量为106.42 u。钯是在1803年由威廉·海德·沃拉斯顿所发现的一种罕见而具有光泽的银白色金属。钯的英文名称是以小行星智神星来命名的。钯与铂、铑、钌、铱、锇形成一组铂族金属的元素家族(PGMs)。铂族金属化学性质相似,但钯的熔点最低,也是这些贵金属中密度最低的一种。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
金属:银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钯(Palladium)·Pd·46 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 10 ·5·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 106.42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d10 2, 8, 18, 18 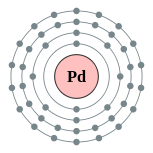 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 威廉·海德·沃拉斯顿(1802年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 威廉·海德·沃拉斯顿 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 12.023 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 10.38 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1828.05 K,1554.9 °C,2830.82 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 3236 K,2963 °C,5365 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 16.74 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 362 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 25.98 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压(>3300)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 0, +1, +2, +4 (两性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.20(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:804.4 kJ·mol−1 第二:1870 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 137 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 139±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 163 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)105.4 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 71.8 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)11.8 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)3070 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 121 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 44 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 180 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 4.75 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 461 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 37.3 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-05-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钯的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钯金属,与它的同族元素铂金属,在现有的供给量当中,有一半以上被用在触媒转换器当中。这些触媒转换器能将汽机车排放废气中的90%的有害气体(例如:一氧化碳、二氧化氮、碳氢化合物),转换为毒害性较低的物质(例如:二氧化碳、氮气、水)。钯也常被使用在电子工业、牙医学、医学、氢气纯化、化学应用、地下水处理以及珠宝业。钯能催化氢气及氧气反应产生水及热,是燃料电池中关键的成分。
钯及其他铂族金属的矿床很罕见。钯含量较高的矿床主要分布在:南非德兰士瓦盆地的布希维尔德火成岩复合体的白云带、美国蒙大拿州的斯蒂尔沃特综合体、加拿大安大略省的索德柏立盆地及珊德湾区、俄罗斯的诺里尔斯综合体,近期更在菲律宾米沙鄢群岛的北部发现。[2] 回收废弃触媒转换器中的钯也是其中一种来源。由于众多的应用以及资源的有限性,引起了大量的投资兴趣。
钯属于周期表中第十族元素,但是他的最外层电子组态遵守洪德定则。位于s壳层中的电子会迁移填入较低能量之d轨域。
钯是一种类似铂的软银白色金属,是铂族金属族当中密度及熔点最低的。退火时柔软且具有延展性,冷加工时可提升强度和硬度。铂可缓慢溶于浓硝酸、热浓硫酸以及常温之王水,并在精细研磨后可溶于盐酸当中。[3] 钯在标准温度下不与氧反应,因此在空气中不会失去光泽。加热至800℃的钯将产生一层氧化钯,并且在含硫的潮湿空气中会轻微褪色。[4]
在3.2K的低温中以α粒子轰击钯膜将会使之产生缺陷,而表现出超导性。[5]
自然存在的钯元素具有七种不同的同位素,其中六种是稳定存在的。最稳定的放射性同位素有:半衰期为650万年的107钯(可在自然界中找到)、半衰期为17天的103钯以及半衰期为3.63天的100钯。另外有发现18种钯的放射性同位素,91钯至123钯,它们原子重量的分布在90.94948(64) amu(91钯)至122.93426(64) amu (123钯)。这18种同位素,除了101钯 (半衰期为8.47小时)、109钯 (半衰期为13.7小时) 及 112钯 (半衰期为21小时)之外,其他的半衰期均小于30分钟。[6]
若是同位素的原子质量单位小于自然存在中最稳定同位素(106钯)的原子质量单位,该同位素最主要的衰变模式为电子捕获,而主要的衰变产物为铑(Rh)。若是同位素的原子质量单位较106钯大,其主要的衰变模式为β衰变( 贝他衰变),主要的衰变产物为银(Ag)。
放射性107银是107钯的衰变产物,最早于1978年在圣塔克拉拉陨石中发现。发现者认为这种以铁为核心的小行星之聚结和分化可能发生在核合成事件后之1000万年。107钯与银之关联性在自太阳系增生中已融化的物体中观测到,证实早期太阳系中核种的短暂存在。[7]
钯化合物通常以0价和+2价两种价态存在,其它价态的化合物也是已知的。总体上来说,与其它元素相比,钯化合物的性质和铂更接近。


钯在现代最大的用途是催化转换器[8],也能用作珠宝、牙科材料、[8][9]手表配件、血糖试纸、飞机火花塞、手术器械和电接触点,[10]或者用于制作专业的横向长笛。[11];也能用作贵金属投资商品,如钯金的ISO货币代码是XPD及964,其余有此类代码的金属还有金、银和铂。[12]钯能够吸收氢气,因此它也是1989年开始的有争议的冷聚变实验的关键组分。
诺里尔斯克镍公司(Norilsk Nickel)是俄罗斯最大的,同时也是世界最大的有色金属和贵金属生产商之一,其生产的钯占全球产量的66%。
催化
钯均匀负载时,如得到钯碳催化剂,可以用作多功能的催化剂,它可以加速氢化、脱氢以及裂化反应。有机化学中大部分碳-碳键的偶合反应都借助于钯化合物催化剂来完成,如赫克反应和铃木反应。
当钯分散到导电材料上时,可以得到优良的电催化剂,用于催化在碱性介质氧化伯醇。[13]在2010年,钯催化的有机反应获得了诺贝尔化学奖。另外,钯可用于均相催化,和多种配体结合,完成高选择性的化学转换,如钯催化剂用于催化的C−F键的反应。[14]
钯也是林德拉催化剂的重要成分。[15]
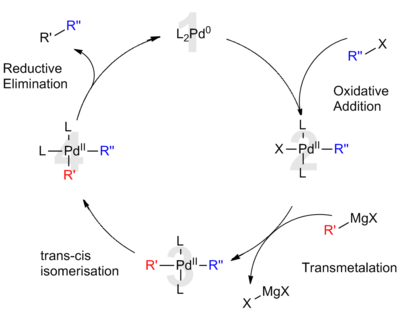
钯催化剂主要用于有机化学以及工业应用,它在合成生物学上也是有较好的前景。在2017年,钯纳米颗粒在哺乳动物体内被证实了有治疗疾病的催化活性。[16]
电子学
钯在电子学中的第二大应用便是用于电容器中,[17]其中钯以及钯银合金用作电极。[8]钯(或钯镍合金)可以用作消费电子产品中的连接部分、配件组分或焊接材料。[18][19]根据2006年庄信万丰的报告,电子行业在当年耗用了107万金衡盎司(合33.2吨)的金属钯。[20]
储氢
钯在室温可以很容易地吸收氢气,形成氢化钯PdHx(x<1)。[21]虽然很多过渡金属也有这种性质,但钯可以高效地吸收氢气,并且在x接近1之前不会失去延展性。[22]钯的这一性质被用于高效、相对廉价且安全的氢储存设备的研究中,但钯本身的价格昂贵是必须要考虑的因素。[23]钯中的氢含量影响着磁化率,随着氢含量的增高,磁化率降低,并且在形成PdH0.62时变为零。在任意更高的比例下,固溶体变为具有抗磁性。[24]
牙医材料
钯在一些牙科汞齐有少量使用(约0.5%),它可用于减少腐蚀并增加最终修复体的金属光泽。[25]
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ NASA, together with USGS, (United States Geological Survey), released a 3-year study report detailing the 8,450 square kilometer palladium deposits lying below the seas of Visayan, Sibuyan, and Tablas Strait. Source: https://breakingphnews.blogspot.com/2016/05/biggest-palladium-deposits-found-in.html (页面存档备份,存于互联网档案馆)
- ^ Hammond, C. R. The Elements. Handbook of Chemistry and Physics 81st. CRC press. 2004. ISBN 978-0-8493-0485-9.
- ^ Craig, Bruce D.; Anderson, David S. Atmospheric Environment. Handbook of corrosion data. ASM International. 1995: 126 [2019-08-03]. ISBN 978-0-87170-518-1. (原始内容存档于2021-05-02).
- ^ B. Strizker, Phys. Rev. Lett., 42, 1769 (1979).
- ^ Atomic Weights and Isotopic Compositions for Palladium (NIST). 2009-08-23 [12 November 2009]. (原始内容存档于2000-03-12).
- ^ Chen, J. H.; Wasserburg, G. J. The isotopic composition of Ag in meteorites and the presence of 107Pd in protoplanets. Geochimica et Cosmochimica Acta. 1990, 54 (6): 1729–1743. Bibcode:1990GeCoA..54.1729C. doi:10.1016/0016-7037(90)90404-9.
- ^ 8.0 8.1 8.2 Palladium. United Nations Conference on Trade and Development. [2007-02-05]. (原始内容存档于2006-12-06).
- ^ Rushforth, Roy. Palladium in Restorative Dentistry: Superior Physical Properties make Palladium an Ideal Dental Metal. Platinum Metals Review. 2004, 48 (1) [2018-07-07]. (原始内容存档于2015-09-24).
- ^ Hesse, Rayner W. palladium. Jewelry-making through history: an encyclopedia. Greenwood Publishing Group. 2007: 146. ISBN 978-0-313-33507-5.
- ^ Toff, Nancy. The flute book: a complete guide for students and performers. Oxford University Press. 1996: 20. ISBN 978-0-19-510502-5.
- ^ Weithers, Timothy Martin. Precious Metals. Foreign exchange: a practical guide to the FX markets. 2006: 34 [2018-07-07]. ISBN 978-0-471-73203-7. (原始内容存档于2021-04-19).
- ^ Tsuji, Jiro. Palladium reagents and catalysts: new perspectives for the 21st century. John Wiley and Sons. 2004: 90. ISBN 0-470-85032-9.
- ^ Drahl, Carmen. Palladium's Hidden Talent. Chemical & Engineering News. 2008, 86 (35): 53–56. doi:10.1021/cen-v086n035.p053.
- ^ Brown, William Henry; Foote, Christopher S; Iverson, Brent L. Catalytic reduction. Organic chemistry. Cengage Learning. 2009: 270 [2018-07-07]. ISBN 978-0-495-38857-9. (原始内容存档于2020-11-14).
- ^ Miller MA, Askevold B, Hannes M, Kohler RH, Pirovich D, Weissleder R. Nano-palladium is a cellular catalyst for in vivo chemistry. Nature Communications. 2017, 8: 15906. Bibcode:2017NatCo...815906M. PMC 5510178
 . PMID 28699627. doi:10.1038/ncomms15906.
. PMID 28699627. doi:10.1038/ncomms15906.
- ^ Zogbi, Dennis. Shifting Supply and Demand for Palladium in MLCCs. TTI, Inc. 2003-02-03 [2018-07-07]. (原始内容存档于2006-03-17).
- ^ Mroczkowski, Robert S. Electronic connector handbook: theory and applications. McGraw-Hill Professional. 1998: 3– [2018-07-07]. ISBN 978-0-07-041401-3. (原始内容存档于2021-04-28).
- ^ Harper, Charles A. Passive electronic component handbook. McGraw-Hill Professional. 1997: 580– [2018-07-07]. ISBN 978-0-07-026698-8. (原始内容存档于2021-04-28).
- ^ Jollie, David. Platinum 2007 (PDF). Johnson Matthey. 2007. (原始内容 (PDF)存档于2008-02-16).
- ^ Manchester, F. D.; San-Martin, A.; Pitre, J. M. The H-Pd (hydrogen-palladium) System. Journal of Phase Equilibria. 1994, 15: 62. doi:10.1007/BF02667685.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ Grochala, Wojciech; Edwards, Peter P. Thermal Decomposition of the Non-Interstitial Hydrides for the Storage and Production of Hydrogen. Chemical Reviews. 2004, 104 (3): 1283–316. PMID 15008624. doi:10.1021/cr030691s.
- ^ Mott, N. F. and Jones, H. (1958) The Theory of Properties of metals and alloys. Oxford University Press. ISBN 0-486-60456-X. p. 200
- ^ Colon, Pierre; Pradelle-Plasse, Nelly; Galland, Jacques. Evaluation of the long-term corrosion behavior of dental amalgams: influence of palladium addition and particle morphology. Dental Materials. 2003, 19 (3): 232–9. PMID 12628436. doi:10.1016/S0109-5641(02)00035-0.
- 元素钯在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钯(英文)
- 元素钯在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钯在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钯(英文)

