| 此条目尚未参照元素专题之格式编写。 |
| 此条目翻译品质不佳。 |
钐(拼音:shān,注音:ㄕㄢㄧ,粤拼:saam1;英语:Samarium),是一种化学元素,其化学符号为Sm,原子序数为62,原子量为150.36 u,属于镧系元素,也是稀土元素之一。钐是一种中等硬度的银色金属,在空气中会缓慢氧化。它属于典型的镧系元素,氧化状态通常为+3,不过也存在钐(II)的化合物,最常见的是SmO、SmS、SmSe和SmTe。最后一种化合物是化学合成中常见的还原剂。钐没有明显的生物作用,仅有轻微的毒性。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钐(Samarium)·Sm·62 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 镧系元素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 不适用 ·6·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 150.36(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Xe] 4f6 6s2 2, 8, 18, 24, 8, 2 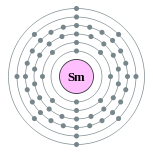 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 7.52 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 7.16 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1345 K,1072 °C,1962 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2173 K,1900 °C,3452 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 8.62 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 192 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 29.54 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 4, 3, 2, 1 ((弱碱性氧化物)) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.17(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:544.5 kJ·mol−1 第二:1070 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 198±8 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 菱方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (室温)(α, poly) 0.940 µΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 13.3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | (室温)(α, poly) 12.7 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)2130 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | α form: 49.7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | α form: 19.5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | α form: 37.8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | α form: 0.274 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 410–440 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 440–600 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-19-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钐的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钐是由法国化学家德布瓦博德兰(Paul-Émile Lecoq de Boisbaudran)于1879年发现的,并以从其中分离出的矿物铌钇矿(Samarskite)命名。该矿物本身早先是以一位俄罗斯矿务官员瓦西里-萨马尔斯基-别克霍夫茨上校(Vasili Samarsky-Bykhovets)的名字命名的,他因此间接成为第一个名字被用来被命名为化学元素的人。钐虽然被列为稀土元素,但它是地壳中含量第40高的元素,比锡等金属还更常见。钐存在于几种矿物中,包括铈矿、硅铍钇矿,铌钇矿,独居石和氟碳铈矿等,浓度最高可达2.8%,后两种是最常见的商业来源。这些矿物主要分布在中国、美国、巴西、印度、斯里兰卡和澳大利亚;中国是迄今为止世界上钐的开采和生产的领导者。
钐的主要商业应用是钐钴磁铁,其永磁化程度仅次于钕磁铁;且钐的化合物可以承受较高的温度,超过700°C(1,292°F),这是因为此合金的居里点较高,因此可以承受较高的温度而不会失去磁性。放射性同位素钐-153是药物钐(153Sm)的活性成分,它是治疗肺癌、前列腺癌、乳腺癌和骨肉瘤的药物“Quadramet”的活性成分,可杀死癌细胞。另一种同位素钐-149是一种强中子吸收剂,因此被添加到核反应堆的控制棒中。它在反应堆运行过程中也会形成衰变产物,是反应堆设计和运行中考虑的重要因素之一。钐的其他应用还包括化学反应的催化剂、放射性年代测定和X射线激光。
钐是一种稀土金属,其硬度和密度与锌相似。钐的沸点为1794℃,是仅次于镱和铕下第三容易挥发的镧系元素;这一特性有利于钐从矿石中分离出来。在环境条件下,钐通常呈现出菱方结构(α形)。当加热到731°C时,其晶体对称性变为六方最密堆积(hcp结构),但转变温度取决于金属纯度。进一步加热到922°C时,金属会转变为以体心立方(bcc结构)。加热至300°C并将其压缩至40kbar后,形成双六方最密堆积结构(dhcp)。施加数百或数千千巴的高压力则会引起一系列的相变,特别是在约900千巴时出现四方晶系结构。在一项研究中,dhcp相可以在不压缩的情况下,使用非对称退火法,温度在400-700℃之间快速变化中产生,证实了这种钐结构的瞬变特性。另外,气相沉积法得到的钐的薄膜在环境条件下可能含有hcp结构或dhcp结构。
钐(及其二氧化物)在室温下具有顺磁性。其对应的有效磁矩在2μB以下,是镧系(及其氧化物)中的第三低,仅次于镧和镥。在冷却到14.8 K时,金属会转变为反磁性状态。[3][4] 单个钐原子可以透过富勒烯分子,将其封装并分离出来。[5]钐原子也可以掺杂在富勒烯固体中的C60分子之间,使其在8K以下的温度下具有超导性。将钐掺杂于铁基超导体中,在温度高达56K即可转变为高温超导体,这是迄今为止该系列超导体的最高值。
新制备的钐具有银色光泽。在空气中,它在室温下会缓慢氧化,并在150℃时自燃。即使在矿物油下保存,钐也会逐渐氧化,并在表面形成灰黄色的氢氧化物混合物粉末。将样品密封在惰性气体如氩气下,可保持样品的金属外观。
钐具有相当大的电正度,能与水反应形成氢氧化钐,其中与冷水反应速度较慢,而与热水反应速度则较快:
2 Sm (s) + 6 H2O (l) → 2 Sm(OH)3 (aq) + 3 H2 (g)
钐很容易溶解在稀硫酸中,形成含有黄色至淡绿色的Sm(III)离子的溶液,以[Sm(OH2)9]3+复合物的形式存在:[6]
2 Sm (s) + 3 H2SO4 (aq) → 2 Sm3+ (aq) + 3 SO42-(aq) + 3 H2 (g)
钐是少数几个表现出氧化态+2的镧系元素之一,Sm2+离子在水溶液中呈血红色。
| 公式 | 颜色 | 对称 | 空间群 | 没有 | 皮尔逊符号 | a (pm) | b (pm) | c (pm) | Z | 密度, g/cm3 |
|---|---|---|---|---|---|---|---|---|---|---|
| Sm | 银色 | 三角形[7] | R3m | 166 | hR9 | 362.9 | 362.9 | 2621.3 | 9 | 7.52 |
| Sm | 银色 | 六角形[7] | P63/mmc | 194 | hP4 | 362 | 362 | 1168 | 4 | 7.54 |
| Sm | 银色 | 四方形[8] | I4/mmm | 139 | tI2 | 240.2 | 240.2 | 423.1 | 2 | 20.46 |
| SmO | 金色 | 立方形[9] | Fm3m | 225 | cF8 | 494.3 | 494.3 | 494.3 | 4 | 9.15 |
| Sm2O3 | 三角形[10] | P3m1 | 164 | hP5 | 377.8 | 377.8 | 594 | 1 | 7.89 | |
| Sm2O3 | 单斜晶系[10] | C2/m | 12 | mS30 | 1418 | 362.4 | 885.5 | 6 | 7.76 | |
| Sm2O3 | 立方形[11] | Ia3 | 206 | cI80 | 1093 | 1093 | 1093 | 16 | 7.1 | |
| SmH2 | 立方形[12] | Fm3m | 225 | cF12 | 537.73 | 537.73 | 537.73 | 4 | 6.51 | |
| SmH3 | 六角形[13] | P3c1 | 165 | hP24 | 377.1 | 377.1 | 667.2 | 6 | ||
| Sm2B5 | 灰色 | 单斜晶系[14] | P21/c | 14 | mP28 | 717.9 | 718 | 720.5 | 4 | 6.49 |
| SmB2 | 六角形[15] | P6/mmm | 191 | hP3 | 331 | 331 | 401.9 | 1 | 7.49 | |
| SmB4 | 四方形[16] | P4/mbm | 127 | tP20 | 717.9 | 717.9 | 406.7 | 4 | 6.14 | |
| SmB6 | 立方形[17] | Pm3m | 221 | cP7 | 413.4 | 413.4 | 413.4 | 1 | 5.06 | |
| SmB66 | 立方形[18] | Fm3c | 226 | cF1936 | 2348.7 | 2348.7 | 2348.7 | 24 | 2.66 | |
| Sm2C3 | 立方形[19] | I43d | 220 | cI40 | 839.89 | 839.89 | 839.89 | 8 | 7.55 | |
| SmC2 | 四方形[19] | I4/mmm | 139 | tI6 | 377 | 377 | 633.1 | 2 | 6.44 | |
| SmF2 | 紫色[20] | 立方形[21] | Fm3m | 225 | cF12 | 587.1 | 587.1 | 587.1 | 4 | 6.18 |
| SmF3 | 白色[20] | 斜方晶系[21] | Pnma | 62 | oP16 | 667.22 | 705.85 | 440.43 | 4 | 6.64 |
| SmCl2 | 棕色[20] | 斜方晶系[22] | Pnma | 62 | oP12 | 756.28 | 450.77 | 901.09 | 4 | 4.79 |
| SmCl3 | 黄色[20] | 六角形[21] | P63/m | 176 | hP8 | 737.33 | 737.33 | 416.84 | 2 | 4.35 |
| SmBr2 | 棕色[20] | 单斜晶系[23] | Pnma | 62 | oP12 | 797.7 | 475.4 | 950.6 | 4 | 5.72 |
| SmBr3 | 黄色[20] | 斜方晶系[24] | Cmcm | 63 | oS16 | 404 | 1265 | 908 | 2 | 5.58 |
| SmI2 | 绿色[20] | 单斜晶系 | P21/c | 14 | mP12 | |||||
| SmI3 | 橙色[20] | 三角形[25] | R3 | 63 | hR24 | 749 | 749 | 2080 | 6 | 5.24 |
| SmN | 立方形[26] | Fm3m | 225 | cF8 | 357 | 357 | 357 | 4 | 8.48 | |
| SmP | 立方形[27] | Fm3m | 225 | cF8 | 576 | 576 | 576 | 4 | 6.3 | |
| SmAs | 立方形[28] | Fm3m | 225 | cF8 | 591.5 | 591.5 | 591.5 | 4 | 7.23 |
氧化物
钐最稳定的氧化物为三氧化二钐Sm2O3。正如许多其他的钐化合物,它存在于几个结晶相。而三角形是从熔体缓慢冷却得到的。Sm2O3的熔点相当高(2345℃),因此熔点通常不以直接加热达到,而使用感应加热通过一个射频线圈。Sm2O3的粉末可以经由火焰熔融法(Verneuil的过程)产生Sm2O3结晶的单斜晶的对称晶体,晶体为筒状的晶柱约数厘米长,直径大约一厘米。当晶柱是纯净的时候为透明,否则则为橙色。加热三角形的Sm2O3至1900℃,可将它转换到更稳定的单斜晶相。
钐是少数可以形成一氧化物SmO的镧系元素之一。在升高的温度(1000℃)和高于50千巴的压力下,Sm2O3的减少能得到有光泽的金黄色的化合物,降低的压力导致一个不完整的反应中得到。SmO有岩盐立方晶格结构。
硫属化合物
钐形成三价的硫化物,硒化物,碲化物。也被称为二价硫族化合物,SmS,SMSE和SMTE为立方岩盐晶体结构。它们处于显著状态为在室温下提高压力从半导体转换到金属态。由于过渡是连续且发生在20-30千巴在SMSE和SMTE,在SmS只需要6.5千巴。这种效应会使SmS的颜色从黑色变成金黄色,其晶体薄膜被划伤或抛光。过渡不改变晶格的对称性,但结晶体积会急剧下降(〜15%),显示当压力下降,SmS返回到半导体状态时的迟滞。
卤化物
金属钐与所有的卤素反应,形成三卤化反应:
2 Sm (s) + 3 X2 (g) → 2 SmX3 (s) ( X = 氯、溴或碘 )
它们与钐、锂或钠金属在高温(约700-900℃)进行还原反应而产生的二卤化物。可以通过加热 SmI3,或在室温下金属与无水四氢呋喃中1,2 -二碘乙烷反应制备而成:
Sm (s) + ICH2-CH2I → SmI2 + CH2=CH2
除了铝二卤化物,还原反应也产生大量有明显晶体结构的非化学计量的钐卤化物,如 Sm14F33、Sm3F7、Sm27F64、Sm11Br24、Sm5Br11 和 Sm6Br13。
钐卤化物改变其晶体结构,一个类型的卤原子取代另一个,对大多数元素(例如,锕系元素)而言这是一种罕见的行为。许多卤化物的结构有两个主要的结晶相,其中之一是更稳定,另一个是亚稳态。后者的形成为先压缩或加热,然后进行骤冷至室温。例如压缩单斜晶系二碘化钐再释放压力会造成PBCL2型的斜方晶系结构(密度5.90克/厘米3)的压力的结果,在一个新的阶段三碘化钐(密度5.97克/厘米3)也有类似反应。
硼化物
在真空中,钐和氧化硼的烧结粉末含有几个钐硼化物相,混合比例可以控制它们的体积比。依赖于不同的熔点/ 结晶温度SMB (2580°C),SMB (约2300°C)和SMB 66(2150°C),特定的钐硼化物粉末可以被使用电弧或区熔技术熔化转换成较大的晶体。所有这些材料是硬,脆,暗灰色的固体与硬度随着硼含量上升而增加。钐硼化钛的挥发性过高无法使用这些方法产生,需要高压力(约65千巴)和低温1140和1240°C之间稳定其增长。温度上升使SMB6优先形成。
六硼化钐是一个典型的中间价化合物,其中Sm2+和Sm3+的比率为三比七。它属于一种近藤绝缘体,在高温下(高于50 K),它的属性是典型的近藤金属,强电子散射使其具有金属导电性,而在低温下,它表现为具有窄约4-14毫电子伏特带隙的非磁性的绝缘层。SmB6伴随着由热导率急剧增加使冷却引起的金属-绝缘体转变,峰值在约15 K,增加的原因是电子低温下无助于热导率,使占主导地位的电子浓度的减少降低电子-声子散射率。
一项新的研究指出,它可能是一个拓扑绝缘体。
其他无机化合物
钐碳化物是在惰性气氛中通过熔化金属石墨的混合物制备而来。合成后它们在空气中不稳定,需在惰性气体下进行研究。钐monophosphide SMP是为1.10电子伏特带隙的半导体,和硅相同,且硅为高导电性的n-型半导体。它可以在1100℃下热处理含有磷和钐的混合粉末的真空石英安瓿制备而来。磷在高温下具有高挥发性,有可能发生爆炸,所以加热速率要保持在低于1℃/分钟。类似的程序被采用在SMAS的monarsenide,但合成温度高于1800℃。
大量的结晶性二元化合物是钐和一个基团-4,5或6的元素X形成,其中X是硅,锗,锡,铅,锑,钐和金属合金形成另一个大型基。它们都从何相应元素的混合粉末热处理制备而来。所得到的化合物是许多非化学计量的,有标称组合物的Sm a X b ,其中b / a的比率变化范围在0.5和3之间。
有机金属化合物
钐形成一个基环戊二烯的Sm(C5H5)3和chloroderivatives的Sm(C5H5)2Cl和2Sm(C5H5)Cl。氯。它们是三氯化钛与四氢呋喃中的NAC5H5反应制备来。和大多数其它镧系元素的环戊二烯相反,在Sm(C5H5)3中,一些C5H5彼此环桥形成环的顶点η1或边缘η2朝向另一个相邻钐原子,产生聚合链。chloroderivative的Sm(C5H5)2Cl具有二聚体结构更精确地表示为(η5- C5H5)2Sm(µ-Cl)2(η5 -C5H5)2。在那里氯桥可以被更换,例如,碘,氢或氮的原子或CN基团。
钐环戊二烯中(C5H5)-离子可以被indenide(C9H7)-或环戊二烯(C8H8)2-环替代,产生Sm(C9H7)3或KSM(η8-C8H8)2。后者的化合物uranocene具有相似的结构。也有一个二价钐的环戊二烯,Sm(C5H5)2-固体,在约85℃下升华,和二茂铁相反,在Sm(C5H5)中2C5H5的环是不平行的,但倾斜40°。
钐的烷基和芳基在在四氢呋喃或乙醚中分解反应得到:
Sm(OR)3 + 3 LiCH(SiMe3)2 → Sm{CH(SiMe3)2}3 + 3 LiOR
钐在自然界的放射性为128(贝克/公克)。钐包含4种稳定的同位素:144Sm,150Sm,152Sm,154Sm,还有3种半衰期极长的放射性同位素 147Sm (t1/2= 1.06×10^11 年), 148Sm (7×10^15 年) 和 149Sm (>2×10^15年),其中152Sm为含量最丰富的(自然界中的含量占 26.75%)[29]. 大多资料来源认为149Sm是一种稳定[29][30]放射性同位素。[31]
其中146Sm, 147Sm,和 148Sm,这些半衰期较长的同位素,主要会经历󠄓α衰变,进而变成为钕的同位素。而较不稳定的同位素中,较轻者主要会捕获电子转变成钷,而较重者主要经历β衰变,转变成铕的同位素。[32]
151Sm 和145Sm的半衰期分别为90年和340天,其余放射性同位素的半衰期都不到两天,而且大部分的半衰期甚至都还不到48秒。其中钐的5种核异构体,算是最稳定的存在,它们的半衰期分别是141mSm (22.6 分),143m1Sm t1/2 = 66 秒) 和 139mSm(t1/2=10.7 秒). [33]
钐为地壳中含量第40多的元素,平均浓度约为8ppm。它的数量是镧系元素中第五多的,甚至比锡这种元素还更常见。钐在泥土中的浓度介于2~23ppm,而海洋中的浓度大约为0.5~0.8ppt 。钐的分布则会取决于它的化学状态,且非常地不均匀。在沙土中,钐在砂土颗粒的表面上的浓度大约是在水中的200倍,而在黏土中则会超过1000倍。[34]
钐鲜少于自然界中以元素态被发现,但就像其他稀土元素一样,是许多矿物的成分之一,包括独居石、氟碳铈镧矿、硅藻土、硅铍钇和铌钇矿;其中独居石(钐的浓度高达2.8%)[35]和氟碳铈镧矿多作为商业用途。世界上的钐估计有200万吨之多;大多数矿源分布在中国、美国、巴西、印度、斯里兰卡以及澳洲,年产量大约为700吨[36],国家生产报告中的数据通常为稀土金属的总量。到目前为止,中国拥有最大的产量,平均每年开采了约12万吨;紧跟在后的是美国(约5000吨)[34]和印度(2700吨)。[37]钐通常都以氧化物的形式出售,价钱通常为30 美元/公斤,为最便宜的镧系元素氧化物之一。常用的混合稀土金属中,仅有约1%的钐。而相对纯净的钐是最近通过离子交换过程,溶剂萃取技术和电化学沉积分离,才可以分离出来。
- ^ Standard Atomic Weights 2013. Commission on Isotopic Abundances and Atomic Weights
- ^ Lide, D. R. (编). Magnetic susceptibility of the elements and inorganic compounds. CRC Handbook of Chemistry and Physics (PDF) 86th. Boca Raton (FL): CRC Press. 2005. ISBN 0-8493-0486-5. (原始内容 (PDF)存档于2011-03-03).
- ^ Lock, J. M. The Magnetic Susceptibilities of Lanthanum, Cerium, Praseodymium, Neodymium and Samarium, from 1.5 K to 300 K. Proceedings of the Physical Society. Series B. 1957, 70 (6): 566. Bibcode:1957PPSB...70..566L. doi:10.1088/0370-1301/70/6/304.
- ^ Huray, P.; Nave, S.; Haire, R. Magnetism of the heavy 5f elements. Journal of the Less Common Metals. 1983, 93 (2): 293. doi:10.1016/0022-5088(83)90175-3.
- ^ Okazaki, T.; Suenaga, Kazutomo; Hirahara, Kaori; et al. Electronic and geometric structures of metallofullerene peapods. Physica B. 2002, 323 (1–4): 97. Bibcode:2002PhyB..323...97O. doi:10.1016/S0921-4526(02)00991-2.
- ^ Chemical reactions of Samarium. Webelements. [2009-06-06].
- ^ 7.0 7.1 Shi, N; Fort, D. Preparation of samarium in the double hexagonal close packed form. Journal of the Less Common Metals. 1985, 113 (2): 21. doi:10.1016/0022-5088(85)90294-2.
- ^ Vohra, Y; Akella, Jagannadham; Weir, Sam; Smith, Gordon S. A new ultra-high pressure phase in samarium. Physics Letters A. 1991, 158: 89. Bibcode:1991PhLA..158...89V. doi:10.1016/0375-9601(91)90346-A.
- ^ Leger, J; Yacoubi, N; Loriers, J. Synthesis of rare earth monoxides. Journal of Solid State Chemistry. 1981, 36 (3): 261. Bibcode:1981JSSCh..36..261L. doi:10.1016/0022-4596(81)90436-9.
- ^ 10.0 10.1 Gouteron, J; Michel, D.; Lejus, A.M.; Zarembowitch, J. Raman spectra of lanthanide sesquioxide single crystals: Correlation between A and B-type structures. Journal of Solid State Chemistry. 1981, 38 (3): 288. Bibcode:1981JSSCh..38..288G. doi:10.1016/0022-4596(81)90058-X.
- ^ Taylor D. Br. Ceram. Trans. J. 1984, 83: 92–98. 缺少或
|title=为空 (帮助) - ^ Daou, J; Vajda, P; Burger, J. Low temperature thermal expansion in SmH2+x. Solid State Communications. 1989, 71 (12): 1145. Bibcode:1989SSCom..71.1145D. doi:10.1016/0038-1098(89)90728-X.
- ^ Dolukhanyan, S. Synthesis of novel compounds by hydrogen combustion. Journal of Alloys and Compounds. 1997,. 253–254: 10. doi:10.1016/S0925-8388(96)03071-X.
- ^ Zavalii, L. V.; Kuz'ma, Yu. B.; Mikhalenko, S. I. Sm2B5 boride and its structure. Soviet Powder Metallurgy and Metal Ceramics. 1990, 29 (6): 471. doi:10.1007/BF00795346.
- ^ Cannon, J; Cannon, D; Tracyhall, H. High pressure syntheses of SmB2 and GdB12. Journal of the Less Common Metals. 1977, 56: 83. doi:10.1016/0022-5088(77)90221-1.
- ^ Etourneau, J; Mercurio, J; Berrada, A; Hagenmuller, P; Georges, R; Bourezg, R; Gianduzzo, J. The magnetic and electrical properties of some rare earth tetraborides. Journal of the Less Common Metals. 1979, 67 (2): 531. doi:10.1016/0022-5088(79)90038-9.
- ^ Solovyev, G. I.; Spear, K. E. Phase Behavior in the Sm-B System. Journal of the American Ceramic Society. 1972, 55 (9): 475. doi:10.1111/j.1151-2916.1972.tb11344.x.
- ^ Schwetz, K; Ettmayer, P; Kieffer, R; Lipp, A. Über die Hektoboridphasen der Lanthaniden und Aktiniden. Journal of the Less Common Metals. 1972, 26: 99. doi:10.1016/0022-5088(72)90012-4.
- ^ 19.0 19.1 Spedding, F. H.; Gschneidner, K.; Daane, A. H. The Crystal Structures of Some of the Rare Earth Carbides. Journal of the American Chemical Society. 1958, 80 (17): 4499. doi:10.1021/ja01550a017.
- ^ 20.0 20.1 20.2 20.3 20.4 20.5 20.6 20.7 Greenwood, p. 1241
- ^ 21.0 21.1 21.2 Greis, O. Über neue Verbindungen im system SmF2_SmF3. Journal of Solid State Chemistry. 1978, 24 (2): 227. Bibcode:1978JSSCh..24..227G. doi:10.1016/0022-4596(78)90013-0.
- ^ Meyer, G; Schleid, T. The metallothermic reduction of several rare-earth trichlorides with lithium and sodium. Journal of the Less Common Metals. 1986, 116: 187. doi:10.1016/0022-5088(86)90228-6.
- ^ Bärnighausen, H. Rev. Chim. Miner. 1973, 10: 77–92. 缺少或
|title=为空 (帮助) - ^ Zachariasen, W. H. Crystal chemical studies of the 5f-series of elements. I. New structure types. Acta Crystallographica. 1948, 1 (5): 265. doi:10.1107/S0365110X48000703.
- ^ Asprey, L. B.; Keenan, T. K.; Kruse, F. H. Inorganic Chemistry. 1964, 3 (8): 1137. doi:10.1021/ic50018a015. 缺少或
|title=为空 (帮助) - ^ Brown, R; Clark, N.J. Composition limits and vaporization behaviour of rare earth nitrides. Journal of Inorganic and Nuclear Chemistry. 1974, 36 (11): 2507. doi:10.1016/0022-1902(74)80462-8.
- ^ Meng, J; Ren, Yufang. Studies on the electrical properties of rare earth monophosphides. Journal of Solid State Chemistry. 1991, 95 (2): 346. Bibcode:1991JSSCh..95..346M. doi:10.1016/0022-4596(91)90115-X.
- ^ Beeken, R.; Schweitzer, J. Intermediate valence in alloys of SmSe with SmAs. Physical Review B. 1981, 23 (8): 3620. Bibcode:1981PhRvB..23.3620B. doi:10.1103/PhysRevB.23.3620.
- ^ 29.0 29.1 Flohr, H.; Breull, W. Effect of etafenone on total and regional myocardial blood flow. Arzneimittel-Forschung. 1975-09, 25 (9): 1400–1403. ISSN 0004-4172. PMID 23.
- ^ Chart of the nuclides, Brookhaven National Laboratory
- ^ Holden, Norman E. "Table of the isotopes" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 引用错误:没有为名为
nubase2的参考文献提供内容 - ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik, The NUBASE evaluation of nuclear and decay properties, Nuclear Physics A, 2003, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ 34.0 34.1 引用错误:没有为名为
LA2的参考文献提供内容 - ^ 引用错误:没有为名为
CRC的参考文献提供内容 - ^ 引用错误:没有为名为
emsley的参考文献提供内容 - ^ Rare Earths (PDF). United States Geological Surves. January 2010 [2010-12-10].
| 维基共享资源中相关的多媒体资源:钐 |
| 查看维基词典中的词条“samarium”。 |
- 元素钐在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钐(英文)
- 元素钐在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钐在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钐(英文)

