钕(拼音:nǚ,注音:ㄋㄩˇ,粤拼:neoi5;英语:Neodymium;旧译釢[注 1]、鋖),是一种化学元素,其化学符号为Nd,原子序数为60,原子量为144.242 u,属于镧系元素,也是稀土元素之一。钕是一个坚硬,可以延展的银白色金属,较活泼,室温下在空气中缓慢氧化,能与水和酸作用放出氢。有顺磁性。钕氧化后,会形成粉红色、蓝紫色和黄色的化合物,分别处于+2、+3和+4氧化态。[2]钕于1885年由奥地利化学家卡尔·奥尔·冯·韦尔斯巴赫发现。它大量存在于矿物独居石和氟碳铈矿中。钕不会以金属形式天然存在,会与其他镧系元素混合,通常经过提炼以供一般用途。虽然钕被归类为稀土元素,但它相当常见,不比钴、镍或铜稀有,并且广泛分布在地球的地壳中。[注 2] 世界上大部分的钕都是在中国开采的。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钕(Neodymium)·Nd·60 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 镧系元素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 不适用 ·6·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 144.242 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Xe] 4f4 6s2 2, 8, 18, 22, 8, 2 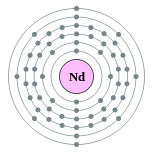 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 7.01 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 6.89 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1297 K,1024 °C,1875 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 3347 K,3074 °C,5565 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 7.14 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 289 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 27.45 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 3, 2(弱碱性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.14(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:533.1 kJ·mol−1 第二:1040 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 181 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 201±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性、20K以下反铁磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (室温) (α,聚合物) 643 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 16.5 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | (室温) (α,聚合物) 9.6 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)2330 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | (α晶型)41.4 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | (α晶型)16.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | (α晶型)31.8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | (α晶型)0.281 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 343 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 265 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-00-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钕的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钕化合物在1927年首次商业用作玻璃染料,现在仍然是玻璃中流行的添加剂。钕化合物的颜色是由Nd3+离子引起的,它通常为红紫色,但会随着照明的类型而变化。一些掺钕玻璃用于发射波长在1047到1062纳米之间的红外线的激光器。它们已被用于极高功率的应用,例如惯性约束聚变中的实验。钕还与其他各种基质晶体一起使用,例如掺钕钇铝石榴石激光中的钇铝石榴石。
钕的另一个重要用途是作为合金中的一种成分,用于制造高强度的钕磁铁——一种强大的永久磁铁。[3]这些磁铁广泛用于麦克风、专业扬声器、入耳式耳机、高性能业余直流电动机和计算机硬盘等需要低磁铁质量(或体积)或强磁场的产品中。较大的钕磁铁则用于高功率和重量的电动机(例如混合动力汽车)和发电机(例如飞机和风力发动机的发电机)。[4]
物理性质
钕是一种稀土金属。金属钕具有明亮的银色金属光泽。钕有两种同素异形体,会从六方晶系转换成体心立方晶系,转变温度 863 °C。[5]钕在室温下是顺磁性的,在冷却到 20 K(−253.2 °C)时变成反铁磁性的。[6] 钕和铁的合金,也就是钕磁铁是铁磁性的。
化学性质
钕在标准情况下会迅速氧化,[5] 在 150 °C 时准备燃烧成氧化钕。钝化后的钕的外层会形成一层氧化钕,剥开后里面的钕会继续和氧气反应:[5]
钕的电正性很大,和冷水反应较慢,但和热水反应迅速,形成氢氧化钕:
金属钕和所有的卤素剧烈反应:
钕和稀硫酸反应,形成含有紫丁香色的 Nd(III) 离子的溶液。它以 [Nd(OH2)9]3+ 配合物的形式存在:[7]
化合物
钕化合物包括:
- 卤化物:氟化钕 (NdF3),四氟化钕(NdF4),氯化钕 (NdCl3),溴化钕 (NdBr3),碘化钕 (NdI3)
- 氧化物:氧化钕 (Nd2O3)
- 硫化物:一硫化钕 (NdS),三硫化二钕(Nd2S3)
- 氮化物:氮化钕 (NdN)
- 氢氧化物:氢氧化钕 (Nd(OH)3)
- 磷化物:磷化钕 (NdP)
- 碳化物:碳化钕 (NdC2)
- 硝酸盐:硝酸钕 (Nd(NO3)3)
- 硫酸盐:硫酸钕 (Nd2(SO4)3)
一些钕化合物的颜色会随着光线而变化。

荧光灯下的钕化合物,从左到右分别为硫酸钕、硝酸钕和氯化钕。

一体式荧光灯下的钕化合物

正常日光下的钕化合物
同位素
天然钕由五种同位素组成,分别是142Nd、143Nd、145Nd、146Nd 和148Nd。其中,142Nd 是最常见的,占了 27.2% 。钕有两种天然的放射性同位素,144Nd 和150Nd。截至2010年,已知的放射性钕同位素有31种,最稳定的两种在自然中存在。它们分别是 144Nd (α衰变,半衰期 2.29×1015 年)和150Nd (双β衰变, 半衰期约为 7×1018)。剩下的放射性同位素半衰期都低于11天,大部分少于 70 秒。钕也有 13 个已知的核同质异能素,其中最稳定的是 139mNd (半衰期 5.5 小时),135mNd(半衰期 5.5 分钟)和 133m1Nd (半衰期 ~70 秒)。

钕是由奥地利化学家卡尔·奥尔·冯·韦尔斯巴赫于1885年在维也纳发现的。[8][9]它在硝酸溶液中对镨钕的硝酸盐进行分步结晶,从镨钕中分离了钕。韦尔斯巴赫通过光谱学确认了钕的存在,但是得到的样本纯度低。Didymium 是由卡尔·莫桑德尔在 1841年发现的,但 1925年才分离到了纯的钕。neodymium 这个名称由希腊文字 neos (νέος),意为新和 didymos (διδύμος),意为双胞胎组成。[5][10][11][12][13][14]

钕在自然界中很少以游离元素的形式被发现,而是存在于诸如独居石和氟碳铈矿(这些是矿物组名称而不是单一矿物名称)的矿石中,这些矿石中含有少量的所有稀土金属。在这些矿物中,钕很少占主导地位,而铈是最丰富的镧系元素,不过也有例外,如独居石-(Nd) 和kozoite-(Nd)。[15]钕的主要矿区在中国、美国、巴西、印度、斯里兰卡和澳大利亚。钕的储量估计约为800万吨。钕虽然属于稀土金属,但一点也不稀有。它在地壳中的丰度约为38mg/kg,在稀土元素中位居第二,仅次于铈。2004年世界钕的产量约为7,000吨。[10]目前的大部分钕产量来自中国。历史上,中国政府对该元素实施了战略物资管制,导致价格出现较大波动。[16] 价格和供货的不确定性导致公司(尤其是日本公司)制造稀土金属较少的永磁体和相关电动机;然而,到目前为止,他们还无法消除对钕的需求。[17][18]根据美国地质调查局,格陵兰拥有最大的未开发稀土矿床储量,尤其是钕。由于在采矿过程中释放放射性物质,在这些地点与当地居民发生采矿利益冲突。[19]
钕通常占轻稀土元素矿物氟碳铈矿和独居石商业矿床稀土含量的10-18%。[5] 由于钕化合物是三价镧系元素颜色最强烈的,因此当不存在竞争发色团时,它有时会主导稀土矿物的着色。它通常呈现粉红色。这方面的突出例子包括来自拉拉瓜、玻利维亚锡矿床的独居石晶体,来自加拿大魁北克省Mont Saint-Hilaire的ancylite,或来自美国宾夕法尼亚州北安普敦县下索肯镇的lanthanite。与钕玻璃一样,这些矿物质在不同的光照条件下会改变颜色。钕的吸收带与水银灯的可见光发射光谱相互作用,未经过滤的短波紫外线使含钕矿物反射出独特的绿色。这可以在含有独居石的沙子或含氟碳铈矿的矿石观察到。
- 钕在液氦温度下具有异常大的比热容量,因此可用于低温冷却器。
- 可能由于和 Ca2+类似,Nd3+被报告[20]可以促进植物生长。
- 钐钕测年法可用于确定岩石[21]和陨石的年龄。
- 海洋沉积物中的钕同位素用于重建过去海洋环流的变化。[22][23]
磁铁

钕磁铁(实际上是合金,化学式Nd2Fe14B)是已知最强的永久磁铁。几克重的钕磁铁可以举起自身重量一千倍的东西。这些磁铁比钐钴磁铁更便宜、更轻、更坚固。然而,它们并非在各个方面都优越,因为钕基磁铁在较低温度下会失去磁性并容易被腐蚀,而钐钴磁铁则不会。
钕磁铁出现在麦克风、专业扬声器、入耳式耳机、吉他和低音吉他拾音器等产品中,以及需要低质量、小体积或强磁场的计算机硬盘。钕也用于混合动力和电动汽车的电动机以及某些商业风力涡轮机设计的发电机(只有带有永磁发电机的风力涡轮机使用钕)。例如,丰田普瑞斯的驱动电动机需要一公斤(2.2 磅)的钕。[4]
2020年,奈梅亨拉德伯德大学和乌普萨拉大学的物理学研究人员宣布,他们在钕的原子结构中观察到了一种称为“自诱导自旋玻璃”的行为。其中一位研究人员解释说,“……我们是扫描隧道显微镜的专家。它使我们能够看到单个原子的结构,让我们可以解析原子的北极和南极。随着高精度成像的这一进步,我们能够发现钕的这种行为,因为我们可以解决磁结构中令人难以置信的微小变化。”钕具有复杂的磁性,这在元素周期表的元素中是前所未有的。[24][25]
激光

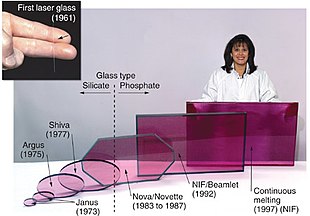

某些具有少量钕离子的透明材料可用于红外线(波长1054~1064nm)激光器中的激活激光媒质,例如Nd:YAG、Nd:YLF、Nd:YVO4和钕玻璃。掺钕晶体(通常为 Nd:YVO4)会产生高功率的红外线激光束,在商用半导体泵浦固体激光手持激光器和激光笔中转换为绿色激光束。
玻璃


钕玻璃是通过在融化的玻璃中加入氧化钕(Nd2O3)来生产的。在白天或白炽灯光下,钕玻璃呈现通常淡紫色,但在荧光灯照明下呈现淡蓝色。钕可用于为玻璃着色从纯紫色到酒红色和暖灰色的微妙色调。
钕的尖锐吸收带使得钕玻璃在不同光照条件下颜色会发生变化。钕玻璃在日光或黄色白炽灯下呈红紫色,在白色荧光下呈蓝色,在三色灯光下呈绿色。这种变色现象受到收藏家的高度评价。它和金或硒混合,可以产生红色。由于钕的着色依赖于原子内部深处的 f-f 跃迁禁制,因此化学环境对颜色的影响相对较小,颜色不受玻璃热量历史的影响。然而,为了获得最佳颜色,需要尽量减少用于制造玻璃的二氧化硅中的含铁杂质。f-f跃迁的相同禁止性质使得稀土着色剂的强度低于大多数过渡元素提供的着色,因此必须在玻璃中使用更多的稀土元素才能达到所需的颜色强度。最初Moser的配方在玻璃熔体中使用了大约5%的氧化钕,这个数量足以让Moser将这些称为“稀土掺杂”玻璃。作为强碱,钕的含量会影响玻璃的熔化性能,因此玻璃的氧化钙含量可能必须做出相应的调整。[26]
透过钕玻璃的光线显示出异常锐利的吸收带。这些玻璃用于天文工作以产生清晰的吸收带,而谱线可以通过这些吸收带进行校准。[5]钕的另一个应用是创建选择性天文过滤器,以减少钠和荧光灯照明造成的光污染影响,同时通过其他颜色,尤其是来自星云的深红色的H-α谱线。[27]钕还用于去除由玻璃中的铁杂质引起的绿色。
钕是didymium(指钕和镨的混合物)的一种成分,用于给玻璃着色,制造焊工和吹玻璃工的护目镜。它尖锐的吸收带消除了589 nm处的强钠谱线。它可以吸收578 nm处的黄色汞谱线,这是在传统白色荧光灯下观察到钕玻璃为1蓝色的主要原因。钕和didymium做的玻璃用于室内摄影的色彩增强滤光片,特别是用于滤除白炽灯中的黄色调。同样的,钕玻璃也越来越直接地广泛用于白炽灯。这些灯的玻璃中含有钕以滤除黄光,从而产生更像阳光的白光。[28]与它在玻璃中的应用类似,钕盐也用作搪瓷的着色剂。[5]
| 钕 | |
|---|---|

| |
| 危险性 | |
GHS危险性符号
| |
| GHS提示词 | Warning |
| H-术语 | H315, H319, H335 |
| P-术语 | P261, P305+351+338[29] |
| NFPA 704 |
 0
2
0
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
金属钕的粉尘是可燃的,会引起爆炸。钕化合物和所有镧系元素化合物一样,具有中低毒性。然而,其毒性尚未得到彻底调查。钕粉尘和盐对眼睛和粘膜有很强的刺激性,对皮肤有中度刺激性。吸入钕粉尘会造成肺栓塞,累积接触会损害肝脏。钕也可作为抗凝剂,尤其是静脉注射时。[10]
钕磁铁已经过医疗用途的测试,例如磁性支架和骨骼修复,但生物相容性阻碍了其广泛应用。可商购的钕磁铁的磁性很强,在远处时仍可相互吸引。如果不小心,它们就会迅速并有力地吸引,造成受伤。有人使用两个钕磁铁从 50 厘米远的地方相互吸引时,直接夹断他的手指。 [30]
这些强力钕磁铁的另一个危害是当摄入不止一个钕磁铁时,它们会相互吸引并夹伤胃肠道中的软组织。这导致约 1700 次急诊室就诊 [31]和钕磁铁玩具的召回。[31][32]
- ^ “釢”亦为化学元素镎的旧译,因造成混淆而采用新译
- ^ 参见化学元素丰度
- ^ Gschneidner, K. A.; Eyring, L. Handbook on the Physics and Chemistry of Rare Earths. Amsterdam: North Holland. 1978. ISBN 0444850228.
- ^ Neodymium(Revised). [2019-04-17]. (原始内容存档于2018-01-29).
Neodymium Oxidation states & Compounds
- ^ Toshiba Develops Dysprosium-free Samarium-Cobalt Magnet to Replace Heat-resistant Neodymium Magnet in Essential Applications. Toshiba (2012-08-16). Retrieved on 2012-09-24.
- ^ 4.0 4.1 Gorman, Steve (August 31, 2009) As hybrid cars gobble rare metals, shortage looms, Reuters.
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 Haynes, William M. (编). Neodymium. Elements. CRC Handbook of Chemistry and Physics 97th. CRC Press. 2016: 4.23. ISBN 9781498754293.
- ^ Andrej Szytula; Janusz Leciejewicz. Handbook of Crystal Structures and Magnetic Properties of Rare Earth Intermetallics. CRC Press. 8 March 1994: 1. ISBN 978-0-8493-4261-5.
- ^ Chemical reactions of Neodymium. Webelements. [2012-08-16].
- ^ v. Welsbach, Carl Auer. Die Zerlegung des Didyms in seine Elemente. Monatshefte für Chemie und verwandte Teile anderer Wissenschaften. 1885, 6 (1): 477–491. S2CID 95838770. doi:10.1007/BF01554643.
- ^ Krishnamurthy, N.; Gupta, C. K. Extractive Metallurgy of Rare Earths. CRC Press. 2004: 6. ISBN 978-0-203-41302-9.
- ^ 10.0 10.1 10.2 Emsley, John. Nature's building blocks: an A–Z guide to the elements
 . Oxford University Press. 2003: 268–270. ISBN 0-19-850340-7.
. Oxford University Press. 2003: 268–270. ISBN 0-19-850340-7.
- ^ Weeks, Mary Elvira. The discovery of the elements. XVI. The rare earth elements. Journal of Chemical Education. 1932, 9 (10): 1751. Bibcode:1932JChEd...9.1751W. doi:10.1021/ed009p1751.
- ^ Weeks, Mary Elvira. The discovery of the elements 6th. Easton, PA: Journal of Chemical Education. 1956.
- ^ Marshall, James L. Marshall; Marshall, Virginia R. Marshall. Rediscovery of the elements: The Rare Earths–The Confusing Years (PDF). The Hexagon. 2015: 72–77 [30 December 2019].
- ^ Marshall, James L. Marshall; Marshall, Virginia R. Marshall. Rediscovery of the elements: The Rare Earths–The Last Member (PDF). The Hexagon. 2016: 4–9 [30 December 2019].
- ^ Hudson Institute of Mineralogy. Mindat.org. 1993–2018.
- ^ Rare Earths. Archive United States Geological Survey, January 2016.
- ^ Honda co-develops first hybrid car motor free of heavy rare earth metals. Reuters. 12 July 2016.
- ^ Honda's Heavy Rare Earth-Free Hybrid Motors Sidestep China. Bloomberg.com. 12 July 2016.
- ^ "Greenland to hold election watched closely by global mining industry" reuters.com. Retrieved 31 March 2021.
- ^ Wei, Y. and Zhou, X. The Effect of Neodymium (Nd3+) on Some Physiological Activities in Oilseed Rape during Calcium (Ca2+) Starvation. 10th International Rapeseed Congress. 1999, 2: 399.
- ^ Team finds Earth's 'oldest rocks'. BBC news (London). 2008-09-26 [2009-06-06].
- ^ Tachikawa, K. Neodymium budget in the modern ocean and paleo-oceanographic implications. Journal of Geophysical Research. 2003, 108 (C8): 3254. Bibcode:2003JGRC..108.3254T. doi:10.1029/1999JC000285
 .
.
- ^ van de Flierdt, Tina; Griffiths, Alexander M.; Lambelet, Myriam; Little, Susan H.; Stichel, Torben; Wilson, David J. Neodymium in the oceans: a global database, a regional comparison and implications for palaeoceanographic research. Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences. 2016-11-28, 374 (2081): 20150293. Bibcode:2016RSPTA.37450293V. PMC 5069528
 . PMID 29035258. doi:10.1098/rsta.2015.0293.
. PMID 29035258. doi:10.1098/rsta.2015.0293.
- ^ Umut Kamber; Anders Bergman; Andreas Eich; Diana Iuşan; Manuel Steinbrecher; Nadine Hauptmann; Lars Nordström; Mikhail I. Katsnelson; Daniel Wegner; Olle Eriksson; Alexander A. Khajetoorians. Self-induced spin glass state in elemental and crystalline neodymium. May 29, 2020 [29 May 2020].
- ^ Radboud University Nijmegen. New 'Whirling' State of Matter Discovered: Self-Induced Spin Glass. May 28, 2020 [29 May 2020].
- ^ Bray, Charles. Dictionary of glass: materials and techniques
 . University of Pennsylvania Press. 2001: 102. ISBN 0-8122-3619-X.
. University of Pennsylvania Press. 2001: 102. ISBN 0-8122-3619-X.
- ^ Baader Neodymium Filter, First Light Optics.
- ^ History of Light, subheading "Timeline", 2001. [2010-08-23]. (原始内容存档于2010-02-13).
- ^ Neodymium 261157. Sigma-Aldrich.
- ^ Swain, Frank. How to remove a finger with two super magnets. Seed Media Group LLC. March 6, 2009 [2013-03-31].
- ^ 31.0 31.1 Abrams, Rachel. After Two-Year Fight, Consumer Agency Orders Recall of Buckyballs. New York Times. July 17, 2014 [2014-07-21].
- ^ Balistreri, William F. Neodymium Magnets:Too Attractive?. Medscape Gastroenterology. 2014.
- 元素钕在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钕(英文)
- 元素钕在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钕在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钕(英文)
- "Neodymium(Revised)". Retrieved 2019-04-17. Neodymium Oxidation states & Compounds

