锇(拼音:é,注音:ㄜˊ,粤拼:ngo4,音同“鹅”;英语:Osmium;旧译銤[2]、鐭),是一种化学元素,其化学符号为Os,原子序数为76,原子量为190.23 u。锇是一种坚硬、易碎的铂系过渡金属,具有独特的蓝白色光泽。锇是自然界中密度最高的元素,密度有22.59 g/cm3。锇一般以痕量存在于自然中,大部分在铂矿藏的合金当中,是地壳中存量最低的稳定元素之一。锇与铂、铱及其他铂系元素形成的合金具有超强的耐用性和硬度,能用于制造钢笔笔头和电触头等。[3]但由于锇金属坚硬易碎且熔点极高,难以塑形、加工,且在空气中容易形成具高挥发性和高毒性的四氧化锇,再加上锇本身非常稀有且昂贵,因此金属态的锇应用很少。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银色,蓝色光泽 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 锇(Osmium)·Os·76 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 8 ·6·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 190.23 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Xe] 4f14 5d6 6s2 2, 8, 18, 32, 14, 2 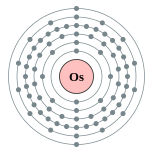 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 史密森·特南特(1803年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 史密森·特南特(1803年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 22.59 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 20 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 3306 K,3033 °C,5491 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 5285 K,5012 °C,9054 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 57.85 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 738 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 24.7 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 8, 7, 6, 5, 4, 3, 2, 1, 0, -1, -2 (微酸性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.2(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:840 kJ·mol−1 第二:1600 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 135 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 144±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (0 °C)81.2 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 87.6 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)5.1 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)4940 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 222 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 462 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 7.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 3920 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-04-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:锇的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
物理性质

锇呈蓝白色,其密度比铱稍高,是密度最高的稳定元素。[4]从X射线散射数据计算出的密度数值最准确。这种方法得出铱的密度为22.562 ± 0.009 g/cm3,而锇的密度为22.587 ± 0.009 g/cm3。[5]
锇金属坚硬,在高温下可保持光泽。锇的压缩性非常低,因此体积模量非常高,在395和462 GPa之间,与钻石的443 GPa相约。在压力为4 GPa的情况下,锇的硬度也比较高。[6][7][8]由于坚硬易碎,蒸气压低(铂系元素中最低),熔点极高(所有元素中第四高),所以固体锇很难塑形,生产过程十分困难。
化学性质
| 锇的氧化态 | |
|---|---|
| −2 | Na2[Os(CO)4] |
| −1 | Na2[Os4(CO)13] |
| 0 | Os3(CO)12 |
| +1 | OsI |
| +2 | OsI2 |
| +3 | OsBr3 |
| +4 | OsO2、OsCl4 |
| +5 | OsF5 |
| +6 | OsF6 |
| +7 | OsOF5 |
| +8 | OsO4, Os(NCH3)4 |
锇可以形成氧化态为−2至+8的化合物。最常见的氧化态有+2、+3、+4和+8。+8态是任何元素可达至的最高氧化态,除锇以外拥有+8态的只有氙、[9][10]钌、[11]𬭶、[12]铱、[13]钚[14]和锔(尚未确定)。[15]氧化态为−1和−2的Na2[Os4(CO)13]和Na2[Os(CO)4]反应性很强,可用于合成锇的原子簇化合物。[16][17]
最常见的+8态化合物是锇粉末在空气中形成的四氧化锇。四氧化锇是一种浅黄色晶体,挥发性高,可溶于水,味道很强,具有毒性。锇粉末的味道与四氧化锇一样。[18]四氧化锇与碱反应会形成红色的锇酸OsO4(OH)2−2,与氨则形成次氮基锇酸OsO3N−。[19][20][21]四氧化锇在130 °C气化,是一种强氧化剂。相比之下,二氧化锇(OsO2)则是黑色的不挥发物质,反应性和毒性也远低于四氧化锇。
具有主要用途的锇化合物只有两种:四氧化锇在电子显微镜照相中用以对组织染色,并在有机合成过程中作烯烃的氧化剂;不挥发的锇酸盐则用在有机氧化反应当中。[22]
锇可以形成各种卤化物,包括五氟化锇(OsF5)、三氯化锇(OsCl3)、三溴化锇(OsBr3)、三碘化锇(OsI3)等等。锇的氧化态较低时,大直径的卤素可以使两者的化合物更加稳定,所以以上的三卤化物存在,但三氟化锇(OsF3)尚未被发现。唯一一种氧化态为+1的锇化合物是碘化锇(OsI)。锇在一些羰基配合物中的氧化态为0,例如十二羰基三锇(Os3(CO)12)。[19][20][23][24]
锇在氧化态较低时,强σ供体(如胺)和π受体(含氮的杂环化合物)都可以增加其稳定性;氧化态较高时,强σ和π供体都可增强稳定性,如O2−和N3−。[25]
虽然锇能以多种氧化态形成化合物,但是纯金属锇在标准温度和压力下可抗御所有酸和碱的侵蚀,甚至包括王水。
同位素
锇共有7种自然产生的同位素,其中6种为稳定同位素:184Os、187Os、188Os、189Os、190Os和(比例最高的)192Os。186Os会进行α衰变,但由于半衰期长达(2.0 ± 1.1)×1015年,所以一般可当做稳定同位素。所有稳定同位素都预测可以进行α衰变,但由于半衰期很长,因而只有186Os的衰变得到了实验证实。理论预测,184Os和192Os可进行双β衰变,但这尚无实验证据。[26]
187Os是187Re的衰变产物(半衰期为4.56×1010年),被广泛用于测定地球岩石以及陨石的年龄(见铼锇定年法)。此同位素还可以用于测量大陆风化的强度,及推断大陆稳定地块根部的地幔在何时稳定下来。含铼矿石中含有异常高的187Os,也是因为这一衰变。[27]然而最为常用的锇定年法则是铱锇定年法。这种方法可分析K-T界线上的冲击石英,也就是6600万年前恐龙灭绝时所留下的地质特征。[28]
1803年,史密森·特南特和威廉·海德·沃拉斯顿在英国伦敦发现了锇元素。[29]锇的发现与铂以及其他铂系元素息息相关。17世纪,人们在哥伦比亚乔科省的银矿中发现了铂。[30]化学家后来发现这种金属不是合金,而是一种新元素,并在1748年发表了这一发现。[31]他们将铂溶于王水(盐酸和硝酸的混合物),以产生稳定的盐。每一次实验都有留有少量黑色的不可溶残留物。[32]约瑟夫·普鲁斯特以为残留物是石墨。[32]维多·科莱-德科提尔(Victor Collet-Descotils)、福尔克拉伯爵安东万·弗朗索瓦(Antoine François, comte de Fourcroy)和路易-尼古拉·沃克兰在1803年同样观测到这一残留物,但因未能取得足够的物质而无法进行更多的实验。[32]
1803年,史密森·特南特分析了这些残留物,并推断其中必含新的金属元素。沃克朗把该粉末来回在酸碱中浸洗,[33]取得了一种挥发性氧化物。他认为这是新元素的氧化物,并把新元素命名为“ptene”,源于希腊文的“πτηνος”(ptènos),即“有翼的”。[34][35]特南特则拥有更大量的残留物,并在不久后辨认出两种新元素,也就是锇和铱。[32][33]他再对产物加入氢氧化钠,在加热后制成了一种黄色溶液(很可能是顺[Os(OH)2O4]2−)。溶液经过酸化后,他用蒸馏法取得了OsO4。[34]由于制成的四氧化锇具有强烈的焦味,所以他把这一新元素命名为现名“osmium”,源于希腊文“οσμή”(osme),即“臭味”。[36]锇元素的发现被记录在1804年6月21日致皇家学院的一封信中。[32][37]
铀和锇在形成氨的哈柏法中是有效的催化剂,这使该方法可以得到广泛应用。当时在BASF一个以卡尔·博施为首的团队购入了世界上大部分的锇来作催化剂。1908年,同一个团队发现了使用铁和氧化铁的更为便宜的催化剂,因此无须再使用昂贵稀少的锇元素。[38]
今天,锇主要是从铂和镍矿石中提取出来的。[39]

锇是地球地壳中最稀有的稳定元素,在大陆地壳里的平均质量比例只有1千亿分之5。[40]
锇在自然中以纯金属或合金的形态出现,尤其是各种比例的铱﹣锇合金。[33]镍和铜矿藏中还含有锇和铱的硫化物、碲化物、锑化物和砷化物。与其他铂系元素一样,锇可以形成自然镍合金及铜合金。[41]
地壳中有三种地质结构的锇含量最高:火成岩、撞击坑以及前二者演化而成的地质结构。最大的已知矿藏有南非的布什维尔德火成杂岩体、[42]俄罗斯的诺里尔斯克及加拿大的索德柏立盆地等。美国有较小的锇矿藏。[42]前哥伦布时期哥伦比亚乔科省居民所用的冲积层矿藏至今仍是铂系元素的一大来源。第二大的冲积层矿藏位于俄罗斯乌拉尔山脉。[39][43]

锇是镍和铜开采和提炼过程的副产品。在镍和铜的电解精炼过程中,金、银等贵金属、铂系元素以及硒和碲等非金属元素都会积聚在正电极上。[44][45]这一泥状物质要进入溶液才可把其中的金属分离出来。具体方法取决于混合物的成分,但主要有两种:加入过氧化钠后溶于王水,或直接溶于氯和氢氯酸的混合溶液。[42][46]锇、钌、铑和铱不可溶于王水,可从铂、金等金属分离开来。铑与熔化的硫酸氢钠反应后会再分离出来。剩余的物质中含有钌、锇和铱,其中铱不可溶于氧化钠。加入氧化钠会产生水溶的钌盐和锇盐,而在氧化后,这些盐会变成挥发性的RuO4和OsO4。氯化铵可将前者沉淀为(NH4)3RuCl6。
溶解后的锇要从其他铂系元素中分离出来。分离方法包括蒸馏法和用适当的有机溶剂把四氧化锇提取出来。[47]特南特和沃拉斯顿所用的方法类似于前者。两种方法所得出的产物与氢进行还原反应,产生粉状或海绵状锇粉末,再经粉末冶金手法进行加工。[48]
锇生产商和美国地质调查局都没有公布锇的产量数据。1971年发布的数字当中,[49]单在美国的消耗量共有2000金衡盎司(62公斤),意味着产量低于每年1吨。2012年美国锇产量的估值为75公斤。[50]
锇一般以99%或更高纯度的粉末的形式出售。锇的量度单位可以采用金衡制或公制。2012年锇的价格约为每金衡盎司400美元(每克13美元)。[51][52]
由于锇的氧化物具有高挥发性和高毒性,而锇金属容易形成氧化物,所以其金属态的应用很少。人们一般使用的是耐用性很强的锇合金。铱锇合金非常坚硬,可同其他铂系金属用于制造需耐用的钢笔笔头、机器枢轴及电触头等。1945年至1955年左右的留声机唱针头也含有铱锇合金。虽然锇合金比钢和铬耐用,但是却远比蓝宝石和钻石逊色,因此最终被淘汰了。[53]
四氧化锇可用于指纹识别,[54]以及在光学和电子显微镜照相中对脂组织进行染色。四氧化锇的氧化性很强,所以能与未饱和碳﹣碳键反应,从而连接油脂。因此在染色的同时,它还会固定生物膜。锇原子的电子密度极高,在透射电子显微镜(TEM)下能大大提高对比度。未经处理的碳物质在TEM下的对比度很低(见图)。[22]铁氰化锇(OsFeCN)也有染色兼固定的性质。[55]
四氧化锇和锇酸钾是化学合成过程中重要的氧化剂,但都是剧毒。夏普莱斯不对称双羟基化反应中,锇酸将双键转换为邻二醇。巴里·夏普莱斯因这一发现而在2001年获得诺贝尔化学奖。[56][57]OsO4非常昂贵,所以化学家一般改用KMnO4。虽然产量会降低,但后者的价格远没有锇高。[58]
1898年,奥地利化学家卡尔·奥尔·冯·威尔士巴赫(Auer von Welsbach)发明了用锇作为灯丝的电灯,并在1902年推出市场。不过,钨的熔点是所有金属中最高的,用于电灯时还能增加光效和延长灯泡寿命,所以在几年后就把锇淘汰了。[34]
和钯相似,锇粉末可有效吸收氢原子,因此有潜力作金属氢化物电池电极。不过锇价格高昂,而且会与氢氧化钾(最常用的电池电解质)反应。[59]
锇的紫外线反射率很高:锇对600 Å波长的反射率是金的两倍。[60]锇因此被用于大小有限的太空紫外光谱仪。多个太空航天飞机任务曾搭载镀锇镜子进入太空,但不久后人们发现近地轨道中的氧自由基足以破坏锇涂层。[61]
斯堪的纳维亚的某些医院在对关节炎病人进行滑膜切除术时,[62]需病人服食四氧化锇(OsO4)。虽然四氧化锇有毒,但并没有病人长期副作用的报告,因此某些锇化合物可能可以和生物体相容。2011年,科学家宣称锇(VI)[63]和锇(II)[64]化合物在活体内有抗癌的作用,且有潜力作抗癌药物。[65]
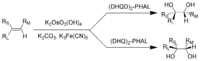
夏普莱斯不对称双羟基化反应:RL=大取代基,RM=中取代基,RS=小取代基
![锇、银和金制镜子在太空任务之后因氧化而变黑[66][67]](/img/wiki/Os/123px-NASAmirroroxidation.jpg)
锇、银和金制镜子在太空任务之后因氧化而变黑[66][67]
锇金属粉末可自燃。[49]锇在室温下会和空气中的氧反应,形成挥发性四氧化锇。某些锇化合物在有氧环境下也会转变成四氧化锇。[49]
四氧化锇的挥发性很高,能轻易穿透皮肤,且经吸入、进食和皮肤接触后都是毒物。[68]如果空气中含有低浓度四氧化锇,会造成肺淤血及皮肤和眼部损害,因此四氧化锇必须在通风柜内处理。[18]粟米油等含多元不饱和脂肪的植物油可迅速将四氧化锇还原成相对惰性的化合物。[69]
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ “銤”亦为化学元素镅的旧译,因造成混淆而采用新译
- ^ Hammond "Osmium", C. R., p. 4–25 in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Arblaster, J. W. Densities of osmium and iridium: recalculations based upon a review of the latest crystallographic data (PDF). Platinum Metals Review. 1989, 33 (1): 14–16 [2013-12-25]. (原始内容 (PDF)存档于2012-02-07).
- ^ Arblaster, J. W. Osmium, the Densest Metal Known. Platinum Metals Review. 1995, 39 (4): 164 [2013-12-25]. (原始内容存档于2011-09-27).
- ^ Weinberger, Michelle; Tolbert, Sarah; Kavner, Abby. Osmium Metal Studied under High Pressure and Nonhydrostatic Stress. Phys. Rev. Lett. 2008, 100 (4): 045506. Bibcode:2008PhRvL.100d5506W. PMID 18352299. doi:10.1103/PhysRevLett.100.045506.
- ^ Cynn, Hyunchae; Klepeis, J. E.; Yeo, C. S.; Young, D. A. Osmium has the Lowest Experimentally Determined Compressibility. Physical Review Letters. 2002, 88 (13): 135701. Bibcode:2002PhRvL..88m5701C. PMID 11955108. doi:10.1103/PhysRevLett.88.135701.
- ^ Sahu, B. R.; Kleinman, L. Osmium Is Not Harder Than Diamond. Physical Review B. 2005, 72 (11): 113106. Bibcode:2005PhRvB..72k3106S. doi:10.1103/PhysRevB.72.113106.
- ^ Selig, H.; Claassen, H. H.; Chernick, C. L.; Malm, J. G.; Huston, J. L. Xenon tetroxide – Preparation + Some Properties. Science. 1964, 143 (3612): 1322–3. Bibcode:1964Sci...143.1322S. JSTOR 1713238. PMID 17799234. doi:10.1126/science.143.3612.1322.
- ^ Huston, J. L.; Studier, M. H.; Sloth, E. N. Xenon tetroxide – Mass Spectrum. Science. 1964, 143 (3611): 1162–3. Bibcode:1964Sci...143.1161H. JSTOR 1712675. PMID 17833897. doi:10.1126/science.143.3611.1161-a.
- ^ Barnard, C. F. J. Oxidation States of Ruthenium and Osmium. Platinum Metals Review. 2004, 48 (4): 157. doi:10.1595/147106704X10801.
- ^ Chemistry of Hassium (PDF). Gesellschaft für Schwerionenforschung mbH. 2002 [2007-01-31]. (原始内容存档 (PDF)于2012-01-14).
- ^ Gong, Yu; Zhou, Mingfei; Kaupp, Martin; Riedel, Sebastian. Formation and Characterization of the Iridium Tetroxide Molecule with Iridium in the Oxidation State +VIII. Angewandte Chemie International Edition. 2009, 48 (42): 7879. doi:10.1002/anie.200902733.
- ^ Domanov, V. P.; Lobanov, Yu. V. Refinement of data on the volatility of octavalent plutonium in the form of tetraoxide PuO4. Radiochemistry (SP MAIK Nauka/Interperiodica). February 2009, 51 (1): 14–17. doi:10.1134/S1066362209010044.
- ^ Domanov, V. P. Possibility of generation of octavalent curium in the gas phase in the form of volatile tetraoxide CmO4. Radiochemistry (SP MAIK Nauka/Interperiodica). January 2013, 55 (1): 46–51. doi:10.1134/S1066362213010098.
- ^ Krause, J.; Siriwardane, Upali; Salupo, Terese A.; Wermer, Joseph R.; Knoeppel, David W.; Shore, Sheldon G. Preparation of [Os3(CO)11]2− and its reactions with Os3(CO)12; structures of [Et4N] [HOs3(CO)11] and H2OsS4(CO). Journal of Organometallic Chemistry. 1993, 454: 263–271. doi:10.1016/0022-328X(93)83250-Y.
- ^ Carter, Willie J.; Kelland, John W.; Okrasinski, Stanley J.; Warner, Keith E.; Norton, Jack R. Mononuclear hydrido alkyl carbonyl complexes of osmium and their polynuclear derivatives. Inorganic Chemistry. 1982, 21 (11): 3955–3960. doi:10.1021/ic00141a019.
- ^ 18.0 18.1 Mager Stellman, J. Osmium. Encyclopaedia of Occupational Health and Safety. International Labour Organization. 1998: 63.34. ISBN 978-92-2-109816-4. OCLC 35279504 45066560 请检查
|oclc=值 (帮助). - ^ 19.0 19.1 Holleman, A. F.; Wiberg, E.; Wiberg, N. Inorganic Chemistry, 1st Edition. Academic Press. 2001. ISBN 0-12-352651-5. OCLC 47901436.
- ^ 20.0 20.1 Griffith, W. P. Osmium and its compounds. Quarterly Review of the Chemical Society. 1965, 19 (3): 254–273. doi:10.1039/QR9651900254.
- ^ Subcommittee on Platinum-Group Metals, Committee on Medical and Biologic Effects of Environmental Pollutants, Division of Medical Sciences, Assembly of Life Sciences, National Research Council. Platinum-group metals. National Academy of Sciences. 1977: 55. ISBN 0-309-02640-7.
- ^ 22.0 22.1 Bozzola, John J.; Russell, Lonnie D. Specimen Preparation for Transmission Electron Microscopy. Electron microscopy : principles and techniques for biologists. Sudbury, Mass.: Jones and Bartlett. 1999: 21–31. ISBN 978-0-7637-0192-5.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997: 1113–1143, 1294. ISBN 0-7506-3365-4. OCLC 213025882 37499934 41901113 请检查
|oclc=值 (帮助). - ^ Gulliver, D. J; Levason, W. The chemistry of ruthenium, osmium, rhodium, iridium, palladium and platinum in the higher oxidation states. Coordination Chemistry Reviews. 1982, 46: 1–127. doi:10.1016/0010-8545(82)85001-7.
- ^ Peter A. Lay; W. Dean Harman. Advances in Inorganic Chemistry. A. G. Sykes. Academic Press. 1992: 221. ISBN 0-12-023637-0.
- ^ Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ Dąbek, Józef; Halas, Stanislaw. Physical Foundations of Rhenium-Osmium Method – A Review. Geochronometria. 2007, 27: 23–26. doi:10.2478/v10003-007-0011-4.
- ^ Alvarez, L. W.; Alvarez, W.; Asaro, F.; Michel, H. V. Extraterrestrial cause for the Cretaceous–Tertiary extinction. Science. 1980, 208 (4448): 1095–1108. Bibcode:1980Sci...208.1095A. PMID 17783054. doi:10.1126/science.208.4448.1095.
- ^ Venetskii, S. I. Osmium. Metallurgist. 1974, 18 (2): 155–157. doi:10.1007/BF01132596.
- ^ McDonald, M. The Platinum of New Granada: Mining and Metallurgy in the Spanish Colonial Empire. Platinum Metals Review. 959, 3 (4): 140–145 [2013-12-25]. (原始内容存档于2011-06-09).
- ^ Juan, J.; de Ulloa, A. Relación histórica del viage a la América Meridional 1. 1748: 606 (西班牙语).
- ^ 32.0 32.1 32.2 32.3 32.4 Hunt, L. B. A History of Iridium (PDF). Platinum Metals Review. 1987, 31 (1): 32–41 [2012-03-15]. (原始内容存档 (PDF)于2012-03-04).
- ^ 33.0 33.1 33.2 Emsley, J. Osmium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2003: 199–201. ISBN 0-19-850340-7.
- ^ 34.0 34.1 34.2 Griffith, W. P. Bicentenary of Four Platinum Group Metals. Part II: Osmium and iridium – events surrounding their discoveries. Platinum Metals Review. 2004, 48 (4): 182–189. doi:10.1595/147106704X4844.
- ^ Thomson, T. A System of Chemistry of Inorganic Bodies. Baldwin & Cradock, London; and William Blackwood, Edinburgh. 1831: 693.
- ^ Weeks, M. E. Discovery of the Elements 7. Journal of Chemical Education. 1968: 414–418. ISBN 0-8486-8579-2. OCLC 23991202.
- ^ Tennant, S. On Two Metals, Found in the Black Powder Remaining after the Solution of Platina. Philosophical Transactions of the Royal Society. 1804, 94: 411–418. JSTOR 107152. doi:10.1098/rstl.1804.0018.
- ^ Smil, Vaclav. Enriching the Earth: Fritz Haber, Carl Bosch, and the Transformation of World Food Production. MIT Press. 2004: 80–86. ISBN 978-0-262-69313-4.
- ^ 39.0 39.1 George, Micheal W. 2006 Minerals Yearbook: Platinum-Group Metals (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- ^ Wedepohl, Hans K. The composition of the continental crust. Geochimica et Cosmochimica Acta. 1995, 59 (7): 1217–1232. Bibcode:1995GeCoA..59.1217W. doi:10.1016/0016-7037(95)00038-2.
- ^ Xiao, Z.; Laplante, A. R. Characterizing and recovering the platinum group minerals—a review. Minerals Engineering. 2004, 17 (9–10): 961–979. doi:10.1016/j.mineng.2004.04.001.
- ^ 42.0 42.1 42.2 Seymour, R. J.; O'Farrelly, J. I. Platinum-group metals. Kirk Othmer Encyclopedia of Chemical Technology. Wiley. 2001. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- ^ Commodity Report: Platinum-Group Metals (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- ^ George, M. W. Platinum-group metals (PDF). U.S. Geological Survey Mineral Commodity Summaries (USGS Mineral Resources Program). 2008 [2013-12-25]. (原始内容存档 (PDF)于2019-01-11).
- ^ George, M. W. 2006 Minerals Yearbook: Platinum-Group Metals (PDF). United States Geological Survey USGS. [2008-09-16]. (原始内容存档 (PDF)于2019-01-11).
- ^ Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R. Platinum group metals and compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2002. doi:10.1002/14356007.a21_075.
- ^ Gilchrist, Raleigh. The Platinum Metals. Chemical Reviews. 1943, 32 (3): 277–372. doi:10.1021/cr60103a002.
- ^ Hunt, L. B.; Lever, F. M. Platinum Metals: A Survey of Productive Resources to industrial Uses (PDF). Platinum Metals Review. 1969, 13 (4): 126–138 [2008-10-02]. (原始内容 (PDF)存档于2008-10-29).
- ^ 49.0 49.1 49.2 Smith, Ivan C.; Carson, Bonnie L.; Ferguson, Thomas L. Osmium: An Appraisal of Environmental Exposure. Environmental Health Perspectives. 1974, 8: 201–213. JSTOR 3428200. PMC 1474945
 . PMID 4470919. doi:10.2307/3428200.
. PMID 4470919. doi:10.2307/3428200.
- ^ PLATINUM-GROUP METALS (PDF). USGS. [27 May 2013]. (原始内容存档 (PDF)于2017-05-13).
- ^ Osmium (页面存档备份,存于互联网档案馆). Los Alamos National Laboratory's Chemistry Division
- ^ Live Osmium prices (页面存档备份,存于互联网档案馆). TaxFreeGold.com. Accessed 6 April 2010
- ^ Stephen D. Cramer and Bernard S. Covino, Jr.; Bernard S. Covino, Jr. ASM Handbook Volume 13B. Corrosion: Materials. ASM International. 2005. ISBN 978-0-87170-707-9.
- ^ MacDonell, Herbert L. The Use of Hydrogen Fluoride in the Development of Latent Fingerprints Found on Glass Surfaces. The Journal of Criminal Law, Criminology, and Police Science. 1960, 51 (4): 465–470. JSTOR 1140672. doi:10.2307/1140672.
- ^ Chadwick, D. Role of the sarcoplasmic reticulum in smooth muscle. John Wiley and Sons. 2002: 259–264. ISBN 0-470-84479-5.
- ^ Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B. Catalytic Asymmetric Dihydroxylation. Chemical Reviews. 1994, 94 (8): 2483–2547. doi:10.1021/cr00032a009.
- ^ Colacot, T. J. 2001 Nobel Prize in Chemistry (PDF). Platinum Metals Review. 2002, 46 (2): 82–83 [2013-12-25]. (原始内容 (PDF)存档于2013-01-31).
- ^ Osmium tetroxide as a reagent in organic chemistry — Master Organic Chemistry (页面存档备份,存于互联网档案馆). Masterorganicchemistry.com. Retrieved on 2012-12-07.
- ^ Antonov, V. E.; Belash, I. T.; Malyshev, V. Yu.; Ponyatovsky, E. G. The Solubility of Hydrogen in the Platinum Metals under High Pressure (PDF). Platinum Metals Revie. 1984, 28 (4): 158–163 [2013-12-25]. (原始内容 (PDF)存档于2013-01-31).
- ^ Torr, Marsha R. Osmium coated diffraction grating in the Space Shuttle environment: performance. Applied Optics. 1985, 24 (18): 2959. Bibcode:1985ApOpt..24.2959T. PMID 18223987. doi:10.1364/AO.24.002959.
- ^ Gull, T. R.; Herzig, H; Osantowski, JF; Toft, AR. Low earth orbit environmental effects on osmium and related optical thin-film coatings. Applied Optics. 1985, 24 (16): 2660. Bibcode:1985ApOpt..24.2660G. PMID 18223936. doi:10.1364/AO.24.002660.
- ^ Sheppeard, H.; D. J. Ward. Intra-articular osmic acid in rheumatoid arthritis: five years' experience. Rheumatology. 1980, 19 (1): 25–29. PMID 7361025. doi:10.1093/rheumatology/19.1.25.
- ^ Lau, T.-C; W.-X. Ni, W.-L. Man, M. T.-W. Cheung, R. W.-Y. Sun, Y.-L. Shu, Y.-W. Lam, C.-M. Che. Osmium(vi) complexes as a new class of potential anti-cancer agents. Chem. Commun. 2011, 47 (7): 2140–2142. doi:10.1039/C0CC04515B.
- ^ Sadler, Peter; Steve D. Shnyder, Ying Fu, Abraha Habtemariam, Sabine H. van Rijt, Patricia A. Cooper, Paul M. Loadman. Anti-colorectal cancer activity of an organometallic osmium arene azopyridine complex. Med. Chem. Commun. 2011, 2 (7): 666–668. doi:10.1039/C1MD00075F.
- ^ Fu, Ying; Romero, María J.; Habtemariam, Abraha; et al. The contrasting chemical reactivity of potent isoelectronic iminopyridine and azopyridine osmium(II) arene anticancer complexes. Chemical Science. 2012, 3 (8): 2485–2494. doi:10.1039/C2SC20220D.
- ^ Second LDEF post-retrieval symposium interim results of experiment A0034 (PDF). NASA. [2009-06-06]. (原始内容存档 (PDF)于2010-05-22).
- ^ Linton, Roger C.; Kamenetzky, Rachel R.; Reynolds, John M.; Burris, Charles L. LDEF experiment A0034: Atomic oxygen stimulated outgassing. In NASA. Langley Research Center (NASA). 1992: 763. Bibcode:1992ldef.symp..763L.
- ^ Luttrell, William E.; Giles, Cory B. Toxic tips: Osmium tetroxide. Journal of Chemical Health and Safety. 2007, 14 (5): 40–41. doi:10.1016/j.jchas.2007.07.003.
- ^ How to Handle Osmium Tetroxide. University of California, San Diego. [2009-06-02]. (原始内容存档于2006-02-21).
- 元素锇在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锇(英文)
- 元素锇在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锇在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锇(英文)

