
磷(拼音:lín,注音:ㄌ丨ㄣˊ,粤拼:leon4;英语:Phosphorus;源于拉丁语:Phosphorum),是一种化学元素,其化学符号为P,原子序数为15,原子量为30.973762 u。[5]
白烟:
在化学史上第一个发现磷元素的人,当推十七世纪的一个德国汉堡商人亨尼格·布兰德(Henning Brand,约1630年~约1710年)。他是一个相信炼金术的人,在三十年战争时他担任初级军官,战争结束后成为玻璃工匠的学徒。后来他娶了一位有钱人的女儿。丰饶的嫁妆让他从此不愁吃穿,所以他开始追求他真正的兴趣,也就是寻找贤者之石,而当时的社会相信贤者之石要透过炼金术才能制成。当时社会相信,贤者之石可以把所有东西变成黄金,甚至可以让人长生不老。
然而,反复的实验失败终究还是花光了他的所有积蓄。更不幸的是他妻子也过世了。之后他又娶了另一位女人,这位后来娶的妻子不只带给他财富让他可以继续实验,也给他一个儿子可以在实验室帮他的忙。
由于他相信人体本身就是一种炼金术,因为从嘴巴吃进去的跟排泄出来的物质完全不一样。所以他使用尿作了大量实验。1669年,他在一次实验中,将砂、木炭、石灰等和尿混合,加热蒸馏,虽没有得到黄金,而竟意外地得到一种十分美丽的物质,它色白质软,能在黑暗的地方放出闪烁的亮光,于是波兰特给它取了个名字,叫“冷光”,这就是今日称之为白磷的物质。波兰特对制磷之法,起初极守秘密,不过,他发现这种新物质的消息立刻传遍了德国。[7]
磷的现代制法是将磷酸钙与砂(主要成分为二氧化硅)及焦炭一起放在电炉中加热。为使反应式易于理解,可写成两步如下:
含氧酸
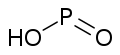
磷的含氧酸非常丰富,结构较为复杂,且大多具有商业价值。这些含氧酸都有和氧相连的氢原子,可以体现酸性,也有些有不体现酸性的直接连在磷上的氢原子。纵然许多磷的含氧酸已经被合成,但仅有以下几种是较常见的。其中的三种——次磷酸、亚磷酸和磷酸尤为重要。
磷(V)化合物









磷酸根中的氧可以被硫取代,如硫代磷酸。
多种硫化磷也是已知的。
磷是骨骼和牙齿的构成材料之一。正常成年人骨中的含磷总量约为600~900克,人体每100毫升全血中含磷35-45毫克。磷能保持人体内代谢平衡,在调节能量代谢过程中发挥重要作用。它是生命物质核苷酸的基本成分。它参与体内的酸碱平衡的调节,参与体内脂肪的代谢。
短时间内摄取一定分量的白磷单质,可造成急性白磷中毒。
- ^ cf. "Memoir on Combustion in General (页面存档备份,存于互联网档案馆)" Mémoires de l'Académie Royale des Sciences 1777, 592–600. from Henry Marshall Leicester and Herbert S. Klickstein, A Source Book in Chemistry 1400–1900 (New York: McGraw Hill, 1952)
- ^ webelements. [2013-09-01]. (原始内容存档于2008-05-12).
- ^ Ellis, Bobby D.; MacDonald, Charles L. B. Phosphorus(I) Iodide: A Versatile Metathesis Reagent for the Synthesis of Low Oxidation State Phosphorus Compounds. Inorganic Chemistry. 2006, 45 (17): 6864–74. PMID 16903744. doi:10.1021/ic060186o.
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 夏征农、陈至立 (编). 《辞海》第六版彩图本. 上海: 上海辞书出版社. 2009年: 第3227页. ISBN 9787532628599.
- ^ 无机化学丛书.第四卷.P195.张青莲 主编
- ^ TodayIFoundOut.com, Matt Blitz-. How One Man’s Love of Urine Led to the Discovery of Phosphorus. Gizmodo. [2020-02-06]. (原始内容存档于2020-02-06) (美国英语).
- ^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 978-0-444-89307-9.
- ^ Kutzelnigg, W. Chemical Bonding in Higher Main Group Elements (PDF). Angewandte Chemie Int. (English) Ed. 1984, 23 (4): 272–295 [2014-04-27]. doi:10.1002/anie.198402721. (原始内容存档 (PDF)于2020-04-16).
- 元素磷在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 磷(英文)
- 元素磷在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素磷在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 磷(英文)

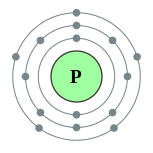
 。
。
 ,必须保存在水中。
,必须保存在水中。


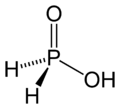

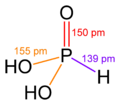

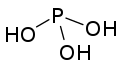

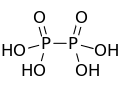

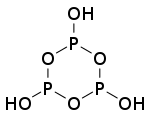
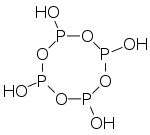
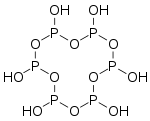

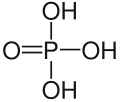


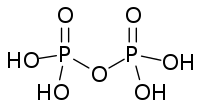

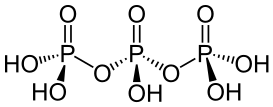
 ),它是一个呈
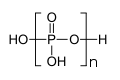
),它是一个呈 键的倾向。目前已知的聚磷酸衍生物已经有很多,比如
键的倾向。目前已知的聚磷酸衍生物已经有很多,比如 和
和 )脱水得到。例如,下列
)脱水得到。例如,下列