镅(英语:Americium;中国大陆译为镅、港澳译为鎇【拼音:méi,注音:ㄇㄟˊ,粤拼:mei4】,台湾译为鋂/𰾄【拼音:méi,注音:ㄇㄟˊ,粤拼:mui4】;),是一种人工合成的化学元素,其化学符号为Am,原子序数为95。镅属于锕系元素,是第三个超铀元素,具有高放射性。镅在元素周期表中位于镧系元素铕之下,是以发现所在的美洲大陆(America)命名的,对应以欧洲(Europe)命名的铕(Europium)。[2]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 镅(Americium)·Am·95 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 锕系元素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 不适用 ·7·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | (243) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Rn] 5f7 7s2 2, 8, 18, 32, 25, 8, 2 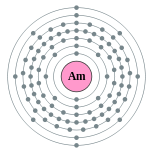 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 格伦·西奥多·西博格、Ralph A. James、Leon O. Morgan、阿伯特·吉奥索(1944年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 12 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1449 K,1176 °C,2149 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2880 K,2607 °C,4725 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 14.39 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 62.7 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸气压 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 7, 6, 5, 4, 3, 2 (两性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.3(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:578 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 173 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 180±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | 0.69[1] µ Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 10 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-35-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:镅的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
位于伯克利加州大学由格伦·西奥多·西博格领导的团队在1944年首次合成出了镅元素。虽然镅是第三个超铀元素,但其发现却晚于第四个超铀元素锔,是第四个被合成出的超铀元素。这项发现最初被列为机密,直到1945年才公诸于世。大部分的镅都是在核反应堆中以中子撞击铀或钚而形成的:一吨乏核燃料含有大约100克镅。镅元素主要用在商业电离烟雾探测器和仪表中,或用作中子源。有人提出用242mAm同位素制造核电池和太空船的核推进燃料,但因该同核异构体的稀少和昂贵而尚待实现。
镅是一种质地较软的放射性金属,外表呈银白色。镅的同位素中最常见的有241Am和243Am,其中243Am是镅最长寿的同位素,半衰期约7370年。在化合物中,特别是溶液中,镅的氧化态通常是+3。镅还有+2到+7之间的其他氧化态,可通过测量吸收光谱分辨出来。由于辐射变晶效应,镅固体和镅化合物的晶体结构本身含有缺陷。这些缺陷随时间而增加,因此其物质属性会进行变化。


虽然过去的核反应实验中很可能已经产生了镅元素,但是要直到1944年,伯克利加州大学的格伦·西奥多·西博格、Leon O. Morgan、Ralph A. James和阿伯特·吉奥索等人才首次专门合成并分离出镅。他们的实验使用了1.5米直径回旋加速器。[4]锔的化学辨认是在芝加哥大学的冶金实验室(现阿贡国家实验室)进行的。继更轻的镎、钚和更重的锔之后,镅是第四个被发现的超铀元素。当时西博格重新排列了元素周期表,并将锕系置于镧系之下。因此镅位于铕以下,两者为同系物。铕(Europium)是以欧洲大陆(Europe)命名的,镅也因此以美洲大陆(America)命名。[5][6][7]
锔的合成过程如下:首先将硝酸钚溶液涂在面积约为0.5 cm2的铂薄片上,蒸发后的残留物经退火转换为二氧化钚(PuO2)。二氧化钚在回旋加速器中受照射之后,产物溶于硝酸中,再用浓氨水沉淀为氢氧化物。沉淀物溶于高氯酸,再用离子交换分离出锔的某个同位素。由于锔和镅的分离过程十分繁复,以致发现团队最初称锔为Pandemonium(希腊文中意为“群魔殿”或“地狱”),并称镅为Delirium(拉丁文中意为“谵妄”)。[8][9][10][11]
最初的实验产生了四个镅同位素:241Am、242Am、239Am和238Am。钚在吸收一颗中子后,形成镅-241。该同位素释放一颗α粒子后,转变为237Np。这衰变的半衰期最初测定为510 ± 20年,但后来改为432.2年。[12]
在产生了241Am之后,对其进行中子撞击,可形成第二种同位素242Am。在迅速β衰变后,242Am会转变为锔同位素242Cm(此前已被发现)。这衰变的半衰期最初测定为17小时,目前则确定为16.02小时。[12]
锔和镅在1944年的发现与当时旨在制造原子弹的曼哈顿计划息息相关。有关其发现的信息一直保密到1945年才公诸于世。在1945年11月11日美国化学学会正式发布锔和镅的发现前5天,美国电台节目“Quiz Kids”(小朋友问答)的一位听众问到,战时除了镎和钚之外还有没有发现其他新的超铀元素,格伦·西博格回应时泄露了有关发现锔和镅的消息。[8]第一批镅元素样本只重几微克,肉眼仅仅可见,并需通过其放射性才能测出。1951年,科学家在1100 °C高真空中用钡金属还原三氟化镅,产生了可观量的镅金属,约重40至200微克。[13]
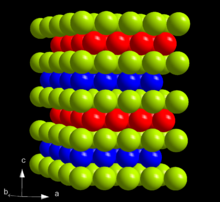
在元素周期表中,镅位于钚之右,锔之左,铕之下。镅是一种高放射性元素。刚制成的时候,镅外表呈银白色,具金属光泽,但在空气中会随时间失去光泽。镅的密度为12 g/cm3,这比锔(13.52 g/cm3)和钚(19.8 g/cm3)的都低,但比铕(5.264 g/cm3)高,这主要是因为镅的原子量更高。镅质软易塑,其体积模量大大低于之前的锕系元素:Th、Pa、U、Np和Pu。[14]镅的熔点为1173 °C,这比钚(639 °C)和铕(826 °C)的明显要高,但比锔(1340 °C)要低。[15][15][16]
在环境条件下,镅主要以最稳定的α型存在,具有六方晶系对称结构,空间群为P63/mmc,晶格参数为a = 346.8 pm及c = 1124 pm,每晶胞有四个原子。镅晶体为六方密排结构,层序为ABAC,因此与α锔等锕系元素及α镧同型。[17][16]镅的晶体结构会随压力和温度改变。在常温下加压至5 GPa时,α镅会转化为β型,具有面心立方对称结构,空间群为Fm3m,晶格常数为a = 489 pm。这种结构是一种层序为ABC的密排结构。[17][16]再加压到23 GPa以上后,镅会转变成γ型斜方晶系结构,与α铀同型。一直到52 GPa镅都不再进行转变,但在10至15 GPa的压力下会显现出单斜晶系相态。[14]文献对这一相态的描述并不一致。三种主要相态α、β和γ也有时写作I、II和III。β型转变成γ型时,晶体体积下降6%。虽然理论预测α型转变成β型时也会有体积大幅度下降,但实验并没有观察到这一点。α到β型转变的压力随温度的提升而降低。当α镅在标准压力下加温到770 °C时,它会变为与β镅不同的一种面心立方相态,并在1075 °C时变为体心立方结构。因此镅的压温相图和镧、镨及钕的相似。[18]
与别的锕系元素一样,由于α粒子辐射,镅的晶体也会有自我破坏的现象。这种现象在低温下特别显著,因为间隙缺陷的可动性较低。这会造成x射线衍射图样的光亮区域间距离的增大。这使得温度与镅的某些属性之间没有明确的关系。[19]例如,镅-241在4.2 K下的电阻率会在40小时内从2 µOhm·cm增加到10 µOhm·cm,并在140小时后达到最高值16 µOhm·cm。这一效应在室温下较不明显。在刚制成时,镅的电阻率随温度变化,从液氦中的2 µOhm·cm到室温下的69 µOhm·cm。这和镎、铀、钍和镤的属性相似,但与钚和锔不同。后两种元素的电阻率会随温度急剧上升,并在60 K就达到最高值。室温下镅的电阻率比镎、钚和锔的低,但比铀、钍和镤的高。[1]
镅从液氦温度到室温以上都呈顺磁性。这与镅旁边的锔极为不同:后者在52 K时会转变为反铁磁性。[20]镅的热膨胀系数具各向异性,沿较短的a轴为(7.5 ± 0.2)×10-6/°C,沿六方结构中较长的c轴则是(6.2 ± 0.4)×10-6/°C。[16]镅金属在氢氯酸中的溶解焓为−620.6 ± 1.3 kJ/mol,而水溶Am3+离子的标准生成焓(ΔfH°)是−621.2 ± 2.0 kJ/mol−1。Am3+/Am0的标准电极电势是2.08 ± 0.01 V。[21]

镅会轻易地和氧反应,也易溶于酸当中。镅最常见的氧化态是+3,[22]而三价镅化合物不容易进行氧化还原反应。这种化学特性和大部分镧系元素相似。三价镅能形成不可溶的氟化物、草酸盐、碘酸盐、氢氧化物、磷酸盐以及其他的盐。[22]另外镅还有从+2到+7的其他氧化态,这是锕系元素中最广的。镅在水溶液中的颜色如下:Am3+从无色至呈黄、红色,Am4+呈黄、红色,AmVO+2呈黄色,AmVIO2+2呈棕色,AmVIIO5−6呈深绿色。[23][24]每个氧化态都有它的特征吸收光谱,光谱在可见光及中红外线区域有尖峰。根据这些尖峰的强度,可推算出相应氧化态的浓度。[25][26][27]例如Am(III)的光谱峰值在504和811 nm,Am(V)的在514和715 nm,Am(VI)的在666和992 nm。[28]
四价或以上的镅化合物都是强氧化剂,强度与酸性溶液中的高锰酸盐离子(MnO−4)相当。[29]四价镅离子在溶液中不稳定,会迅速转变为三价镅;在固体中,镅的+4态则很稳定,如二氧化镅(AmO2)及四氟化镅(AmF4)。
所有五价和六价镅化合物都是络合盐,如KAmO2F2、Li3AmO4、Li6AmO6、Ba3AmO6和AmO2F2。这些高氧化态(Am(IV)、Am(V)和Am(VI))的可通过氧化Am(III)离子制成,过程可以在稀硝酸中用过硫酸铵,[30]在高氯酸中用氧化银,[28]或在碳酸钠溶液中用臭氧或过硫酸钠。[27]科学家于1951年首次观察到镅的+5氧化态。[31]这种价态在溶液中以AmO+2离子(酸性)或AmO−3离子(碱性)的形式存在,但这是不稳定的,并且会进行快速歧化反应:[32][33][34]
氧化物
镅已知的氧化物有三种,分别为AmO(二价)、Am2O3(三价)和AmO2(四价)。一氧化镅只以微量制备,尚未详细表征。[35]三氧化二镅是一种棕红色固体,熔点为2205 °C。[36]镅的几乎所有应用用的都是二氧化镅固体。与多数其他锕系二氧化物相同,二氧化镅也是一种黑色固体,具立方晶体结构(氟石)。[37]
三价镅的草酸盐在室温下真空抽干后,化学式为Am2(C2O4)3·7H2O。在真空中加热到240 °C后,当中的水会脱离,化合物会在300 °C时分解成AmO2,分解过程大约在470 °C时完成。[22]这种草酸盐溶于硝酸当中,最大溶解度为0.25 g/L。[38]
卤化物
镅卤化物的氧化态有+2、+3和+4,[39]其中+3态最为稳定,特别在溶液中。[40]
| 氧化态 | F | Cl | Br | I |
|---|---|---|---|---|
| +4 | 四氟化镅 AmF4 浅粉红色 |
|||
| +3 | 三氟化镅 AmF3 粉红色 |
三氯化镅 AmCl3 粉红色 |
三溴化镅 AmBr3 浅黄色 |
三碘化镅 AmI3 浅黄色 |
| +2 | 二氯化镅 AmCl2 黑色 |
二溴化镅 AmBr2 黑色 |
二碘化镅 AmI2 黑色 |
三价镅可用钠汞齐还原为二价镅盐,形成黑色的卤化物:AmCl2、AmBr2和AmI2。这些盐很容易和氧反应,并会在水中氧化,释放氢气并变回三价镅。二氯化镅的晶体结构属于正交晶系,晶格常数为:a = 896.3 ± 0.8 pm,b = 757.3 ± 0.8 pm和c = 453.2 ± 0.6 pm。二溴化镅的晶体结构属于四方晶系,晶格常数为:a = 1159.2 ± 0.4和c = 712.1 ± 0.3 pm。[41]镅金属和相应的卤化汞(HgX2,X可以是Cl、Br或I)也可以形成这些化合物:[42]
三氟化镅(AmF3)不易溶,在弱酸溶液中Am3+和氟离子反应后会沉淀出来:
固态三氟化镅在与氟气反应后,会形成四氟化镅(AmF4):[43][44]
另一种四价的氟化镅固体是KAmF5。[43][45]镅在水溶状态时也会呈四价氧化态。要产生以上的氟化镅,须将黑色的Am(OH)4溶于15 M浓度的NH4F中,直到镅的浓度达到0.01 M为止。所得红色溶液的特征吸收光谱和AmF4相似,但不同于镅的其他氧化态。当加热至90 °C时,四价镅溶液并没有发生岐化或还原反应,但的α粒子辐射使其自身逐渐还原为三价镅。[26]
大部分三价卤化镅都会形成六方晶体,其颜色及卤素原子间结构则各异。三氯化镅(AmCl3)是红色的,结构与三氯化铀同型(空间群为P63/m),熔点为715 °C。[39]三氟化镅与LaF3同型(空间群为P63/mmc),三碘化镅则与BiI3同型(空间群为R3)。三溴化镅却例外,结构与正交晶体PuBr3同型,空间群为Cmcm。[40]把二氧化镅溶于氢氯酸后进行蒸发,可形成镅的六水合物晶体(AmCl3·6H2O)。这些晶体具吸湿性,外表呈黄、红色,结构属于单斜晶系。[46]
把相应的卤化镅与氧或Sb2O3反应后,可制成镅的卤氧化物AmVIO2X2、AmVO2X、AmIVOX2和AmIIIOX,其中X表示卤素。通过气态水解过程则能够产生AmOCl:[42]
氧族及氮族元素化合物
镅的已知氧族元素化合物包括镅的硫化物AmS2、[47]硒化物AmSe2和Am3Se4[47][48]以及碲化物Am2Te3和AmTe2。[49]镅(243Am)能够和氮族元素磷、砷、[50]锑及铋形成化学式为AmX的化合物。这些化合物都是立方晶系的。[48]
硅化物及硼化物
单硅化镅(AmSi)及“二硅化镅”(实际上是AmSix,其中1.87 < x < 2.0)可通过在真空中使用单质硅还原三氟化镅形成,前者温度要在1050 °C,后者则须在1150至1200 °C。AmSi是一种黑色固体,与LaSi同构,具正交晶体结构。AmSix外表具亮银色光泽,晶体结构属于四方晶系(空间群为I41/amd),与PuSi2和ThSi2同构。[51]镅的硼化物包括AmB4和AmB6。在真空或惰性大气里将镅的某种氧化物或卤化物与二硼化镁一同加热,能够形成四硼化镅。[52][53]
有机化合物
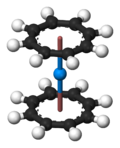
镅能够与两个环辛四烯配位体形成类似于双(环辛四烯)合铀的金属有机配合物(η8-C8H8)2Am。[54]镅也会和三个环戊二烯形成三角形的(η5-C5H5)3Am配合物。[55]
延伸X光吸收细微结构(EXAFS)已证实,在含有n-C3H7-BTP和Am3+离子的溶液中,存在Am(n-C3H7-BTP)3型的配合物,其中BTP指2,6-二(1,2,4-三嗪-3-基)吡啶。某些BTP型配合物只和镅相互作用,因此在提取镅的过程中相当有用。[56]
镅共有19种同位素和8种同核异构体,全部都具有放射性。其中两种为释放α粒子的长半衰期同位素241Am和243Am,半衰期分别为432.2和7370年;另有一种同核异构体242m1Am,半衰期为141年。其余的同位素和同核异构体半衰期从0.64微秒(245m1Am)到50.8小时(240Am)不等。与多数锕系元素一样,拥有奇数中子数的镅同位素具有较高的核裂变率,临界质量也较低。[12]
镅-241衰变成237Np时会释放5种不同能量的α粒子,但以5.486 MeV(85.2%)和5.443 MeV(12.8%)能量的为主。因为产生的许多都是亚稳态,所以衰变过程也会释放伽玛射线,能量值不连续,介乎26.3和158.5 keV之间,显著波峰出现在59.5keV。[57]
镅-242是一种短半衰期的同位素,半衰期为16.02小时。[12]它主要经β衰变(82.7%)成为242Cm,但也会经电子捕获(17.3%)衰变为242Pu。242Cm和242Pu以几乎相同的衰变链经过238Pu,到234U为止。
几乎所有的(99.541%)242m1Am都已内部转换成为242Am,而剩余的0.459%则以α衰变成为238Np。后者再分解为238Pu,最后形成234U。[12]
镅-243经α衰变成为239Np,再经β衰变变为239Pu。239Pu释放一颗α粒子,变为235U。
裂变
同位素242m1Am(半衰期为141年)的热中子吸收截面最高(5,700靶恩)[58],因此维持核链反应所需的临界质量很低。裸露的242m1Am球体临界质量大约为9至14公斤(不确定性是由于缺乏有关其物质特性的数据)。加上金属反射体后,临界质量可降至3至5公斤,如果使用水反射体则更低。[59]这样小的临界质量有助于制造可移动核武器,但由于242m1Am的稀少和昂贵,故未能实现。其余两个同位素241Am和243Am的临界质量则相对更高:前者为57.6至75.6公斤,后者为209公斤。[60]同样由于稀少和昂贵,所以镅未能用作核反应堆中的核燃料。[61]
有科学家提出一种十分紧密的10 kW功率高通量反应堆,它只须使用20克242m1Am。这种低功率反应堆可作较安全的中子源,供医院作放射性治疗。[62]

镅同位素中半衰期最长、最常见的同位素是241Am和243Am,其半衰期分别为432.2和7370年。相对地球的年龄来说,这是微不足道的,因此所有原始的镅元素,也就是在地球形成时可能存在的镅,至今都已全部衰变殆尽。
今天地球上的镅都集中在1945年至1980年曾进行大气层核试验的地点,以及发生过核事故的地点,如切尔诺贝尔核事故。美国第一颗氢弹“常春藤麦克”(1952年11月1日于埃内韦塔克环礁引爆)的辐射落尘中,就含有包括镅在内的多个锕系元素。由于属于军事机密,这项结果直到1956年才被公布。[63]1945年7月16日在新墨西哥州阿拉莫戈多附近进行的托立尼提核试使用的含钚原子弹爆炸后,在沙漠上留下了托立尼提物质,一种玻璃状的爆炸残留物,里面含有镅-241。1968年美国一架载有四颗氢弹的B-52轰炸机在格陵兰坠毁,意外地点同样探测到较高的镅含量。[64]
在其他地区,来自镅残留物的平均辐射量大约只有0.01皮居里每克(0.37 MBq/g)。大气层中的镅化合物较难溶于常见的溶剂中,但会黏附在泥土粒子上。分析表明,沙粒表面上的含镅量比其周围的水高出大约1,900倍;壤土中该比例则更高。[65]
镅一般是为了研究用途而少量人工生产的。每吨乏核燃料大约含有100克镅元素,主要包括241Am和243Am同位素。[66]这些同位素的半衰期较长,不适宜直接弃置,因此镅和其他长半衰期的锕系元素都要先经过中和过程:先把镅分离出来,再在反应堆中用中子撞击将它转变为短半衰期的核素。这一过程称为核嬗变。[67][68]
含铀量极高的矿藏中,重元素经中子捕获和β衰变之后,可能会自然产生痕量的镅,尽管这一点尚未得到证实。[69][70]从95号镅至100号镄的超铀元素曾在位于加蓬奥克洛的天然核反应堆中自然产生,但至今已不再形成了。[71]
核合成
几十年来,镅都是在核反应堆中少量生产的,至今241Am和243Am同位素已达到几公斤的产量。[72]不过,由于分离过程极为繁复,自从1962年出售以来,每克241Am的价格停留在1,500美元左右,并没有大幅变动。[73]较重的243Am同位素的单次产量则更少,分离过程也更为复杂,因此价格也更高,每毫克约售100至160美元。[74][75]
铀是反应堆中最常见的物质,但镅并不是从铀直接产生的,而是经过以下反应从钚同位素239Pu生成的。
239Pu在吸收两颗中子(亦即(n,γ)反应)和一次β衰变以后,产生241Am:
乏核燃料中存在的钚有12%是241Pu。由于该同位素会自发变为241Am,因此可以将它萃取出来,以生成更多的241Am。[73]但是这一过程需时甚久,原先的241Pu要在15年后才会有一半变为241Am,而且241Am的量在70年后,便不会再提升。[76]
产生出的241Am在反应堆中经过中子捕获,可用作制造更重的镅同位素。在轻水反应堆(LWR)当中,79%的241Am转变为242Am,10%转变为同核异构体242mAm:[note 1][77]
镅-242的半衰期只有大约16小时,因此进一步向上转化为243Am的过程效率很低。后者通常是在高中子通量下使239Pu捕获4颗中子形成的:
镅金属的生成
大多数生成方式都会产生多种锕系元素的氧化物,镅要从这一混合物中分离出来。一般的过程将乏核燃料(混合氧化物核燃料)溶解在硝酸中,其中的钚和铀通过钚铀萃取法(PUREX)在一种烃中用磷酸三丁酯先提取出来。水溶残液中剩余的镧系和锕系元素再用酰胺萃取出来,在剥离后形成多个三价镧系、锕系元素的混合物。镅化合物的提取则用到层析法和离心分离法,[78]并需使用合适的试剂。科学家在镅的溶剂提取技术方面已经进行了许多的研究。例如,一项名为EUROPART的欧洲计划研究了包括三嗪在内的多个化合物是否适合作为萃取剂。[79][80][81][82][83]有研究提出双三嗪基吡啶(BTBP)能选择性地提取镅(和锔)。[84]要将镅和特性很接近的锔分离开来,可把两者的氢氧化物的浆状混合物置于水溶碳酸氢钠中,在高温下注入臭氧。在溶液中,镅和锔都主要呈+3氧化态,但在这一反应下,锔不会改变,而镅则会氧化成为可溶的四价镅配合物,可以轻易洗去。[85]
镅化合物在还原后会形成镅金属。最早用来产生镅金属的化合物是三氟化镅。这一反应使用单质钡元素作为还原剂,并在去水、去氧的环境下用钽和钨造的器材进行。[13][17][86]
另一种方法则用镧或钍金属还原二氧化镅:[86][15]



电离烟雾探测器
镅是唯一一种进入日常应用的人造元素及超铀元素。一种常见的烟雾探测器使用二氧化镅(241Am)作为电离辐射源。[87]这种同位素比226Ra优胜,因为它能释放5倍多的α粒子,却释放很少的有害γ辐射。一个新的烟雾探测器一般装有1微居里(37 kBq)的镅,亦即0.28微克。这一量随着镅衰变为镎-237而逐渐减少,而镎-237是一种半衰期很长的超铀元素(约214万年半衰期)。探测器内的镅半衰期为432.2年,因此在19年后就含有3%的镎,32年后则有5%。衰变产生的辐射通过电离室,也就是两片电极间充满空气的区间,电极间有着少量的电流。烟雾进入电离室后会吸收辐射出来的α粒子,减少电离的程度,因此改变流通的电流,从而触发警报。相比光学烟雾探测器,电离探测器较为便宜,还能够测得大小不足以产生足够光学散射的烟雾粒子。然而,这种探测器容易发生误报。[88][89][90][91]
放射性核素
由于241Am的半衰期比238Pu的高很多(432.2年相比87年),因此有人提出用它作为放射性同位素热电机里的主要元素,可用于太空船上。[92]但镅产生较少的热量及电力:241Am的功率为114.7 mW/g,243Am 的功率为6.31 mW/g。[1] (cf. 390 mW/g for 238Pu)[92]镅的中子辐射还会对人类造成更大的伤害。欧洲空间局有计划在其太空探测器中使用镅元素。[93]
其他的太空应用还包括,在使用核推进器的飞船中以镅作为燃料。这种推进器利用了242mAm的高核裂变率,一片一微米厚的薄片就能达到这一效果。使用薄片可以避免自我吸收辐射,而如果用铀或钚燃料柱的话,只有其表面能够释放可用的α粒子。[94][95]242mAm的裂变产物可以用来直接推进太空船,或用以加热推进气体。产物的能量传导到液体后,还能够进行磁流体发电。[96]
同位素242mAm的高核裂变率还能够用来制造核电池。这种电池的设计并不用到镅所释放的α粒子能量,而是用了这些粒子的电荷,也就是把镅当作持续的正电极。一个含3.2公斤242mAm的电池可持续80天提供约140 kW的电力。[97]虽然潜在的应用范围很广,但是目前镅的产量稀少,价格昂贵,实际实施因此遭到了限制。[96]
中子源
241Am的氧化物和铍一起挤压,可制成高效的中子源。镅产生α粒子,铍再大量产生中子,因为铍元素对 (α,n)核反应具有较高的截面:
这种241AmBe中子源被广泛地应用在中子水分仪中,可探测土壤中的含水量及在建筑高速公路时作湿度、密度的质量管制。 这种中子源的用途还包括测井、中子摄影术、断层摄影术及其他放射化学探测术。[98]
制造其他元素
镅被用于合成其他超铀元素。比如,82.7%的242Am会衰变成242Cm,而其余的17.3%则衰变为242Pu。在核反应堆中,242Am吸收中子后可向上变为243Am和244Am,经β衰变后产生244Cm:
利用12C或22Ne离子对241Am进行辐射,可分别产生同位素247Es(锿)或260Db(𬭊)。[98]1949年,同一组团队使用同一台1.5米直径回旋加速器,在合成镅元素后对241Am进行中子撞击,首次专门合成并辨认了锫元素(243Bk同位素)。1965年,俄罗斯杜布纳联合核研究所用15N离子撞击243Am,产生了锘元素。另外,伯克利和杜布纳科学家合作进行的实验中,用18O撞击243Am,合成了铹元素。[7]
光谱仪
不少医学及工业用途都需要镅-241作为可移动的伽马射线及α粒子射源。241Am所射出的60 keV伽玛射线可用于材料分析摄影术、X射线荧光光谱学以及核密度计等。例如,镅就被用作测量玻璃的厚度,从而制造平滑的玻璃。[72]镅-241还可以用来在低能范围校准光谱仪,因为该同位素的光谱只有一个谱峰,其康普顿连续谱也是可忽略的(光度低至少三个数量级)。[99]镅-241的伽马射线更被用于诊断甲状腺功能,但这一医学应用已经不再被使用了。
所有比钨重的元素在生物体中不存在自然生理功能,身为人造放射性元素的镅亦然。[100][101]有科学家提出利用细菌从河溪中移除镅以及其他的重金属。柠檬酸杆菌属肠杆菌科能够从水溶液中把镅离子沉淀出来,在其细胞壁上形成一种金属磷酸盐配合物。[102]多项研究发现,镅会吸附及累积在细菌[103][104]和古菌当中。[105]
镅的放射性很高,所以镅金属和镅化合物都只能在特殊的实验室中用特别的设备处理。虽然大部分镅的同位素都只释放α粒子,使用很薄的普通材质就能隔除,但是这些同位素的衰变产物却会产生伽马射线和中子,它们的穿透性就强得多了。[106]
一旦进食,镅会在几天内排出体外,只有0.05%会进入血液。血液中的镅有45%进入肝脏,45%进入骨骼,剩下的10%则排出体外。肝脏对镅的吸收因人而异,并岁年龄的增大而加强。在骨骼里的镅首先沉积于皮层和小梁表面,并逐渐分散到整个骨骼。同位素241Am在骨骼里的生物半衰期为50年,在肝脏中则是20年,但会永久停留在性腺(睾丸或卵巢)当中。所有在体内的镅都会因放射性而致癌。[65][107][108]
弃置的烟雾探测器会连同里面的镅进入垃圾堆填区。大多数地区有关弃置镅元素的规定都较为宽松。在美国,一位童军曾收集多个烟雾探测器当中的镅,并试图建造增殖核反应堆。[109][110][111][112]历史上曾发生过多次人类受镅污染的事件,其中最严重的发生在一位64岁研究人员身上。他的实验室发生了爆炸,使他暴露在比标准高500倍的镅-241辐射量当中。他75岁去世,但并非由于辐射致病,而是死于事发前已诊断出的心血管疾病。[113][114]
- ^ 亚稳态以质量数后的“m”表示。
- ^ 1.0 1.1 1.2 Muller, W.; Schenkel, R.; Schmidt, H. E.; Spirlet, J. C.; McElroy, D. L.; Hall, R. O. A.; Mortimer, M. J. The electrical resistivity and specific heat of americium metal. Journal of Low Temperature Physics. 1978, 30 (5–6): 561. Bibcode:1978JLTP...30..561M. doi:10.1007/BF00116197.
- ^ Seaborg, Glenn T. The Transuranium Elements. Science. 1946, 104 (2704): 379–386. Bibcode:1946Sci...104..379S. JSTOR 1675046. PMID 17842184. doi:10.1126/science.104.2704.379.
- ^ LBL NEWS Magazine, Vol.6, No.3, Fall 1981, p. 49
- ^ Obituary of Dr. Leon Owen (Tom) Morgan (1919–2002), Retrieved 28 November 2010
- ^ Seaborg, G. T.; James, R.A. and Morgan, L. O.: "The New Element Americium (Atomic Number 95)", THIN PPR (National Nuclear Energy Series, Plutonium Project Record), Vol 14 B The Transuranium Elements: Research Papers, Paper No. 22.1, McGraw-Hill Book Co., Inc., New York, 1949. Abstract; Full text (January 1948), Retrieved 28 November 2010
- ^ Street, K.; Ghiorso, A.; Seaborg, G. The Isotopes of Americium. Physical Review. 1950, 79 (3): 530 [2013-05-23]. Bibcode:1950PhRv...79..530S. doi:10.1103/PhysRev.79.530. (原始内容存档于2019-07-10).
- ^ 7.0 7.1 Greenwood, p. 1252
- ^ 8.0 8.1 Pepling, Rachel Sheremeta. Chemical & Engineering News: It's Elemental: The Periodic Table – Americium. 2003 [7 July 2010]. (原始内容存档于2007-12-27).
- ^ Robert E. Krebs. The History and Use of Our Earth's Chemical Elements: A Reference Guide, Second Edition. Greenwood Publishing Group. 2006: 322. ISBN 978-0-313-33438-2.
- ^ Harper, Douglas. pandemonium. Online Etymology Dictionary.
- ^ Harper, Douglas. delirium. Online Etymology Dictionary.
- ^ 12.0 12.1 12.2 12.3 12.4 Audi, G; Bersillon, O.; Blachot, J.; Wapstra, A.H. The N? evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 1997, 624: 1. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. (原始内容 (PDF)存档于2008-09-23).
- ^ 13.0 13.1 Westrum, Edgar F.; Eyring, Leroy. Journal of the American Chemical Society. 1951, 73 (7): 3396. doi:10.1021/ja01151a116. 缺少或
|title=为空 (帮助) - ^ 14.0 14.1 Benedict, U. Study of actinide metals and actinide compounds under high pressures. Journal of the Less Common Metals. 1984, 100: 153. doi:10.1016/0022-5088(84)90061-4.
- ^ 15.0 15.1 15.2 Wade, W; Wolf, T. Preparation and some properties of americium metal. Journal of Inorganic and Nuclear Chemistry. 1967, 29 (10): 2577. doi:10.1016/0022-1902(67)80183-0.
- ^ 16.0 16.1 16.2 16.3 McWhan, D.B.; Cunningham, B.B.; Wallmann, J.C. Crystal structure, thermal expansion and melting point of americium metal. Journal of Inorganic and Nuclear Chemistry. 1962, 24 (9): 1025. doi:10.1016/0022-1902(62)80246-2.
- ^ 17.0 17.1 17.2 Gmelin Handbook of Inorganic Chemistry, System No. 71, transuranics, Part B 1, pp. 57–67.
- ^ D. A. Young. Phase diagrams of the elements. University of California Press. 1991: 226. ISBN 978-0-520-91148-2.
- ^ Benedict, U; Dufour, C. Low temperature lattice expansion of americium dioxide. Physica B+C. 1980, 102: 303. Bibcode:1980PhyBC.102..303B. doi:10.1016/0378-4363(80)90178-3.
- ^ Kanellakopulos, B; Blaise, A.; Fournier, J.M.; Müller, W. The magnetic susceptibility of Americium and curium metal. Solid State Communications. 1975, 17 (6): 713. Bibcode:1975SSCom..17..713K. doi:10.1016/0038-1098(75)90392-0.
- ^ Mondal, J.U.; Raschella, D.L.; Haire, R.G.; Petereson, J.R. The enthalpy of solution of 243Am metal and the standard enthalpy of formation of Am3+(aq). Thermochimica Acta. 1987, 116: 235. doi:10.1016/0040-6031(87)88183-2.
- ^ 22.0 22.1 22.2 Penneman, p. 4
- ^ Americium (页面存档备份,存于互联网档案馆), Das Periodensystem der Elemente für den Schulgebrauch (The periodic table of elements for schools) chemie-master.de(德文), Retrieved 28 November 2010
- ^ Greenwood, p. 1265
- ^ Penneman, pp. 10–14
- ^ 26.0 26.1 Asprey, L. B.; Penneman, R. A. First Observation of Aqueous Tetravalent Americium1. Journal of the American Chemical Society. 1961, 83 (9): 2200. doi:10.1021/ja01470a040.
- ^ 27.0 27.1 Coleman, J. S.; Keenan, T. K.; Jones, L. H.; Carnall, W. T.; Penneman, R. A. Preparation and Properties of Americium(VI) in Aqueous Carbonate Solutions. Inorganic Chemistry. 1963, 2: 58. doi:10.1021/ic50005a017.
- ^ 28.0 28.1 Asprey, L. B.; Stephanou, S. E.; Penneman, R. A. Hexavalent Americium. Journal of the American Chemical Society. 1951, 73 (12): 5715. doi:10.1021/ja01156a065.
- ^ Holleman, p. 1956
- ^ Asprey, L. B.; Stephanou, S. E.; Penneman, R. A. Journal of the American Chemical Society. 1950, 72 (3): 1425. doi:10.1021/ja01159a528. 缺少或
|title=为空 (帮助) - ^ Werner, L. B.; Perlman, I. Journal of the American Chemical Society. 1951, 73: 495. doi:10.1021/ja01145a540. 缺少或
|title=为空 (帮助) - ^ Hall, G; Markin, T.L. The self-reduction of americium(V) and (VI) and the disproportionation of americium(V) in aqueous solution. Journal of Inorganic and Nuclear Chemistry. 1957, 4 (5–6): 296. doi:10.1016/0022-1902(57)80011-6.
- ^ Coleman, James S. The Kinetics of the Disproportionation of Americium(V). Inorganic Chemistry. 1963, 2: 53. doi:10.1021/ic50005a016.
- ^ Greenwood, p. 1275
- ^ Akimoto, Y. A note on AmN and AmO. Journal of Inorganic and Nuclear Chemistry. 1967, 29 (10): 2650–2652. doi:10.1016/0022-1902(67)80191-X.
- ^ Holleman, p. 1972
- ^ Greenwood, p. 1267
- ^ Penneman, p. 5
- ^ 39.0 39.1 Holleman, p. 1969
- ^ 40.0 40.1 Asprey, L. B.; Keenan, T. K.; Kruse, F. H. Crystal Structures of the Trifluorides, Trichlorides, Tribromides, and Triiodides of Americium and Curium. Inorganic Chemistry. 1965, 4 (7): 985. doi:10.1021/ic50029a013.
- ^ Baybarz, R.D. The preparation and crystal structures of americium dichloride and dibromide. Journal of Inorganic and Nuclear Chemistry. 1973, 35 (2): 483. doi:10.1016/0022-1902(73)80560-3.
- ^ 42.0 42.1 Greenwood, p. 1272
- ^ 43.0 43.1 Asprey, L. B. New Compounds of Quadrivalent Americium, AmF4, KAmF5. Journal of the American Chemical Society. 1954, 76 (7): 2019. doi:10.1021/ja01636a094.
- ^ Greenwood, p. 1271
- ^ Penneman, p. 6
- ^ Burns, John H.; Peterson, Joseph Richard. Crystal structures of americium trichloride hexahydrate and berkelium trichloride hexahydrate. Inorganic Chemistry. 1971, 10: 147. doi:10.1021/ic50095a029.
- ^ 47.0 47.1 Damien, D; Jove, J. Americium disulfide and diselenide. Inorganic and Nuclear Chemistry Letters. 1971, 7 (7): 685. doi:10.1016/0020-1650(71)80055-7.
- ^ 48.0 48.1 Roddy, J. Americium metallides: AmAs, AmSb, AmBi, Am3Se4, and AmSe2. Journal of Inorganic and Nuclear Chemistry. 1974, 36 (11): 2531. doi:10.1016/0022-1902(74)80466-5.
- ^ Damien, D. Americium tritelluride and ditelluride. Inorganic and Nuclear Chemistry Letters. 1972, 8 (5): 501. doi:10.1016/0020-1650(72)80262-9.
- ^ Charvillat, J; Damien, D. Americium monoarsenide. Inorganic and Nuclear Chemistry Letters. 1973, 9 (5): 559. doi:10.1016/0020-1650(73)80191-6.
- ^ Weigel, F; Wittmann, F; Marquart, R. Americium monosilicide and "disilicide". Journal of the Less Common Metals. 1977, 56: 47. doi:10.1016/0022-5088(77)90217-X.
- ^ Lupinetti, A. J. et al. 美国专利第6,830,738号 "Low-temperature synthesis of actinide tetraborides by solid-state metathesis reactions", Filed 4 Apr 2002, Issued 14 Dec 2004
- ^ Eick, Harry A.; Mulford, R.N.R. Americium and neptunium borides. Journal of Inorganic and Nuclear Chemistry. 1969, 31 (2): 371. doi:10.1016/0022-1902(69)80480-X.
- ^ Elschenbroich, Christoph. Organometallchemie. Vieweg+teubner Verlag. 2008: 589. ISBN 978-3-8351-0167-8.
- ^ Thomas E. Albrecht-Schmitt. Organometallic and Coordination Chemistry of the Actinides. Springer. 2008: 8. ISBN 978-3-540-77836-3.
- ^ Girnt, Denise; Roesky, Peter W.; Geist, Andreas; Ruff, Christian M.; Panak, Petra J.; Denecke, Melissa A. 6-(3,5-Dimethyl-1H-pyrazol-1-yl)-2,2′-bipyridine as Ligand for Actinide(III)/Lanthanide(III) Separation. Inorganic Chemistry. 2010, 49 (20): 9627–35. PMID 20849125. doi:10.1021/ic101309j.
- ^ Christian Klinck. α-decay of 241Am. Theory – A lecture course on radioactivity. University of Technology Kaiserslautern. [28 November 2010]. (原始内容存档于2011年7月6日).
- ^ Pfennig, G.; Klewe-Nebenius, H and Seelmann Eggebert, W. (Eds.): Karlsruhe nuclide, 7 Edition 2006.
- ^ Dias, H.; Tancock, N. and Clayton, A. Critical Mass Calculations for 241Am, 242mAm and 243Am (PDF). Nippon Genshiryoku Kenkyujo JAERI. 2003: 618–623. (原始内容 (PDF)存档于2011-07-22). Abstract 互联网档案馆的存档,存档日期2012-03-13.
- ^ Institut de Radioprotection et de Sûreté Nucléaire, "Evaluation of nuclear criticality safety data and limits for actinides in transport" (页面存档备份,存于互联网档案馆), p. 16.
- ^ Ronen, Y.; Aboudy, M. and Regev, D. A novel method for energy production using 242mAm as a nuclear fuel. Nuclear technology. 2000, 129 (3): 407–417 [2013-05-23]. (原始内容存档于2011-09-08).
- ^ Ronen, Y.; Aboudy, M. and Regev, D. Homogeneous 242mAm-Fueled Reactor for Neutron Capture Therapy. Nuclear Science and Engineering. 2001, 138 (3): 295–304. OSTI 20804726.
- ^ Fields, P. R.; Studier, M. H.; Diamond, H.; et al. Transplutonium Elements in Thermonuclear Test Debris. Physical Review. 1956, 102 (1): 180–182. Bibcode:1956PhRv..102..180F. doi:10.1103/PhysRev.102.180.
- ^ Eriksson, Mats. On Weapons Plutonium in the Arctic Environment (PDF). Risø National Laboratory, Roskilde, Denmark: Lund University. April 2002: 28 [15 November 2008]. (原始内容 (PDF)存档于2008-12-18).
- ^ 65.0 65.1 Human Health Fact Sheet on Americium 互联网档案馆的存档,存档日期2011-07-16., Los Alamos National Laboratory, Retrieved 28 November 2010
- ^ Hoffmann, Klaus Kann man Gold machen? Gauner, Gaukler und Gelehrte. Aus der Geschichte der chemischen Elemente, Urania-Verlag, Leipzig, Jena, Berlin 1979, no ISBN, p. 233
- ^ Baetslé, L. Application of Partitioning/Transmutation of Radioactive Materials in Radioactive Waste Management 互联网档案馆的存档,存档日期2005-04-26., Nuclear Research Centre of Belgium Sck/Cen, Mol, Belgium, September 2001, Retrieved 28 November 2010
- ^ Fioni, Gabriele; Cribier, Michel and Marie, Frédéric Can the minor actinide, americium-241, be transmuted by thermal neutrons? 互联网档案馆的存档,存档日期2007-11-11., Department of Astrophysics, CEA/Saclay, Retrieved 28 November 2010
- ^ Earth, Rachel Ross 2017-05-23T02:31:00Z Planet. Facts About Americium. livescience.com. 23 May 2017 [2019-08-10] (英语).
- ^ Americium - Element information, properties and uses | Periodic Table. www.rsc.org. [2019-08-10].
- ^ Emsley, John. Nature's Building Blocks: An A-Z Guide to the Elements New. New York, NY: Oxford University Press. 2011. ISBN 978-0-19-960563-7.
- ^ 72.0 72.1 Greenwood, p. 1262
- ^ 73.0 73.1 Smoke detectors and americium 互联网档案馆的存档,存档日期2010-11-12., World Nuclear Association, January 2009, Retrieved 28 November 2010
- ^ Hammond C. R. "The elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ H. J. Emeleus; A. G. Sharpe. Advances in Inorganic Chemistry. Academic Press. 1987: 2. ISBN 978-0-08-057880-4.
- ^ BREDL Southern Anti-Plutonium Campaign (页面存档备份,存于互联网档案馆), Blue Ridge Environmental Defense League, Retrieved 28 November 2010
- ^ Sasahara, A.; et al. Neutron and Gamma Ray Source Evaluation of LWR High Burn-up UO2 and MOX Spent Fuels. Journal of Nuclear Science and Technology. 2004, 41 (4): 448–456 [2013-05-23]. doi:10.3327/jnst.41.448. (原始内容存档于2010-11-19). article/200410/000020041004A0333355.php Abstract 互联网档案馆的存档,存档日期2010-11-24.
- ^ Penneman, pp. 34–48
- ^ Hudson, M. J.; et al. The coordination chemistry of 1,2,4-triazinyl bipyridines with lanthanide(III) elements – implications for the partitioning of americium(III). Dalton Trans. 2003, (9): 1675–1685. doi:10.1039/b301178j.
- ^ Geist, A. ; et al. Actinide(III)/Lanthanide(III) Partitioning Using n-Pr-BTP as Extractant: Extraction Kinetics and Extraction Test in a Hollow Fiber Module (PDF). 6th Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. OECD Nuclear Energy Agency. 11–13 December 2000.[永久失效链接]
- ^ C. Hill, D. Guillaneux, X. Hérès, N. Boubals and L. Ramain. Sanex-BTP Process Development Studies (PDF). Atalante 2000: Scientific Research on the Back-end of the Fuel Cycle for the 21st Century. Commissariat à l'énergie atomique. 24–26 October 2000. (原始内容 (PDF)存档于2012-11-15).
- ^ Geist, A.; et al. Effective Actinide(III)-Lanthanide(III) Separation in Miniature Hollow Fibre Modules (PDF). 7th Information Exchange Meeting on Actinide and Fission Product Partitioning and Transmutation. OECD Nuclear Energy Agency. 14–16 October 2002.
- ^ D.D. Ensor. Separation Studies of f-Elements (PDF). Tennessee Tech University. (原始内容 (PDF)存档于2006-09-22).
- ^ Magnusson D, Christiansen B, Foreman MRS, Geist A, Glatz JP, Malmbeck R, Modolo G, Serrano-Purroy D and Sorel C. Demonstration of a SANEX Process in Centrifugal Contactors using the CyMe4-BTBP Molecule on a Genuine Fuel Solution. Solvent Extraction and Ion Exchange. 2009, 27 (2): 97. doi:10.1080/07366290802672204.
- ^ Penneman, p. 25
- ^ 86.0 86.1 Penneman, p. 3
- ^ Smoke Detectors and Americium, Nuclear Issues Briefing Paper 35, May 2002. (Internet Archive), Retrieved 28 November 2010
- ^ Residential Smoke Alarm Performance, Thomas Cleary, Building and Fire Research Laboratory, National Institute of Standards and Technology, UL Smoke and Fire Dynamics Seminar. November 2007.
- ^ Bukowski, R. W. et al. (2007) Performance of Home Smoke Alarms Analysis of the Response of Several Available Technologies in Residential Fire Settings (页面存档备份,存于互联网档案馆), NIST Technical Note 1455-1
- ^ Smoke detectors and americium-241 fact sheet (PDF). Canadian Nuclear Society. [31 August 2009]. (原始内容 (PDF)存档于2013-05-24).
- ^ Julie Louise Gerberding. Toxicological Profile For Americium (PDF; 2.1MiB). United States Department of Health and Human Services/Agency for Toxic Substances and Disease Registry. 2004-04 [29 August 2009]. (原始内容存档 (PDF)于2009-09-06).
- ^ 92.0 92.1 Basic elements of static RTGs (页面存档备份,存于互联网档案馆), G.L. Kulcinski, NEEP 602 Course Notes (Spring 2000), Nuclear Power in Space, University of Wisconsin Fusion Technology Institute (see last page)
- ^ Space agencies tackle waning plutonium stockpiles, Spaceflight now, 9 July 2010
- ^ Extremely Efficient Nuclear Fuel Could Take Man To Mars In Just Two Weeks. ScienceDaily. 3 January 2001 [22 November 2007]. (原始内容存档于2007-10-17).
- ^ Kammash, T.; et al. An americium-fueled gas core nuclear rocket. AIP Conf. Proc.. Tenth symposium on space nuclear power and propulsion 271: 585–589. 10 January 1993. doi:10.1063/1.43073.
- ^ 96.0 96.1 Ronen, Y; Shwageraus, E. Ultra-thin 242mAm fuel elements in nuclear reactors. Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment. 2000, 455 (2): 442. Bibcode:2000NIMPA.455..442R. doi:10.1016/S0168-9002(00)00506-4.
- ^ Genuth, Iddo Americium Power Source 互联网档案馆的存档,存档日期2010-05-07., The Future of Things, 3 October 2006, Retrieved 28 November 2010
- ^ 98.0 98.1 Harry H. Binder. Lexikon der chemischen Elemente: das Periodensystem in Fakten, Zahlen und Daten : mit 96 Abbildungen und vielen tabellarischen Zusammenstellungen. 1999. ISBN 978-3-7776-0736-8.
- ^ Nuclear Data Viewer 2.4 (页面存档备份,存于互联网档案馆), NNDC
- ^ Toeniskoetter, Steve; Dommer, Jennifer and Dodge, Tony The Biochemical Periodic Tables – Americium 互联网档案馆的存档,存档日期2011-11-04., University of Minnesota, Retrieved 28 November 2010
- ^ Dodge, C.J.; et al. Role of Microbes as Biocolloids in the Transport of Actinides from a Deep Underground Radioactive Waste Repository. Radiochim. Acta. 1998, 82: 347–354.
- ^ MacAskie, LE; Jeong, BC; Tolley, MR. Enzymically accelerated biomineralization of heavy metals: application to the removal of americium and plutonium from aqueous flows. FEMS Microbiology Reviews. 1994, 14 (4): 351–67. PMID 7917422. doi:10.1111/j.1574-6976.1994.tb00109.x.
- ^ Wurtz, EA; Sibley, TH; Schell, WR. Interactions of Escherichia coli and marine bacteria with 241Am in laboratory cultures. Health physics. 1986, 50 (1): 79–88. PMID 3511007. doi:10.1097/00004032-198601000-00007.
- ^ Francis, A.J.; et al. Role of Bacteria as Biocolloids in the Transport of Actinides from a Deep Underground Radioactive Waste Repository. Acta Radiochimica. 1998, 82: 347–354. OSTI 2439.
- ^ Liu, N; Yang, Y; Luo, S; Zhang, T; Jin, J; Liao, J; Hua, X. Biosorption of 241Am by Rhizopus arrihizus: preliminary investigation and evaluation. Applied radiation and isotopes : including data, instrumentation and methods for use in agriculture, industry and medicine. 2002, 57 (2): 139–43. PMID 12150270.
- ^ Public Health Statement for Americium Section 1.5., Agency for Toxic Substances and Disease Registry, April 2004, Retrieved 28 November 2010
- ^ Division of Environmental Health, Office of Radiation Protection. Fact Sheet # 23. Americium-241 (PDF). November 2002 [28 November 2010]. (原始内容 (PDF)存档于2010-11-11).
- ^ Frisch, Franz Crystal Clear, 100 x energy, Bibliographisches Institut AG, Mannheim 1977, ISBN 978-3-411-01704-1, p. 184
- ^ Ken Silverstein, The Radioactive Boy Scout: When a teenager attempts to build a breeder reactor. Harper's Magazine, November 1998
- ^ 'Radioactive Boy Scout' Charged in Smoke Detector Theft. Fox News. 4 August 2007 [28 November 2007]. (原始内容存档于2007-12-08).
- ^ Man dubbed 'Radioactive Boy Scout' pleads guilty. Detroit Free Press. Associated Press. 27 August 2007 [27 August 2007]. (原始内容存档于2007-09-29).
- ^ 'Radioactive Boy Scout' Sentenced to 90 Days for Stealing Smoke Detectors. Fox News. 4 October 2007 [28 November 2007]. (原始内容存档于2007-11-13).
- ^ Cary, Annette. Doctor remembers Hanford's 'Atomic Man'. Tri-City Herald. 25 April 2008 [17 June 2008]. (原始内容存档于2010-02-10).
- ^ AP wire. Hanford nuclear workers enter site of worst contamination accident. 3 June 2005 [17 June 2007]. (原始内容存档于2007-10-13).
- Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- Holleman, Arnold F. and Wiberg, Nils Textbook of Inorganic Chemistry, 102 Edition, de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Penneman, R. A. and Keenan T. K. The radiochemistry of americium and curium (页面存档备份,存于互联网档案馆), University of California, Los Alamos, California, 1960
- Nuclides and Isotopes – 14th Edition, GE Nuclear Energy, 1989.
- Fioni, Gabriele; Cribier, Michel and Marie, Frédéric. Can the minor actinide, americium-241, be transmuted by thermal neutrons?. Commissariat à l'énergie atomique. (原始内容存档于2007-11-11).
- Guide to the Elements – Revised Edition, Albert Stwertka, (Oxford University Press; 1998) ISBN 978-0-19-508083-4
| 维基共享资源中相关的多媒体资源:镅 |
| 查看维基词典中的词条“americium”。 |
- 元素镅在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 镅(英文)
- 元素镅在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素镅在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 镅(英文)
- Americium at The Periodic Table of Videos(诺丁汉大学)
- ATSDR – Public Health Statement: Americium
- World Nuclear Association – Smoke Detectors and Americium

