𬭛(拼音:bō,注音:ㄆㄛ,粤拼:bo1;英语:Bohrium)是一种人工合成的化学元素,其化学符号为Bh,原子序数为107。以丹麦物理学家尼尔斯·玻尔命名。𬭛是一种放射性极强的超重元素及锕系后元素,其所有同位素的半衰期都很短,非常不稳定,其中寿命最长的是270Bh,半衰期仅约61秒。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 名称·符号·序数 | 𬭛(Bohrium)·Bh·107 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 7 ·7·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | [270] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Rn] 5f14 6d5 7s2 (计算值)[1][2] 2, 8, 18, 32, 32, 13, 2 (预测) 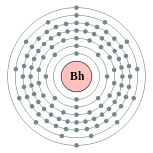 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 重离子研究所(1981年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态(预测) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 37(预测)[2] g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 蒸气压 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 7, 5, 4, 3(预测)[2] (实验证实的氧化态以粗体显示) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:742.9(估值)[2] kJ·mol−1 第二:1688.5(估值)[2] kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 128(估值)[2] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 141(估值)[3] pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 54037-14-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:𬭛的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在元素周期表中,𬭛是位于d区块的过渡金属,为第7周期、第7族的成员。人们对𬭛的化学属性并不完全了解,就目前实验结果所知,𬭛符合7族中位于铼之下元素的特性。
| 外部视频链接 | |
|---|---|
超重元素[a]的原子核是在两个不同大小的原子核[b]的聚变中产生的。粗略地说,两个原子核的质量之差越大,两者发生反应的可能性就越大。[12]由较重原子核组成的物质会作为靶子,被较轻原子核的粒子束轰击。两个原子核只能在距离足够近的时候,才能聚变成一个原子核。原子核(全部都有正电荷)会因为静电排斥而相互排斥,所以只有两个原子核的距离足够短时,强核力才能克服这个排斥力并发生聚变。粒子束因此被粒子加速器大大加速,以使这种排斥力与粒子束的速度相比变得微不足道。[13]不过,只是靠得足够近不足以使两个原子核聚变:当两个原子核逼近彼此时,它们通常会在一起约10−20秒后裂变(产物不需要和反应物相同),而非形成单独的原子核。[13][14]如果聚变发生了,两个原子核产生的一个原子核会处于激发态[15],被称为复合原子核,非常不稳定。[13]为了达到更稳定的状态,这个暂时存在的原子核可能会直接核裂变,[16]或是放出一些带走激发能量的中子。如果这些激发能量不足以使中子被放出,复合原子核就会放出γ射线。这个过程会在原子核碰撞后的10−16秒发生,并创造出更稳定的原子核。[16]联合工作团队(JWP)定义,化学元素的原子核只有10−14秒内不进行放射性衰变,才能被识别出来,这个值大约是原子核得到它的外层电子,显示其化学性质所需的时间。[17][c]
粒子束穿过目标后,会到达下一个腔室——分离室。如果反应产生了新的原子核,它就会被这个粒子束携带。[19]在分离室中,新产生的原子核会从其它核素(原本的粒子束和其它反应产物)中分离,[d]并转移到半导体探测器中,在这里停止原子核。这时标记撞击探测器的确切位置、能量和到达时间。[19]这个转移需要10−6秒的时间,意即这个原子核需要存活这么长的时间才能被检测到。[22]衰变被记录后,这个原子核被再次记录,并测量位置、衰变能量和衰变时间。[19]
原子核的稳定性源自于强核力,但强核力的作用距离很短,随着原子核越来越大,强核力对最外层的核子(质子和中子)的影响减弱。同时,原子核会被质子之间,范围不受限制的静电排斥力撕裂。[23]超重元素[24]的主要衰变方式——α衰变和自发裂变都是这种排斥引起的。[e]α衰变由发射出去的α粒子记录,在实际衰变之前很容易确定衰变产物。如果这样的衰变或一系列连续衰变产生了一个已知的原子核,则可以很容易地确定反应的原始产物。[f](衰变链中的所有衰变都必须在同一个地方发生。)[19] 已知的原子核可以通过它经历的衰变的特定特征来识别,例如衰变能量(或更具体地说,发射粒子的动能)。[g]然而,自发裂变会产生各种分裂产物,因此无法从其分裂产物确定原始核素。[h]
尝试合成超重元素的物理学家可以获得的信息是探测器收集到的信息:粒子到达探测器的位置、能量和时间,以及粒子衰变的信息。物理学家分析这些数据并试图得出结论,确认它确实是由新元素引起的,而非由不同的核素引起的。如果提供的数据不足以得出创造出来的核素确实是新元素的结论,并且对观察到的影响没有其他解释,就可能在解释数据时出现错误。[i]

正式发现
位于德国达姆施塔特重离子研究所,由彼得·安布鲁斯特和Gottfried Münzenberg为首的团队于1981年首次确定性地成功合成𬭛元素。它们将铬-54原子核加速撞击铋-209目标,并制造出5个𬭛-262同位素原子:[36]
IUPAC/IUPAP镄后元素工作小组在其1992年的报告当中将重离子研究所的团队列为𬭛的正式发现者。[37]
提出的命名
该德国团队建议将该元素命名为Nielsbohrium,符号为Ns,以纪念丹麦物理学家尼尔斯·波尔。前苏联杜布纳联合核研究所的科学家却曾经建议把第105号元素(现名为𬭊)命名为Nielsbohrium。德国的团队希望在纪念波尔的同时,肯定杜布纳团队作为首次提出该冷核聚变反应的一方,从而解决命名争议。杜布纳团队与德国团队就此对107号元素的命名达成了共识。[38]
在104至106号元素命名争议的同时,国际纯粹与应用化学联合会(IUPAC)使用Unnilseptium(符号为Uns)作为临时的系统化命名。[39]1994年,IUPAC的一个委员会建议将107号元素命名为Bohrium(现名),而非Nielsbohrium,因为此前并没有以某科学家的全名为元素取名的先例。[39][40]发现者对此表示反对,并担心这样的名称会和硼(Boron)混淆,特别是两者的含氧负离子的国际命名:Bohrate(𬭛酸盐)和Borate(硼酸盐)。这个问题交由IUPAC位于丹麦的分支处理,但最终的投票结果仍然决定使用Bohrium。鉴于国际上对104至107号元素名均存在较大分歧,1997年8月27日IUPAC在协商后正式对101至109号元素的重新英文定名,其中Bohrium一名成为了国际承认的107号元素的命名。IUPAC之后决定将𬭛酸盐改称Bohriates,而非Bohrates。[39]
全国科学技术名词化学名词审定委员会据此于1998年7月8日重新审定、公布101至109号元素的中文命名,其中首次给出107号元素中文名:“𬭛”(bō,音同“波”)[41],名称源自IUPAC决定的英文名Bohrium,以纪念丹麦物理学家尼尔斯·波尔。[42][43]
𬭛等超重元素的合成方法是将两种较轻的元素通过粒子加速器相互高速撞击,并以此产生核聚变反应。多数𬭛同位素都可以用这种方法合成,但某些较重的同位素则目前只在原子序更高的元素的衰变产物当中发现。[44]
根据所用能量的高低,核合成分为“热”和“冷”两类。在热核聚变反应中,低质量、高能的发射体朝着高质量目标(锕系元素)加速,产生处于高激发能的复核(约40至50 MeV),再裂变或蒸发出3至5颗中子。[45]在冷核聚变反应中,聚变所产生的复核有着低激发能(约10至20 MeV),因此这些产物的裂变可能性较低。复核冷却至基态时,会只射出1到2颗中子,因此产物的含中子量更高。[44]冷核聚变一词在此指的不是在室温下发生的核聚变反应(见冷核聚变)。[46]
冷核聚变
在1981年重离子研究所团队成功合成𬭛之前,杜布纳联合核研究所的科学家曾于1976年尝试进行冷核聚变合成𬭛。他们探测到两次自发裂变事件,半衰期分别为1至2毫秒和5秒。根据别的冷核聚变反应推断,两次裂变分别来自于261Bh和257Db。不过,之后的证据降低了261Bh的自发裂变支链,因此事件指定为𬭛的确定性也大大降低。指定为𬭊的裂变事件之后改为指向258Db,而2毫秒长的自发裂变事件则指定为258Rf的33%电子捕获支链。[37]重离子研究所团队在1981年研究了这条反应,并成功发现𬭛。利用衰变母子体关系法,他们探测到5个262Bh原子。[36]1987年,来自杜布纳的内部报告指出,其团队曾经直接探测到261Bh的自发裂变。重离子研究所团队又在1989年进一步研究这条反应,并在测量1n和2n激发函数时,发现了新同位素261Bh,但是并没有探测到261Bh的自发裂变支链。[47]2003年,他们利用新制造的三氟化铋(BiF3)目标继续进行研究,并取得更多有关262Bh及其衰变产物258Db的数据。2005年,由于质疑此前数据的准确性,位于劳伦斯伯克利国家实验室(LBNL)的团队重新测量了1n激发函数。他们观测到18个262Bh原子和3个261Bh原子,并证实了262Bh的两个同核异构体。[48]
2007年,LBNL的团队研究了类似的反应,首次使用铬-52发射体寻找最轻的𬭛同位素260Bh:
研究人员成功探测到8个260Bh原子,它们经过α衰变形成256Db,期间放射的α粒子能量为10.16 MeV。这种能量显示N=152的闭核持续有着稳定的作用。[49]
杜布纳的团队在1976年在一系列利用冷核聚变产生新元素的实验中,研究了铅-208目标和锰-55发射体之间的反应:
他们观测到与铋-209和铬-54之间反应相同的自发裂变事件,并同样指向261Bh和257Db。之后的证据表示事件应该改为指向258Db和258Rf(见上)。[37]1983年,他们重新进行实验,并用到新的方法:测量经化学分离出的衰变产物的α衰变。研究人员探测到来自衰变产物262Bh的α衰变,加强证实𬭛原子核的成功合成。[37]位于LBNL的团队之后详细研究这条反应,并在2005年探测到33次262Bh的衰变及2个261Bh原子。这确定了这条反应释放一颗中子的激发函数,以及提供了有关两种262Bh同核异构体的光谱数据。2006年重复进行这条反应时研究了释放两颗中子的激发函数。该团队发现,释放一颗中子的反应的截面比使用209Bi目标的相应反应较高,著与预期的相反。要得出其原因则需要进一步的研究。[50][51]
热核聚变
劳伦斯伯克利国家实验室首次于2006年研究了铀-238目标与磷-31发射体之间的反应。
实验结果还没有被发布,但初步结果似乎表明可能来自264Bh的自发裂变。[52]
位于中国兰州近代物理中心(IMP)研究了镅-243目标与镁-26发射体之间的反应,以合成新的同位素265Bh,以及搜集有关266Bh的更多数据:
研究人员进行了两组实验,并测量了释放3、4或5颗中子的部分激发函数。[53]
日本理化学研究所的团队首次于2008年研究了锔-248目标和钠-23之间的反应,以了解266Bh的衰变属性。该同位素是他们所声称的鿭衰变链中的产物:[54]
同位素266Bh进行α衰变,能量为9.05至9.23 MeV。这项结果在2010年得到进一步证实。[55]
首次利用热核聚变尝试合成𬭛的实验是在1979年由杜布纳的团队进行的。他们使用氖-22发射体和锫-249目标:
该反应在1983年得到重复,与首次一样,研究团队并没有探测到任何来自𬭛原子核的自发裂变。更近期的实验利用热核聚变合成高中子数的稳定的𬭛同位素,从而首次开始对𬭛进行化学研究。1999年,劳伦斯伯克利国家实验室的团队声称发现了长半衰期的267Bh(5个原子)和266Bh(1个原子)同位素。[56]两者之后都得到了证实。[57]位于瑞士伯尔尼的保罗谢尔研究所(PSI)其后在第一次实际研究𬭛的化学特性时,又合成了6个267Bh原子。[58]
作为衰变产物
| 蒸发残余 | 𬭛同位素 |
|---|---|
| 294Ts, 290Mc, 286Nh, 282Rg, 278Mt | 274Bh[59] |
| 288Mc, 284Nh, 280Rg, 276Mt | 272Bh[60][61] |
| 287Uup, 283Uut, 279Rg, 275Mt | 271Bh[60] |
| 282Uut, 278Rg, 274Mt | 270Bh[60] |
| 278Uut, 274Rg, 270Mt | 266Bh[61] |
| 272Rg, 268Mt | 264Bh[62] |
| 266Mt | 262Bh[63] |
𬭛也在更高原子序的元素衰变时作为产物被发现。鿏是其中一种这样的元素,它共有7个已知的同位素,全部都进行α衰变,形成𬭛原子核,质量数从262到274不等。鿏本身也可以是𬬭、鿭、镆或Ts的衰变产物。至今发现的元素当中,除以上的之外没有别的可以衰变成𬭛。[64]例如在2010年1月,杜布纳的研究团队通过Uus的α衰变链发现了𬭛-274:[59]
| 同位素 | 半衰期 [64][65] |
衰变形式[64][65] | 发现年份 | 所用反应 |
|---|---|---|---|---|
| 260Bh | 35 ms | α | 2007年 | 209Bi(52Cr,n)[49] |
| 261Bh | 11.8 ms | α | 1986年 | 209Bi(54Cr,2n)[47] |
| 262Bh | 84 ms | α | 1981年 | 209Bi(54Cr,n)[36] |
| 262mBh | 9.6 ms | α | 1981年 | 209Bi(54Cr,n)[36] |
| 263Bh | 0.2? ms | α ? | 未知 | — |
| 264Bh | 0.97 s | α | 1994年 | 272Rg(—,2α)[62] |
| 265Bh | 0.9 s | α | 2004年 | 243Am(26Mg,4n)[53] |
| 266Bh | 0.9 s | α | 2000年 | 249Bk(22Ne,5n)[56] |
| 267Bh | 17 s | α | 2000年 | 249Bk(22Ne,4n)[56] |
| 268Bh | 25? s | α, SF? | 未知 | — |
| 269Bh | 25? s | α ? | 未知 | — |
| 270Bh | 61 s | α | 2006年 | 282Nh(—,3α)[60] |
| 271Bh | 1.2 s | α | 2003年 | 287Mc(—,4α)[60] |
| 272Bh | 9.8 s | α | 2005年 | 288Mc(—,4α)[60] |
| 273Bh | 90? min | α, SF ? | 未知 | — |
| 274Bh | ~54 s | α | 2009年 | 294Ts(—,5α)[59] |
| 275Bh | 40? min | SF ? | 未知 | — |
如同其他高原子序的超重元素,𬭛的所有同位素都具有极高的放射性,寿命短暂,非常不稳定。𬭛的一些同位素已在实验室中成功合成,所用方法有两种:高速撞击两种原子核以产生核聚变,或制造出更高的元素并观测其衰变产物。目前正式发现了的𬭛同位素有11种,质量数分别为260–262、264–267、270–272、274,其中寿命最长的是𬭛-270,半衰期约61秒,而𬭛-262拥有已知的亚稳态。这些同位素都会经α衰变,然而某些仍未被发现的𬭛同位素理论上会进行自发裂变。[64]
稳定性与半衰期
较轻的𬭛同位素一般有较短的半衰期。260Bh、261Bh、262Bh、262mBh和263Bh的半衰期在100毫秒以下。同位素264Bh、265Bh、266Bh和271Bh较为稳定,半衰期在1秒左右,而267Bh和272Bh则有大约10秒的半衰期。质量最高的同位素最为稳定,其中270Bh和274Bh分别有大约61秒和54秒的半衰期。未知的273Bh和275Bh同位素预期将会有更长的半衰期,分别为90分钟和40分钟。值得注意的是,在被发现之前,理论预计的274Bh半衰期也长达90分钟左右,但最终实际只有54秒。[64]
高质子量的260Bh、261Bh和262Bh是直接由冷核聚变产生的,262mBh和264Bh则是在鿏和𬬭的衰变链中被发现的。高中子量的266Bh和267Bh是通过向锕系元素目标进行放射产生的。中子量最高的四个同位素270Bh 、271Bh 、272Bh 和274Bh分别是在282Nh、287Mc和288Mc和294Nh的衰变链中发现的。后七个同位素的半衰期在8毫秒至1分钟不等。[57]
同核异构体
𬭛的唯一一个确定的同核异构体出现在262Bh。直接和成262Bh会产生两种状态:基态和一个同核异能态。已证实,基态会经α衰变,放射的α粒子能量为10.08、9.82和9.76 MeV,半衰期为84毫秒。激发态也通过α衰变,放射的α粒子能量为10.37和10.24 MeV,半衰期为9.6毫秒。[36]
推算
𬭛预计是元素周期表中6d系过渡金属的第四个元素,也是7族元素中最重的一个,位于锰、锝和铼之下。该族的所有元素都拥有明显的+7氧化态,其稳定性随着质量的增加而提升。因此𬭛也预计会有稳定的+7态。锝同时也有稳定的+4态,而铼拥有稳定的+4和+3态。𬭛也有可能拥有这些较低的氧化态。
该族的重元素会形成具挥发性的七氧化物M2O7,所以𬭛应该会形成具挥发性的Bh2O7。这个氧化物应该会在水中溶解,形成高𬭛酸HBhO4。铼和锝在其氧化物的卤化反应后能够形成卤氧化物MO3Cl,所以BhO3Cl也可能会在这种反应中产生。该族较重元素的氧化物在氟化反应会产生MO3F和MO2F3,而铼则另外会形成ReOF5和ReF7。因此,𬭛也应会产生这些氟氧化物,从而证实它会延续7族元素的化学特性。
化学实验
1995年第一次尝试分离𬭛元素的实验以失败告终。[66]
尽管相对论效应颇为重要,不过107号元素仍然是个典型的7族元素,这在2000年得到证实。[67]
2000年,保罗谢尔研究所的团队利用267Bh原子进行了化学反应。这些𬭛原子是Bk-249和Ne-22离子的融合产物。这些原子在经过热能化后,与HCl/O2混合物反应,并形成一种具挥发性的氯氧化物。这条反应也同时产生了同族的较轻元素锝(同位素为108Tc)及铼(同位素为169Re)。测量出来的吸附等温线明确指出一种挥发性氯氧化物的产生,其特性和氯氧化铼相似。这证实𬭛是一个典型的7族元素。[58]
| 化学式 | 名称 |
|---|---|
| BhO3Cl | 氯氧化𬭛 |
- ^ 在核物理学中,如果一个元素有高原子序,就可以被称为重元素。82号元素铅就是重元素的例子。“超重元素”这一词通常指原子序大于103的元素(尽管也有其它的定义,例如原子序大于100[7]或112。[8]有时这一词和锕系后元素是同义词,将超重元素的上限定在还未发现的超锕系元素的开始。)[9](那个元素的)“超重同位素”和“超重核素”顾名思义——分别是(那个元素的)高质量同位素和高质量的核素。
- ^ 2009年,由尤里·奥加涅相引领的团队在JINR发表了他们通过对称的136Xe + 136Xe反应,尝试合成钅黑的结果。他们未能在这个反应中观察到单个原子,因此对截面设置了上限,即核反应概率的度量为2.5 pb。[10]作为比较,发现钅黑的反应208Pb + 58Fe的截面约为20 pb(进一步来说,为19+19-11 pb),符合发现者的预测。[11]
- ^ 这个值也标志着普遍接受的复合原子核寿命上限。[18]
- ^ 这种分离是基于产生的原子核会比未反应的粒子束更慢地通过目标。分离器中包含电场和磁场,它们对运动粒子的影响会因粒子的特定速度而被抵消。[20]飞行时间质谱法和反冲能量的测量也有助于这种分离,两者结合可以估计原子核的质量。[21]
- ^ 不是所有放射性衰变都是因为静电排斥力导致的。举个例子,β衰变是弱核力导致的。[25]
- ^ 由于原子核的质量不是直接测量的,而是根据另一个原子核的质量计算得出的,因此这种测量称为间接测量。直接测量也是有可能的,但在大多数情况下,它们仍然无法用于超重原子核。[26]2018年,LBNL首次直接测量了超重原子核的质量,[27]它的质量是根据转移后原子核的位置确定的(位置有助于确定其轨迹,这与原子核的质荷比有关,因为转移是在有磁铁的情况下完成的)。[28]
- ^ 如果在真空中发生衰变,那么由于孤立系统在衰变前后的总动量必须保持守恒,衰变产物也将获得很小的速度。这两个速度的比值以及相应的动能比值与两个质量的比值成反比。衰变能量等于α粒子和衰变产物的已知动能之和。[29]这些计算也适用于实验,但不同之处在于原子核在衰变后不会移动,因为它与探测器相连。
- ^ 自发裂变是由苏联科学家格奥尔基·弗廖罗夫发现的。[30]LBL的科学家们认为自发裂变的信息不足以声称合成元素,他们认为对自发裂变的研究还不够充分,无法将其用于识别新元素,因为很难确定复合原子核是不是仅喷射中子,而不是质子或α粒子等带电粒子。[18]因此他们更喜欢通过连续的α衰变将新的同位素与已知的同位素联系起来。[30]
- ^ 举个例子,1957年,元素102在瑞典斯德哥尔摩省斯德哥尔摩的诺贝尔物理研究所被错误地鉴定。[31]早先没有关于该元素发现的明确声明,所以由它的瑞典、美国和英国发现者命名为nobelium。后来证明这个元素的鉴定是错误的。[32]第二年,RL无法重现瑞典的结果,而是宣布他们合成了该元素,这一说法后来也被驳回。[32] JINR坚持认为他们是第一个发现该元素的人,并为新元素建议命名为joliotium,[33]而这个名称也没有被接受(JINR后来认为元素102的命名是仓促的)。[34]这个名称是在IUPAC对元素发现优先权的裁决的书面答复中提出的,该裁决于1992年9月29日签署。[34]但由于其广泛使用,“nobelium”这个名称仍然保持不变。[35]
- ^ Johnson, E.; Fricke, B.; Jacob, T.; Dong, C. Z.; Fritzsche, S.; Pershina, V. Ionization potentials and radii of neutral and ionized species of elements 107 (bohrium) and 108 (hassium) from extended multiconfiguration Dirac–Fock calculations. The Journal of Chemical Physics. 2002, 116: 1862. Bibcode:2002JChPh.116.1862J. doi:10.1063/1.1430256.
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 Haire, Richard G. Transactinides and the future elements. Morss; Edelstein, Norman M.; Fuger, Jean (编). The Chemistry of the Actinide and Transactinide Elements 3rd. Dordrecht, The Netherlands: Springer Science+Business Media. 2006. ISBN 1-4020-3555-1.
- ^ Chemical Data. Bohrium - Bh, Royal Chemical Society
- ^ Oganessian, Yu. Ts.; Abdullin, F. Sh.; Bailey, P. D.; Benker, D. E.; Bennett, M. E.; Dmitriev, S. N.; Ezold, J. G.; Hamilton, J. H.; Henderson, R. A. Synthesis of a New Element with Atomic Number Z=117. Physical Review Letters. 2010, 104. Bibcode:2010PhRvL.104n2502O. PMID 20481935. doi:10.1103/PhysRevLett.104.142502. (gives life-time of 1.3 min based on a single event; conversion to half-life is done by multiplying with ln(2).)
- ^ 5.0 5.1 FUSHE. Synthesis of SH-nuclei (PDF). 2012 [September 2012].[失效链接]
- ^ Wakhle, A.; Simenel, C.; Hinde, D. J.; et al. Simenel, C.; Gomes, P. R. S.; Hinde, D. J.; et al , 编. Comparing Experimental and Theoretical Quasifission Mass Angle Distributions. European Physical Journal Web of Conferences. 2015, 86: 00061. ISSN 2100-014X. doi:10.1051/epjconf/20158600061
 (英语).
(英语).
- ^ Krämer, K. Explainer: superheavy elements. Chemistry World. 2016 [2020-03-15]. (原始内容存档于2021-05-15) (英语).
- ^ Discovery of Elements 113 and 115. Lawrence Livermore National Laboratory. [2020-03-15]. (原始内容存档于2015-09-11) (英语).
- ^ Eliav, E.; Kaldor, U.; Borschevsky, A. Electronic Structure of the Transactinide Atoms. Scott, R. A. (编). Encyclopedia of Inorganic and Bioinorganic Chemistry. John Wiley & Sons: 1–16. 2018. ISBN 978-1-119-95143-8. doi:10.1002/9781119951438.eibc2632 (英语).
- ^ Oganessian, Yu. Ts.; Dmitriev, S. N.; Yeremin, A. V.; et al. Attempt to produce the isotopes of element 108 in the fusion reaction 136Xe + 136Xe. Physical Review C. 2009, 79 (2): 024608. ISSN 0556-2813. doi:10.1103/PhysRevC.79.024608 (英语).
- ^ Münzenberg, G.; Armbruster, P.; Folger, H.; et al. The identification of element 108 (PDF). Zeitschrift für Physik A. 1984, 317 (2): 235–236 [20 October 2012]. Bibcode:1984ZPhyA.317..235M. doi:10.1007/BF01421260. (原始内容 (PDF)存档于7 June 2015) (英语).
- ^ Subramanian, S. Making New Elements Doesn't Pay. Just Ask This Berkeley Scientist. Bloomberg Businessweek. [2020-01-18]. (原始内容存档于2019-12-11) (英语).
- ^ 13.0 13.1 13.2 Ivanov, D. Сверхтяжелые шаги в неизвестное [Superheavy steps into the unknown]. nplus1.ru. 2019 [2020-02-02]. (原始内容存档于2020-04-23) (俄语).
- ^ Hinde, D. Something new and superheavy at the periodic table. The Conversation. 2017 [2020-01-30]. (原始内容存档于2020-03-17) (英语).
- ^ Nuclear Reactions (PDF): 7–8. [2020-01-27]. (原始内容存档 (PDF)于2020-11-30). Published as Loveland, W. D.; Morrissey, D. J.; Seaborg, G. T. Nuclear Reactions. Modern Nuclear Chemistry. John Wiley & Sons, Inc. 2005: 249–297. ISBN 978-0-471-76862-3. doi:10.1002/0471768626.ch10 (英语).
- ^ 16.0 16.1 Krása, A. Neutron Sources for ADS. Faculty of Nuclear Sciences and Physical Engineering (Czech Technical University in Prague). 2010: 4–8. S2CID 28796927 (英语).
- ^ Wapstra, A. H. Criteria that must be satisfied for the discovery of a new chemical element to be recognized (PDF). Pure and Applied Chemistry. 1991, 63 (6): 883 [2021-11-28]. ISSN 1365-3075. doi:10.1351/pac199163060879. (原始内容存档 (PDF)于2021-10-11) (英语).
- ^ 18.0 18.1 Hyde, E. K.; Hoffman, D. C.; Keller, O. L. A History and Analysis of the Discovery of Elements 104 and 105. Radiochimica Acta. 1987, 42 (2): 67–68 [2021-11-28]. ISSN 2193-3405. doi:10.1524/ract.1987.42.2.57. (原始内容存档于2021-11-27) (英语).
- ^ 19.0 19.1 19.2 19.3 Chemistry World. How to Make Superheavy Elements and Finish the Periodic Table [Video]. Scientific American. 2016 [2020-01-27]. (原始内容存档于2020-04-21) (英语).
- ^ Hoffman, Ghiorso & Seaborg 2000,第334页.
- ^ Hoffman, Ghiorso & Seaborg 2000,第335页.
- ^ Zagrebaev, Karpov & Greiner 2013,第3页.
- ^ Beiser 2003,第432页.
- ^ Staszczak, A.; Baran, A.; Nazarewicz, W. Spontaneous fission modes and lifetimes of superheavy elements in the nuclear density functional theory. Physical Review C. 2013, 87 (2): 024320–1. ISSN 0556-2813. doi:10.1103/physrevc.87.024320
 (英语).
(英语).
- ^ Beiser 2003,第439页.
- ^ Oganessian, Yu. Ts.; Rykaczewski, K. P. A beachhead on the island of stability. Physics Today. 2015, 68 (8): 32–38 [2021-11-28]. ISSN 0031-9228. OSTI 1337838. doi:10.1063/PT.3.2880. (原始内容存档于2021-11-28) (英语).
- ^ Grant, A. Weighing the heaviest elements. Physics Today. 2018. doi:10.1063/PT.6.1.20181113a (英语).
- ^ Howes, L. Exploring the superheavy elements at the end of the periodic table. Chemical & Engineering News. 2019 [2020-01-27]. (原始内容存档于2021-11-28) (英语).
- ^ Beiser 2003,第433页.
- ^ 30.0 30.1 Robinson, A. E. The Transfermium Wars: Scientific Brawling and Name-Calling during the Cold War. Distillations. 2019 [2020-02-22]. (原始内容存档于2021-11-28) (英语).
- ^ Nobelium - Element information, properties and uses | Periodic Table. Royal Society of Chemistry. [2020-03-01]. (原始内容存档于2021-03-08) (英语).
- ^ 32.0 32.1 Kragh 2018,第38–39页.
- ^ Kragh 2018,第40页.
- ^ 34.0 34.1 Ghiorso, A.; Seaborg, G. T.; Oganessian, Yu. Ts.; et al. Responses on the report 'Discovery of the Transfermium elements' followed by reply to the responses by Transfermium Working Group (PDF). Pure and Applied Chemistry. 1993, 65 (8): 1815–1824 [7 September 2016]. doi:10.1351/pac199365081815. (原始内容存档 (PDF)于25 November 2013) (英语).
- ^ Commission on Nomenclature of Inorganic Chemistry. Names and symbols of transfermium elements (IUPAC Recommendations 1997) (PDF). Pure and Applied Chemistry. 1997, 69 (12): 2471–2474 [2021-11-28]. doi:10.1351/pac199769122471. (原始内容存档 (PDF)于2021-10-11) (英语).
- ^ 36.0 36.1 36.2 36.3 36.4 Münzenberg, G.; Hofmann, S.; Heßberger, F. P.; Reisdorf, W.; Schmidt, K. H.; Schneider, J. H. R.; Armbruster, P.; Sahm, C. C.; Thuma, B. Identification of element 107 by α correlation chains. Zeitschrift für Physik A Atoms and Nuclei (Springer). 1981, 300 (1): 107–8 [19 November 2012]. Bibcode:1981ZPhyA.300..107M. doi:10.1007/BF01412623. (原始内容存档于2013-12-27).
- ^ 37.0 37.1 37.2 37.3 Barber, R. C.; Greenwood, N. N.; Hrynkiewicz, A. Z.; Jeannin, Y. P.; Lefort, M.; Sakai, M.; Ulehla, I.; Wapstra, A. P.; Wilkinson, D. H. Discovery of the transfermium elements. Part II: Introduction to discovery profiles. Part III: Discovery profiles of the transfermium elements (Note: for Part I see Pure Appl. Chem., Vol. 63, No. 6, pp. 879-886, 1991). Pure and Applied Chemistry. 1993, 65 (8): 1757. doi:10.1351/pac199365081757.
- ^ Ghiorso, A.; Seaborg, G. T.; Oganessian, Yu. Ts.; Zvara, I.; Armbruster, P.; Heßberger, F. P.; Hofmann, S.; Leino, M.; Münzenberg, G. Responses on 'Discovery of the transfermium elements' by Lawrence Berkeley Laboratory, California; Joint Institute for Nuclear Research, Dubna; and Gesellschaft fur Schwerionenforschung, Darmstadt followed by reply to responses by the Transfermium Working Group (PDF). Pure and Applied Chemistry. 1984, 65 (8): 1815–1824 [20 October 2012]. doi:10.1351/pac199365081815. (原始内容 (PDF)存档于2016年3月4日).
- ^ 39.0 39.1 39.2 Names and symbols of transfermium elements (IUPAC Recommendations 1997). Pure and Applied Chemistry. 1997, 69 (12): 2471. doi:10.1351/pac199769122471.
- ^ Names and symbols of transfermium elements (IUPAC Recommendations 1994). Pure and Applied Chemistry. 1994, 66 (12): 2419. doi:10.1351/pac199466122419.
- ^ 中国化学会无机化学名词小组修订. 无机化学命名原则 : 1980, 统一书号:13031·2078. 1982-12: 4-5 [2020-11-10].
- ^ 刘路沙. 101—109号元素有了中文定名. 光明网. 光明日报. [2020-11-10]. (原始内容存档于2020-11-10).
- ^ 贵州地勘局情报室摘于《中国地质矿产报》(1998年8月13日). 101~109号化学元素正式定名. 贵州地质. 1998, 15: 298–298 [2020-11-10]. (原始内容存档于2020-12-03).
- ^ 44.0 44.1 Armbruster, Peter & Münzenberg, Gottfried. Creating superheavy elements. Scientific American. 1989, 34: 36–42.
- ^ Barber, Robert C.; Gäggeler, Heinz W.; Karol, Paul J.; Nakahara, Hiromichi; Vardaci, Emanuele; Vogt, Erich. Discovery of the element with atomic number 112 (IUPAC Technical Report). Pure and Applied Chemistry. 2009, 81 (7): 1331. doi:10.1351/PAC-REP-08-03-05.
- ^ Fleischmann, Martin; Pons, Stanley. Electrochemically induced nuclear fusion of deuterium. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry. 1989, 261 (2): 301–308. doi:10.1016/0022-0728(89)80006-3.
- ^ 47.0 47.1 Münzenberg, G.; Armbruster, P.; Hofmann, S.; Heßberger, F. P.; Folger, H.; Keller, J. G.; Ninov, V.; Poppensieker, K.; Quint, A. B. Element 107. Zeitschrift für Physik A. 1989, 333 (2): 163. Bibcode:1989ZPhyA.333..163M. doi:10.1007/BF01565147.
- ^ "Entrance Channel Effects in the Production of 262,261Bh" (页面存档备份,存于互联网档案馆), Nelson et al., LBNL repositories 2005. Retrieved on 2008-03-04
- ^ 49.0 49.1 Nelson, S.; Gregorich, K.; Dragojević, I.; Garcia, M.; Gates, J.; Sudowe, R.; Nitsche, H. Lightest Isotope of Bh Produced via the Bi209(Cr52,n)Bh260 Reaction. Physical Review Letters. 2008, 100 (2). Bibcode:2008PhRvL.100b2501N. doi:10.1103/PhysRevLett.100.022501.
- ^ Folden Iii, C. M. Excitation function for the production of 262Bh (Z=107) in the odd-Z-projectile reaction 208Pb(55Mn, n). Physical Review C. 2006, 73: 014611. Bibcode:2006PhRvC..73a4611F. doi:10.1103/PhysRevC.73.014611.
- ^ "Excitation function for the production of 262Bh (Z=107) in the odd-Z-projectile reaction 208Pb(55Mn, n)", Folden et al., LBNL repositories, May 19, 2005. Retrieved on 2008-02-29
- ^ Hot fusion studies at the BGS with light projectiles and 238U targets (页面存档备份,存于互联网档案馆), J. M. Gates
- ^ 53.0 53.1 Gan, Z.G.; Guo, J. S.; Wu, X. L.; Qin, Z.; Fan, H. M.; Lei, X. G.; Liu, H. Y.; Guo, B.; Xu, H. G. New isotope 265Bh. The European Physical Journal A. 2004, 20 (3): 385. Bibcode:2004EPJA...20..385G. doi:10.1140/epja/i2004-10020-2.
- ^ Morita, Kosuke; et al.. Decay Properties of 266Bh and 262Db Produced in the 248Cm + 23Na Reaction. Journal of the Physical Society of Japan. 2009, 78 (6): 064201. Bibcode:2009JPSJ...78f4201M. arXiv:0904.1093
 . doi:10.1143/JPSJ.78.064201.
. doi:10.1143/JPSJ.78.064201.
- ^ Morita, K.; Morimoto, K.; Kaji, D.; Haba, H.; Ozeki, K.; Kudou, Y.; Sato, N.; Sumita, T.; Yoneda, A. Decay Properties of 266Bh and 262Db Produced in the 248Cm+23Na Reaction—Further Confirmation of the [sup 278]113 Decay Chain—: 331. 2010. doi:10.1063/1.3455961.
- ^ 56.0 56.1 56.2 Wilk, P. A.; Gregorich, KE; Turler, A; Laue, CA; Eichler, R; Ninov V, V; Adams, JL; Kirbach, UW; Lane, MR. Evidence for New Isotopes of Element 107: 266Bh and 267Bh. Physical Review Letters. 2000, 85 (13): 2697–700. Bibcode:2000PhRvL..85.2697W. PMID 10991211. doi:10.1103/PhysRevLett.85.2697.
- ^ 57.0 57.1 Münzenberg, G.; Gupta, M. Production and Identification of Transactinide Elements: 877. 2011. doi:10.1007/978-1-4419-0720-2_19.
- ^ 58.0 58.1 "Gas chemical investigation of bohrium (Bh, element 107)" (页面存档备份,存于互联网档案馆), Eichler et al., GSI Annual Report 2000. Retrieved on 2008-02-29
- ^ 59.0 59.1 59.2 Oganessian, Yu. Ts.; Abdullin, F. Sh.; Bailey, P. D.; Benker, D. E.; Bennett, M. E.; Dmitriev, S. N.; Ezold, J. G.; Hamilton, J. H.; Henderson, R. A. Synthesis of a New Element with Atomic Number Z=117. Physical Review Letters. 2010, 104 (14): 142502. Bibcode:2010PhRvL.104n2502O. PMID 20481935. doi:10.1103/PhysRevLett.104.142502.
- ^ 60.0 60.1 60.2 60.3 60.4 60.5 Oganessian, Yu. Ts.; Penionzhkevich, Yu. E.; Cherepanov, E. A. AIP Conference Proceedings 912: 235. 2007. doi:10.1063/1.2746600.
|chapter=被忽略 (帮助) - ^ 61.0 61.1 Morita, Kosuke; Morimoto, Kouji; Kaji, Daiya; Akiyama, Takahiro; Goto, Sin-Ichi; Haba, Hiromitsu; Ideguchi, Eiji; Kanungo, Rituparna; Katori, Kenji. Experiment on the Synthesis of Element 113 in the Reaction209Bi(70Zn, n)278113. Journal of the Physical Society of Japan. 2004, 73 (10): 2593. Bibcode:2004JPSJ...73.2593M. doi:10.1143/JPSJ.73.2593.
- ^ 62.0 62.1 Hofmann, S.; Ninov, V.; Heßberger, F. P.; Armbruster, P.; Folger, H.; Münzenberg, G.; Schött, H. J.; Popeko, A. G.; Yeremin, A. V. The new element 111. Zeitschrift für Physik A. 1995, 350 (4): 281. Bibcode:1995ZPhyA.350..281H. doi:10.1007/BF01291182.
- ^ Münzenberg, G.; Armbruster, P.; Heßberger, F. P.; Hofmann, S.; Poppensieker, K.; Reisdorf, W.; Schneider, J. H. R.; Schneider, W. F. W.; Schmidt, K.-H. Observation of one correlated α-decay in the reaction 58Fe on 209Bi→267109. Zeitschrift für Physik A. 1982, 309 (1): 89. Bibcode:1982ZPhyA.309...89M. doi:10.1007/BF01420157.
- ^ 64.0 64.1 64.2 64.3 64.4 Sonzogni, Alejandro. Interactive Chart of Nuclides. National Nuclear Data Center: Brookhaven National Laboratory. [2008-06-06]. (原始内容存档于2018-06-12).
- ^ 65.0 65.1 Gray, Theodore. The Photographic Periodic Table of the Elements. periodictable.com. 2002–2010 [16 November 2012]. (原始内容存档于2012-11-11).
- ^ Malmbeck, R.; Skarnemark, G.; Alstad, J.; Fure, K.; Johansson, M.; Omtvedt, J. P. Journal of Radioanalytical and Nuclear Chemistry. 2000, 246 (2): 349. doi:10.1023/A:1006791027906. 缺少或
|title=为空 (帮助) - ^ Gäggeler, H. W.; Eichler, R.; Brüchle, W.; Dressler, R.; Düllmann, Ch.E.; Eichler, B.; Gregorich, K. E.; Hoffman, D. C.; Hübener, S. Chemical characterization of bohrium (element 107). Nature. 2000, 407 (6800): 63–5. PMID 10993071. doi:10.1038/35024044.
- 元素𬭛在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 𬭛(英文)
- 元素𬭛在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素𬭛在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 𬭛(英文)
- Los Alamos National Laboratory – Bohrium(页面存档备份,存于互联网档案馆)
- Properties of BhO3Cl

