溴(拼音:xiù,注音:ㄒ丨ㄡˋ,粤拼:cau3;英语:Bromine),是一种化学元素,其化学符号为Br,原子序数为35,原子量为79.904 u,是一种卤素。溴分子在标准温度和压力下是有挥发性的红棕色液体,活性介于氯与碘之间。纯溴也称溴素。溴蒸气具有腐蚀性,并且有毒。2007年约制造了556,000公吨的溴。[2]溴与其化合物可被用来作为阻燃剂(溴化阻燃剂)、净水剂、杀虫剂、染料等等。曾是常用消毒药剂的红药水中就含有溴和汞。在照相术中,溴和碘与银的化合物担任感光剂的角色。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 气体/液体:棕红色 固体:带金属光泽  | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 溴(Bromine)·Br·35 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 卤素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 17 ·4·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 79.904(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Ar] 3d10 4s2 4p5 2, 8, 18, 7 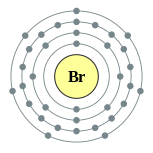 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 路易斯·尼可拉斯·瓦奎宁(1825年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 路易斯·尼可拉斯·瓦奎宁(1825年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 液态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (Br2,液态)3.1028 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 265.8 K,-7.2 °C,19 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 332.0 K,58.8 °C,137.8 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相点 | 265.90 K(−7 °C),5.8[1] kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 588 K,10.34[1] MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (Br2)10.571 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | (Br2)29.96 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | (Br2) 75.69 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 7, 5, 4, 3, 1, -1 (强酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.96(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:1139.9 kJ·mol−1 第二:2103 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 120±3 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 185 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 正交 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)7.8×1010 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 0.122 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速 | (20°C)206 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7726-95-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:溴的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
溴元素化学性质十分活泼,所以不会独立存在于自然界,存在于无色可溶结晶卤化盐,类似于食盐。虽然在地壳中相对稀少,但溴离子的高可溶性让它积聚于海洋中。商业上,可轻易的从卤池中分离溴元素,多数于美国、以色列和中国。溴存在于海洋中的质量大概是氯的三分之一。
在高温条件下,有机溴化合物会解离形成自由溴原子,使自由基连锁反应终止。这个效应让有机溴化合物成为实用的阻燃剂,每年生产出的溴,过半作为此用途。同样的性质,大气中的挥发性有机溴化合物容易被紫外线太阳光分解,成为自由溴原子,造成臭氧层破损。因此,许多有机溴化合物,例如做为杀虫剂的溴甲烷,已不再被使用。溴化合物仍被使用于钻井液、感光底片及工业上有机化合物的反应中间体。
大量的溴盐是剧毒,因为溶出的溴离子作用,造成溴中毒。然而,溴离子和次溴酸的生物角色最近被阐明,发现它是人类必需的微量元素。生物性有机溴化合物在海洋生命,例如藻类中的角色,在更早之前便已得知。在药学上,简单的溴离子有对中枢神经系统的抑制作用。在被短效药物取代之前,溴化盐曾是主要的药用镇定剂。它们仍然保有对抗癫痫的优点。
溴分别被两个科学家安东尼·巴拉尔[3]和卡尔·罗威[4]在1825年与1826年所发现。[5]
1826年,刚刚取得药剂师学位的年轻化学实验室助理巴拉尔在蒙彼利埃的盐沼中的海苔的灰烬中发现了一种棕黄色的液体,这种液体后来被证明是溴的化合物。那些海苔是用来制备碘的,但其中也含有溴。巴拉尔从有着饱和氯的海苔灰溶液中分离出溴。他发现产物的性质介于氯与碘之间,因此他试着证明该化合物是一氯化碘(ICl),但在失败后他确信他发现了一个新元素,并把它称之为rutile(意为红色),而他的导师约瑟夫·安哥拉达则建议称之为muride[6],源自拉丁文字muria,意思是卤水。[3]
卡尔·贾古柏·罗威在1825年从巴特克罗伊茨纳赫村里的水泉中分离出了溴。罗威用了一个有饱和氯的矿物盐溶液,并用二乙醚提取出了溴。在醚蒸发后,留下了一些棕色的液体。他用此液体作为他工作的样本申请了一个在利奥波德·格梅林实验室的职位。由于发现的公开被延迟了,所以巴拉尔率先发表了他的结果。[4]
在法国科学家路易斯·尼可拉斯·瓦奎宁和路易斯·贾奎斯·瑟纳德与约瑟夫·路易·盖-吕萨克证实了年轻药剂师巴拉尔的实验之后,结论出现在法国科学院的一场演讲上,并被发表在化学纪实上。[7]在他发表的论文中,巴拉尔说他基于安格拉达的建议把新元素的名字从muride改成brôme。其他的说法则认为法国的化学与物理学家约瑟夫·路易·盖-吕萨克基于它蒸气的独特气味建议了这个名称。[8]溴直到1860年才被大量的制造。
在少数的药学应用之外,溴的第一个商业应用是用于银版摄影法。在1840年,发现到用溴制造银版摄影法用的光敏的卤化银在许多地方胜过之前所使用的碘蒸气。[9]
溴化钾与溴化钠在19世纪末期到二十世纪初期被用作抗癫痫药与镇静剂,直到他们渐渐地被水合氯醛与巴比妥类药物所取代。[10]
溴的名称Bromine来自希腊文bromos(βρῶμος,公山羊的恶臭)[11],日文中便将之意译为“臭素”。
汉语中的“溴”字,原出处为《荀子·劝学篇》“兰槐之根是为芷其渐之溴君子不近”。这里的溴,也做滫,是指臭水。十九世纪徐寿引进西方的化学知识体系,写著《化学鉴原》时,用溴这个生僻字指称第35号化学元素,此后溴这个字就有了全新的意义。
溴的原子序是卤素中的第三位,在元素周期表中为第17族,是唯一在室温下呈液态的非金属元素。元素单质的形式是双原子分子:Br2。它是黏稠、可流动、红棕色的液体,并在标准温度和压力下容易挥发,形成红色的蒸气(颜色近似于二氧化氮),并且有一股与氯气相似的恶臭。溴是一种卤素,它的活性小于氯但大于碘。溴微溶于水,但对二硫化碳,有机醇类(像甲醇)与有机酸的溶解度佳。它很容易与其他原子键结并有强烈的漂白作用。溴像氯一样,也用在游泳池的维护。
一些特定的溴化合物被认为是有可能破坏臭氧层的或是具有生物累积性的。所以许多工业用的溴化合物不再被生产,被限制,或逐渐的淘汰。蒙特利尔公约提到了一些有机溴化物是需要被逐渐淘汰的。
溴是一种强氧化剂。它会和金属和大部分有机化合物产生激烈的反应,若有水参与则反应更加剧烈,溴和金属反应会产生金属溴盐及次溴酸盐(有水参与时),和有机化合物则可能产生磷光或萤光化合物。
溴的性质近似于氟、氯、碘,但介于氯和碘之间。它的电子组态是[Ar]3d104s24p5,第四也是最外壳层有七个价电子。就像全部的卤素,它还缺少一个电子才能成为一个完整的八隅体。是强氧化剂,会和许多元素反应以填满它的外壳层。[12]根据元素周期性,它的电负度介于氯和碘之间(氟:3.98,氯:3.16,溴:2.96,碘:2.66),化学活性比氯低但比碘高。相反地,溴离子的的氧化力较碘离子弱但比氯离子强。[12]这些相似性导致氯、溴和碘在早期被约翰·沃尔夫冈·德贝莱纳分类为三元组,预见了化学元素周期性的存在。[13][14]它的原子半径介于氯和碘之间,许多性质也近似氯和碘的中间值,例如第一游离能、电子亲和力、分子解离焓、离子半径和X-X键结长度。[12]溴的挥发性导致其高度的侵入性、窒息性和刺激性气味。[15]
全部四个稳定的卤素皆有分子间凡得瓦力引力,它们的强度随着同核双原子卤素分子的电子数量增加而增高。因此,溴的熔点及沸点皆在氯和碘之间。也因为卤素一族的分子量由上而下增加,溴的密度、熔化热和蒸发热介于氯和碘之间,虽然因为其双原子分子结构,它们的蒸发热皆很低(导致高挥发性)。[12]卤素的颜色由上而下变深:氟是淡黄色气体,氯是黄绿色,溴是红棕色挥发性液体(熔点−7.2℃,沸点58.8℃),碘是有光泽的黑色固体。这个趋势的形成原因是可被卤素吸收的可见光波长由上而下增加。[12]针对卤素的颜色,对溴而言,由于在最高占用分子反键结轨域πg和最低未占用分子反键结轨域σu之间的电子跃迁,[16]它的颜色在低温变浅,所以固态溴在−195℃时是淡黄色。[12]
就像固态氯和碘,固态溴的晶体属于斜方晶系,是一种溴分子的层状晶格。溴分子键长为227皮米(近似于气态溴分子的键长228皮米),在同一层溴分子中,Br···Br的距离为331皮米,层间距离为399皮米(溴凡德瓦半径195皮米)。这个结构代表溴是非常差的电导体,在稍低于熔点下量测的导电度,约为5 × 10−13 Ω−1 cm−1,但比完全量测不出导电度的氯稍好。[12]
在55GPa(约54万倍大气压力)的压力下,溴从绝缘体转为金属。在75GPa,它转为面心斜方结构。在100GPa,它转为体心斜方单原子结构。[17]
同位素
溴有两个稳定的同位素:79Br及81Br。自然界中只有这两种同位素,79Br占51%,81Br占49%。两者皆有3/2-核子自旋,可用于核磁共振,其中81Br较常用。它们近似一比一的分布对用质谱仪分辨含有溴的化合物十分有帮助。其它至少已发现23种放射性同位素存在,[18]不少是核分裂的产物,多因半衰期太短而无法存在于自然界。有几种来自于核分裂产物的大原子量溴同位素会产生延迟性的中子衰变。所有的放射性溴同位素的半衰期相对来讲是比较短的,半衰期最长的是一个中子数不足的同位素。其中,最重要的是80Br(t1/2=17.7分钟)、80mBr (t1/2=4.421小时)和82Br(t1/2=35.28小时),皆为天然溴元素中子活化产生。[12]最稳定的溴放射性同位素是77Br(t1/2=57.04小时)。比79Br轻的同位素最主要的衰变模式是借由电子捕获衰变为硒的同位素;比81Br重的同位素借由β衰变成氪的同位素;80Br可能借由前述两方法衰变成稳定80Se或80Kr。[19]
溴在自然界中和其他卤素一样,基本没有单质状态存在。它的化合物常常和氯的化合物混杂在一起,但是数量少得多,在一些矿泉水、盐湖水(如死海)和海水中含有溴。地球上99%的溴元素以Br-的形式存在于海水中,所以人们也把溴称为“海洋元素”。由过滤法,溴盐在海水里的含量约65 ppm,[20]但它在海里的浓度比氯小。溴可以在溴含量丰富的卤井与死海(接近50000ppm)中商业开采。[21][22]

2007年制造的溴接近556,000公吨(价值约25亿美元),其中最主要的生产国是美国,以色列与中国。[23][24][25]溴的生产量自1960年代以来已经成长了六倍,美国溴含量最多的地方在哥伦比亚县与犹尼昂县。[26]中国的溴来源位于山东省,而以色列的溴则源于死海的水。使用氯气来处理富含溴的卤水,在过程中,溴离子被氯气所氧化而形成溴分子。
由于溴的商业运用以及很长的保存时间,人们不会刻意的去制备它。但小量的溴可以经由固态溴化钠与浓硫酸(H2SO4)制备。反应的第一步是制造气态的溴化氢(HBr),但于此反应条件下,部分的溴化氢会被进一步硫酸氧化形成溴分子(Br2)与二氧化硫(SO2)。
还可以用氢溴酸和过氧化氢反应制备。
或者使用以下归中反应制备:
使用相似的化合物,如使用稀盐酸与次氯酸钠也是可以的。最重要的是,该酸的阴离子(以上述的例子,硫酸根与氯离子)的电负度比溴还大,使取代反应能够发生。
有机化学
有机化合物要被溴化有加成反应与取代反应两种途径。溴对烯的双键进行电加成,中途产生一个环状含溴的中间产物。在像二硫化碳之类的无水溶剂里,反应将产生二溴的产物。举例来说,它跟乙烯反应将会产生1,2-二溴乙烷,溴也可以对苯酚与苯胺进行加成反应。当用来反应的是溴水时,除了本来会出现的二溴化物外,有少部分的烯会被反应成卤代醇。由于溴的反应是非常的可靠的,所以溴水被拿来做检测烯类、苯酚与苯胺的检测试剂。就像其他的卤素一样,溴也可以进行自由基反应,举例来说,烃类在光照下可被溴溴化。
溴,在有催化量的的磷的情况下,可以轻易的以溴化羧酸中的α-氢。这个方法被称做赫尔-乌尔哈-泽林斯基反应,是商业制溴乙酸法的基础。人们通常使用N-溴代琥珀酰亚胺来代替元素态的溴,因为它比较好处理,而且反应也比较温和且更具选择性。有机溴化物相对于活性较弱的有机氯化物与较贵的有机碘化物而言,是比较好的选择。因此,格氏试剂与有机锂化物通常使用相对应的有机溴化物来制造。
无机反应
| 溴的氧化态 | |
|---|---|
| -1 | HBr |
| +1 | BrCl |
| +3 | BrF3 |
| +5 | BrF5 |
| +5 | BrO3− |
| +7 | BrO4− |
溴是一种氧化剂,它会把碘离子氧化成碘,同时自身还原成溴离子。
溴也会把金属与类金属氧化成相对应的溴化物,通常无水的溴与含水的溴比起来活性较低,但无水的溴会与铝、钛、汞、锑、碱土金属与碱金属剧烈的反应。
如果溴是溶解在含水的氢氧化物中的话,溴离子(Br−)将会与次溴酸根(BrO−)一起产生,产生的次溴酸根是溴化物且具有漂白能力的原因。在一些化合物中,次溴酸根的自身氧化还原是定量的,其产生的溴酸根是与氯酸根相当相似的强氧化剂。
过溴酸根无法使用制造过氯酸根的方法-电解来制造,其制造方法是将溴酸根与氟进行反应。
许多种的有机溴化物在工业上有其应用,其中一部分是由溴制备而来,另一部分则是由溴化氢制备而来。而溴化氢则是以在溴中燃烧氢来取得。[2]
加成反应[27]是制备1,2-二溴乙烷的过程,而1,2-二溴乙烷是有机溴化物中被制造的量最多的。
阻燃物
含溴阻燃剂的重要性与日俱增,当燃烧发生时,阻燃剂会生成氢溴酸,它会干扰在火焰当中所进行的氧化连锁反应。高活性的氢、氧与氢氧根自由基会与溴化氢反应成活性没那么强的溴自由基。[28][29]含溴的化合物可以借由在聚合过程中加入一些被溴化的单体或在聚合后加入含溴化合物的方法加入聚合物中。添加四溴双酚A可以制造聚酯与环氧树脂,用于印刷电路板(PCB)的环氧树脂通常都是由阻燃剂制成的,并且在产品缩写中以FR来表示。(如FR-4与FR-2)溴乙烯可以用来制造聚乙烯、聚氯乙烯与聚丙烯。十溴二苯醚可以添加在已完成的聚合物中。[30]
汽油添加剂
1,2-二溴乙烷是添加在含铅汽油中的一种汽油添加剂,它借由产生挥发性的溴化铅来移除引擎中的铅,此类用法在美国占了1966年全部溴用量的77%,但这种用途在1970年代因为会污染环境而被禁止了。[31]此化合物也曾被当作杀虫用的熏剂,但此种应用也一样的被禁止了。[25]
杀虫剂
溴甲烷曾被广泛的用做烟薰土地用的农药,蒙特利尔公约决定到2005年逐渐淘汰这种会破坏臭氧层的化合物。在1991年,估计有35,000公吨的此化合物被用来对付线虫动物、真菌、杂草还有一些土壤的问题。[32][33]
其他用途

- 钙、钠与锌的溴化物在溴的市场中占有一席之地,这些盐类在水里产生稠密的化合物,可以用来做钻井液,有时也被称做clear brine fluids。[25][34]
- 溴也可以用来生产溴化植物油,溴化植物油在许多橘子口味的软性饮料中当作乳剂。在此化合物于1940年代被发现后,它被广泛地使用,直到在1970年代中期,英国与美国限制了它的使用并且研发出了替代用的乳剂。[35]但在1997年美国的软性饮料仍然可以含有含溴植物油。[36]
- 某些染料、农业化学药品与药品是有机溴化合物。1-溴-3-氯丙烷、1-溴乙基苯与1-溴化烷是利用烯类与溴化氢的反马氏规则加成来制备的。溴化乙锭(EtBr)在凝胶电泳中当作DNA的染色剂。
- 高折射率的化合物。
- 水净化与消毒用化合物。[25]
- 溴化钾被一些摄影业者使用来防止雾(不希望出现的银的还原)的生成。
- 溴蒸气被用于敏化银版摄影法用的银版的第二步,该版之后会经过汞蒸气的处理。溴的角色是加强刚被碘化的银版的光敏。

溴在人体中还未找到已知的功能,但有机溴化合物的确自然存在。海中的有机物是有机溴化合物的主要来源,在1999年有超过1600种化合物被发现。其中最常见的是溴甲烷,海藻估计制造了56,000公吨的此化合物,[37]夏威夷的芦笋藻所制成的香精油中就含有80%的溴甲烷。[38]一个有名且已被人类长时间使用的有机溴化合物是泰尔紫,[37][39]这种含溴的紫色物质存在于一种体型中等的掠食性海蜗牛:腹足纲的紫螺蜗牛之中。这种天然的有机溴化合物直到1909年才被保罗·弗里德兰德所发现。[40]大部分自然界中的有机溴化合物是由溴化过氧化酶所产生的。[41]
元素状态的溴是有毒且有刺激性的,其蒸气有强烈腐蚀性,能破坏橡胶。因为溴是一种氧化剂,它不能与大部分的有机或无机化合物稳定的共存,所以输送溴时需要谨慎,通常是使用内衬著铅的钢制桶子,并以坚固的金属架支撑。
当某些特定的含溴离子化合物在酸性环境下与高锰酸钾(KMnO4)混合时,会产生淡棕色的溴雾,它闻起来像是漂白水,并且对黏膜有很强的刺激性以及催泪性。一旦有人暴露于其中,应该立即移动至有新鲜空气的地方,如果出现了某些症状,那么必须以药物治疗。
- ^ 1.0 1.1 Haynes, William M. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data 92nd. Boca Raton, FL.: CRC Press. 2011: 4.121. ISBN 978-1-4398-5511-9. OCLC 730008390 (英语).
- ^ 2.0 2.1 Jack F. Mills "Bromine" in Ullmann's Encyclopedia of Chemical Technology Wiley-VCH Verlag; Weinheim, 2002. DOI: 10.1002/14356007.a04_391
- ^ 3.0 3.1 Balard, Antoine. Memoire of a peculire Substance contained in Sea Water. Annals of Philosophy. 1826: 387– and 411–.
- ^ 4.0 4.1 Landolt, Hans Heinrich. Nekrolog: Carl Löwig. Berichte der deutschen chemischen Gesellschaft. 1890, 23 (3): 905–909 [2009-04-05]. doi:10.1002/cber.18900230395. (原始内容存档于2021-07-17).
- ^ Weeks, Mary Elvira. The discovery of the elements: XVII. The halogen family.. Journal of Chemical Education. 1932, 9: 1915.
- ^ Rediscovery of elements (PDF). [2009-07-02]. (原始内容 (PDF)存档于2012-01-21).
- ^ Balard, A.J. Annales de Chimie et Physique 32: 337–382. 1826.
- ^ Wisniak, Jaime. Antoine-Jerôme Balard. The discoverer of bromine (PDF). Revista CENIC Ciencias Químicas. 2004, 35 (1).[失效链接]
- ^ Barger, M. Susan; White, William Blaine. Technological Practice of Daguerreotypy. The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. 2000: 31–35. ISBN 9780801864582.
- ^ Shorter, Edward. A History of Psychiatry: From the Era of the Asylum to the Age of Prozac. John Wiley and Sons: 200–202. 1997. ISBN 9780471245315.
- ^ Gemoll W, Vretska K: Griechisch-Deutsches Schul- und Handwörterbuch("Greek-German dictionary"), 9th ed., published by öbvhpt Archive.is的存档,存档日期2012-09-08, ISBN 978-3-209-00108-5
- ^ 12.0 12.1 12.2 12.3 12.4 12.5 12.6 12.7 Greenwood and Earnshaw, pp. 800–4
- ^ Johann Wolfgang Dobereiner. Purdue University. [2008-03-08]. (原始内容存档于2014-11-14).
- ^ A Historic Overview: Mendeleev and the Periodic Table (PDF). NASA. [2008-03-08]. (原始内容存档 (PDF)于2008-03-07).
- ^ Greenwood and Earnshaw, p. 793–4
- ^ Greenwood and Earnshaw, pp. 804–9
- ^ Duan, Defang; et al. Ab initio studies of solid bromine under high pressure. Physical Review B. 2007-09-26, 76 (10): 104113. Bibcode:2007PhRvB..76j4113D. doi:10.1103/PhysRevB.76.104113.
- ^ GE Nuclear Energy. Chart of the Nuclides, 14th Edition. 1989.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik, The NUBASE evaluation of nuclear and decay properties, Nuclear Physics A, 2003, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Tallmadge, John A.; Butt, John B.; Solomon Herman J. Minerals From Sea Salt. Ind. Eng. Chem. 1964, 56 (7): 44–65. doi:10.1021/ie50655a008.
- ^
Oumeish, Oumeish Youssef. Climatotherapy at the Dead Sea in Jordan. Clinics in Dermatology. 1996, 14 (6): 659–664. doi:10.1016/S0738-081X (96)00101-0 请检查
|doi=值 (帮助). - ^ Al-Weshah, Radwan A. The water balance of the Dead Sea: an integrated approach. Hydrological Processes. 2008, 14 (1): 145–154.
- ^ Emsley, John. Bromine. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001: 69–73. ISBN 0198503407.
- ^ Lyday, Phyllis A. Comodity Report 2007: Bromine (PDF). United States Geological Survey. [2008-09-03]. (原始内容存档 (PDF)于2017-04-27).
- ^ 25.0 25.1 25.2 25.3 Lyday, Phyllis A. Mineral Yearbook 2007: Bromine (PDF). United States Geological Survey. [2008-09-03]. (原始内容存档 (PDF)于2016-03-04).
- ^ Bromine:An Important Arkansas Industry 互联网档案馆的存档,存档日期2009-02-25., Butler Center for Arkansas Studies
- ^ N. A. Khan, F. E. Deatherage, and J. B. Brown (1963). "Stearolic Acid". Org. Synth.; Coll. Vol. 4: 851.
- ^ Green, Joseph. Mechanisms for Flame Retardancy and Smoke suppression -A Review. Journal of Fire Sciences. 1996, 14 (6): 426–442. doi:10.1177/073490419601400602.
- ^ Kaspersma, Jelle; Doumena, Cindy; Munrob Sheilaand; Prinsa, Anne-Marie. Fire retardant mechanism of aliphatic bromine compounds in polystyrene and polypropylene. Polymer Degradation and Stability. 2002, 77 (2): 325–331. doi:10.1016/S0141-3910 (02)00067-8 请检查
|doi=值 (帮助). - ^ Weil, Edward D.; Levchik, Sergei. A Review of Current Flame Retardant Systems for Epoxy Resins. Journal of Fire Sciences. 2004, 22 (1): 25–40. doi:10.1177/0734904104038107.
- ^ Alaeea, Mehran; Ariasb, Pedro; Sjödinc, Andreas; Bergman, Åke. An overview of commercially used brominated flame retardants, their applications, their use patterns in different countries/regions and possible modes of release. Environment International. 2003, 29 (6): 683–689. doi:10.1016/S0160-4120 (03)00121-1 请检查
|doi=值 (帮助). - ^ Messenger, Belinda; Braun, Adolf. Alternatives to Methyl Bromide for the Control of Soil-Borne Diseases and Pests in California (PDF). Pest Management Analysis and Planning Program. 2000 [2008-11-17]. (原始内容 (PDF)存档于2010-04-21).
- ^ Decanio, Stephen J.; Norman, Catherine S. Economics of the "Critical Use" of Methyl bromide under the Montreal Protocol. Contemporary Economic Policy. 2008, 23 (3): 376–393. doi:10.1093/cep/byi028.
- ^ Darley, H. C. H.; Gray, George Robert. Composition and Properties of Drilling and Completion Fluids. Gulf Professional Publishing. 1988: 61–62. ISBN 9780872011472.
- ^ Kaufman, Vered R.; Garti, Nissim. Effect of cloudy agents on the stability and opacity of cloudy emulsions for soft drinks. International Journal of Food Science & Technology. 1984, 19 (2): 255–261. doi:10.1111/j.1365-2621.1984.tb00348.x.
- ^ Horowitz, B. Zane. Bromism from Excessive Cola Consumption',Clinical Toxicology 35 (3): 315–320. 1997. doi:10.3109/15563659709001219.
- ^ 37.0 37.1 Gordon W. Gribble. The diversity of naturally occurring organobromine compounds. Chemical Society Reviews. 1999, 28 (5): 335. doi:10.1039/a900201d.
- ^ Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta). Journal of Agricultural snd Food Chemistry. 1976, 24 (4): 856–861. doi:10.1021/jf60206a040. Authors list列表中的
|first1=缺少|last1=(帮助); 使用|coauthors=需要含有|author=(帮助) - ^ Gordon W. Gribble. Naturally Occurring Organohalogen Compounds. Acc. Chem. Res. 1998, 31 (3): 141–152. doi:10.1021/ar9701777.
- ^ Friedländer, P. Über den Farbstoff des antiken Purpurs aus murex brandaris. Berichte der deutschen chemischen Gesellschaft. 1909, 42 (1): 765–770.
- ^ Butler, Alison; Carter-Franklin, Jayme N. The role of vanadium bromoperoxidase in the biosynthesis of halogenated marine natural products. Natural Product Reports. 2004, 21: 180–188. doi:10.1039/b302337k.
| 维基共享资源中相关的多媒体资源:溴 |
| 查看维基词典中的词条“溴”。 |
- 元素溴在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 溴(英文)
- 元素溴在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素溴在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 溴(英文)
- Los Alamos National Laboratory – Bromine (页面存档备份,存于互联网档案馆)
- Theodoregray.com – Bromine (页面存档备份,存于互联网档案馆)
- USGS Minerals Information: Bromine (页面存档备份,存于互联网档案馆)
- Bromine Science and Environmental Forum (BSEF) (页面存档备份,存于互联网档案馆)
- Thermal Conductivity of BROMINE (页面存档备份,存于互联网档案馆)
- Viscosity of BROMINE (页面存档备份,存于互联网档案馆)

