铕(拼音:yǒu,注音:丨ㄡˇ,粤拼:jau5;英语:Europium;),是一种化学元素,其化学符号为Eu,原子序数为63,原子量为151.964 u,属于镧系元素,也是稀土元素之一。元素以欧洲(Europe)命名。铕是一种较坚硬的银白色金属,在空气和水中容易氧化。铕的氧化态通常为+3,但其+2态也并不鲜见。所有氧化态为+2的铕化合物都具有轻微的还原性。铕在生物体中没有重要的功用,和其他重金属相比毒性较低。铕的大部分应用都采用了其化合物的磷光特性,例如电视机的磷光体以及欧罗(欧元)纸币的防伪磷光体等。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色,表面一般有氧化变色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 铕(Europium)·Eu·63 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 镧系元素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 不适用 ·6·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 151.964 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氙] 4f7 6s2 2, 8, 18, 25, 8, 2 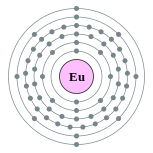 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 尤金·德马塞(1896年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 尤金·德马塞(1901年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 5.264 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 5.13 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1099 K,826 °C,1519 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 1802 K,1529 °C,2784 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 9.21 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 176 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 27.66 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 3, 2, 1 (微碱性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | ? 1.2(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:547.1 kJ·mol−1 第二:1085 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 198±6 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 体心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (室温)(多晶)0.900 µ Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 13.9(估值) W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | (室温)(多晶) 35.0 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 18.2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 7.9 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 8.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.152 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 167 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-53-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铕的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
物理性质


铕是一种可延展金属,硬度与铅相约。其晶体结构为体心立方。[2]铕的一些性质和其半满的电子层有很大的关系。在镧系元素中,铕的熔点第二低,密度则最低。[2]
在冷却至1.8 K、加压至80 GPa时,铕会变成超导体。这是因为,铕在金属态下化合价为二,[3]在受压的情况下化合价变为三。二价状态下强大的局域磁矩(J = 7/2)抑制了超导相态,而三价时的磁矩为零,因此超导性质得以发挥。[4]
化学性质
铕是反应性最高的稀土元素。它在空气中会迅速氧化:大约厘米大小的铕金属样本在几天之内就会整块氧化。[5]在水中铕的反应性和钙相近,反应式为
由于反应性高,就算涂上一层矿物油保护层,固体铕样本也一般不会有闪亮的金属表面。铕会在150至180 °C的空气当中自燃,形成三氧化二铕:
铕在稀硫酸中容易溶解,形成淡粉红色的水合铕(III)溶液:[6]
铕一般显三价态,但有时也会形成二价化合物。这在几乎完全形成三价化合物的镧系元素中是比较少见的。铕的+2态的电子排布为4f7,因为半满的f壳层有更高的稳定性。在大小和配位数方面,铕(II)和钡(II)相似。例如,两者的硫酸盐都很难溶于水。[7]二价铕是一种弱还原剂,且会在空气中氧化成三价铕化合物。在缺氧条件(特别是地热条件)下,二价铕足够稳定,所以会掺入钙以及其他碱土金属的矿物之中。这种离子交换过程是“负铕异常”现象的基础,即镧系元素矿物(如独居石)的铕含量相对颗粒陨石含量偏少。氟碳铈矿(Bastnäsite)的负铕异常比独居石轻微,因此成为了今天铕元素的主要来源。虽然铕的浓度一般很低,但由于它的二价离子可以很容易从其他三价镧系元素中分离出来,所以较易取得。
同位素
自然形成的铕元素由两种同位素组成:151Eu和153Eu,后者的丰度为52.2%,比前者稍高。153Eu是稳定同位素,但151Eu则会进行α衰变,半衰期为5+11−3×1018 年,[8]即在1公斤自然铕样本中大约每2分钟发生一次α衰变事件。这一数值与理论预测值吻合。除了自然的放射性同位素151Eu以外,已知的人造放射性同位素共有35种,其中最稳定的有150Eu(半衰期为36.9年)、152Eu(13.516年)和154Eu(8.593年)。所有剩余的放射性同位素半衰期都在4.7612年以下,且大部分小于12.2秒。铕共有8种亚稳态,最稳定的有150mEu(半衰期为12.8小时)、152m1Eu(9.3116小时)和152m2Eu(96分钟)。[9]
质量比153Eu低的同位素衰变模式主要是电子捕获,并一般产生钐的同位素;质量更高的则主要进行β−衰变,并一般产生钆的同位素。[9]
| 同位素 | 151Eu | 152Eu | 153Eu | 154Eu | 155Eu |
|---|---|---|---|---|---|
| 产量 | ~10 | 低 | 1580 | >2.5 | 330 |
| 靶恩 | 5900 | 12800 | 312 | 1340 | 3950 |
铕是某些核裂变反应的产物,但铕同位素质量较高,其裂变产物产量很低。
和其他镧系元素一样,铕的许多同位素,特别是奇数质量数和低中子数的同位素(如152Eu),拥有很高的中子捕获截面,通常可以作为中子毒物。
钐-151经β衰变后会产生151Eu,但由于半衰期长,吸收中子的平均时间短,所以大部分151Sm最终会变为152Sm。
| 项: 单位: |
t½ a |
产额 % |
Q* KeV |
βγ * |
|---|---|---|---|---|
| 155Eu | 4.76 | .0803 | 252 | βγ |
| 85Kr | 10.76 | .2180 | 687 | βγ |
| 113mCd | 14.1 | .0008 | 316 | β |
| 90Sr | 28.9 | 4.505 | 2826 | β |
| 137Cs | 30.23 | 6.337 | 1176 | βγ |
| 121mSn | 43.9 | .00005 | 390 | βγ |
| 151Sm | 90 | .5314 | 77 | β |
152Eu(半衰期为13.516年)和154Eu(8.593年)不能作为β衰变产物,因为152Sm和154Sm都没有放射性。154Eu和134Cs是仅有的两个裂变产量高于百万分之2.5的长寿命受屏蔽核素。[10]对153Eu进行中子活化,可以产生更大量的154Eu,但其中大部分会再转化为155Eu。
对于铀-235和热中子,155Eu(半衰期为4.7612年)的裂变产量为百万分之330,其大部分会在燃料燃耗结束时嬗变成无放射性、无吸收性的钆-156。
整体来说,在辐射危害上,铕比铯-137和锶-90弱得多,而作为中子毒物,铕则比钐弱很多。[11][12][13][14][15][16][17]
存量

铕在自然界中不以单体出现。许多矿物都含有铕,其中最重要的包括:氟碳铈矿、独居石、磷钇矿和铈铌钙钛矿。[18]
相对其他稀土元素来说,铕有时会在矿物中具有偏高或者偏低的含量,这种现象称为铕异常。[19]地球化学和岩石学的微量元素分析常用到铕元素,以了解火成岩的形成过程。通过分析铕异常情况,可有助重建一套火成岩之间的关系。
少量的二价铕(Eu2+)可以作为某些萤石(CaF2)样本的亮蓝色萤光激活剂。Eu3+在高能粒子照射下会变为Eu2+。[20]这种萤光矿物可以在英国北部Weardale及周边地区。英文中的萤光一词(fluorescence)就是来自此处所发现的萤石(fluorite)。直到很久以后人们才发现,萤光是矿石中的铕所造成的。[21][22][23][24]
铕一般和其他的稀土元素一同出现,所以是一起开采,并之后再分离开来的。氟碳铈矿、铈铌钙钛矿、磷钇矿和独居石等矿石中含有可开采量的稀土元素。首两种为正磷酸盐矿物LnPO4(Ln表示除钷以外所有的镧系元素),磷钇矿为氟碳酸盐矿物LnCO3F。独居石同时含有钍和钇,而钍及其衰变产物都具有放射性,使处理过程更为困难。从原矿萃取和分离各种镧系元素的方法有几种。方法的选择要考虑矿物的成分和浓度,以及每种镧系元素在矿物浓缩物中的分布。矿石首先经过烘烤,再经酸碱来回浸溶,形成镧系元素的混合浓缩物。如果其中铈居多,就可将铈(III)转化为铈(IV),从而沉淀出来。利用溶剂萃取法或离子交换层析法能够增加铕在混合物中的比例。用锌、锌汞齐、电离等方法可以把铕(III)转化为铕(II)。后者的化学性质和碱土金属相似,因此可以以碳酸盐的形态沉淀出来,或与硫酸钡共沉淀。[25]要制备铕金属,可以对熔融三氯化铕(EuCl3)和氯化钠(NaCl)或氯化钙(CaCl2)的混合物进行电离,以石墨电解槽作为阴极,石墨作为阳极。反应同时也会产生氯气。[18][25][26][27][28]
世界上有多个出产铕的大型矿藏。中国内蒙古的白云鄂博铁矿含有大量的氟碳铈矿和独居石,估计稀土金属氧化物的含量有3600万吨,因此它是目前世界上最大的矿藏。[29][30][31]中国依靠白云鄂博铁矿在1990年代成为了最大的稀土元素产国。所产出的稀土元素中,只有0.2%是铕。1965年至1990年代,美国加州山口(Mountain Pass)稀土矿场是全球第二大稀土元素来源。当地的氟碳铈矿含有较高浓度的轻稀土元素(镧至钆、钪、钇),而铕含量则只有0.1%。俄罗斯西北部的科拉半岛出产铈铌钙钛矿,是另一个大型稀土元素产地。除铌、钽和钛以外,它拥有高达30%的稀土元素,因此是这些元素在俄罗斯的最大来源。[18][32]

在大多数条件下,铕化合物都具有+3氧化态。在这些化合物中,铕(III)通常与6至9个含氧配位体(通常为水)成键。铕的氯化物、硫酸盐、硝酸盐都可溶于水和极性有机溶液。具亲脂性的铕配合物一般拥有类似乙酰丙酮的配位体,例如EuFOD。
卤化物
铕金属可与所有卤素反应:
如此形成白色的三氟化铕(EuF3)、黄色的三氯化铕(EuCl3)、灰色的三溴化铕(EuBr3)以及无色的三碘化铕(EuI3)。对应的二卤化物同样可以形成:黄绿色的二氟化铕(EuF2)、无色的二氯化铕(EuCl2)、无色的二溴化铕(EuBr2)以及绿色的二碘化铕(EuI2)。[2]
氧族及氮族元素化合物
铕可以和所有氧族元素形成稳定化合物,其中较重的氧族元素(硫、硒和碲)会使较低的氧化态更加稳定。已知的氧化物共有三种:一氧化铕(EuO)、三氧化二铕(Eu2O3)及混合价态氧化物Eu3O4,其同时含有铕(II)和铕(III)。其他的氧族元素化合物包括一硫化铕(EuS)、一硒化铕(EuSe)和一碲化铕(EuTe),三者均为黑色固体。三氧化二铕在高温下分解,经过硫化形成一硫化铕:[33]
铕的主要氮化物为一氮化铕(EuN)。
虽然铕存在于大部分稀有元素矿物之中,但由于分离过程的困难,所以直到19世纪末该元素才被分离出来。威廉·克鲁克斯在1885年对稀有元素的萤光光谱进行过分析,其中的一些“异常”谱线后来发现来自于铕元素。[34]
保罗·埃米尔·勒科克·德布瓦博德兰于1890年首次发现铕元素。他在钐钆浓缩物的分馏提取物中,观测到了既不属于钐,又不属于钆的谱线。然而,一般的说法是法国化学家尤金·德马塞发现了铕。他在1896年怀疑新发现的钐样本中有一种未知元素的污染物,并在1901年成功将其分离出来。他依据欧洲的名称“Europe”将此元素命名为“Europium”。[35][36]
1960年代初,人们发现了掺铕正钒酸钇红色磷光体。但在彩色电视机工业即将革新之时,独居石加工厂却无法维持足够的铕元素供给,[37]因为独居石的铕含量一般只在0.05%左右。当时莫利矿业位于加州山口的氟碳铈矿藏即将开启运作,当地的稀土矿含有异常高的0.1%铕含量,所以能够支撑这一工业。在铕磷光体被发现之前,彩色电视机的红色磷光体很弱,以致其他颜色的磷光体须要抑制才能保持颜色的平衡。铕磷光体能产生明亮的红光,因此不再须要调低别的颜色,彩色电视机的亮度也可以大大提高。[37]自此铕就一直用于电视机和电脑荧屏的生产中。加州山口稀土矿场之后面临中国白云鄂博铁矿的竞争,后者能产出铕含量为0.2%的矿石。
弗兰克·斯佩丁(Frank Spedding)对发展离子交换技术所作出的贡献在1950年代中革新了稀土工业。他曾自述[38]在1930年代在做有关稀土元素的演讲时,一位老人说要向他献上几磅重的氧化铕。当时这算作是极大量的铕,所以斯佩丁并没有认真对待。但不久后他确实收到了内含几磅氧化铕的邮件。这位老人正是发展了氧化还原铕纯化方法的赫伯特·纽比·麦科伊(Herbert Newby McCoy)。[27][39]

铕的商业用途非常有限。几乎所有应用都用到铕在+2或+3氧化态下的磷光特性。
在激光器和其他光电装置中,铕可以作玻璃的掺杂剂。三氧化二铕是一种常用的红色磷光体,用于CRT电视机和萤光灯中。它也是钇基磷光体的激活剂。[40][41]彩色电视机屏含有0.5至1克铕元素。[42]三价铕磷光体能给出红光,但二价铕的萤光颜色则取决于主体晶格,一般靠近蓝色。两种铕磷光体(红、蓝)加上黄绿色的铽磷光体,可产生“白”光。通过调节不同磷光体的比例,可以产生不同色温的白光。这种萤光系统一般应用在螺旋型萤光灯泡中。一些电视机和电脑荧屏也同样使用这种系统作为其三个原色。[40]萤光玻璃的生产也用到了铕。除掺铜硫化锌之外,另一种持续发光的较常见磷光体就是掺铕氯酸锶。[43]铕的萤光性质还能用在新药研发筛选过程中,以追踪生物分子的相互作用。欧罗纸币的防伪磷光体也含有铕。[44][45]
铕配合物,如Eu(fod)3,可以用作核磁共振光谱法的位移试剂,但这项应用已近乎被平价超导磁铁所淘汰。手性位移试剂(如Eu(hfc)3)今天仍被用于测量对映异构体纯度。[46][47][48][49][50]
没有明确证据显示铕的毒性比其他的重金属高。氯化铕的急性腹腔注射半数致死量(LD50)为550 mg/kg,急性口服LD50为5000 mg/kg。硝酸铕的腹腔注射LD50为320 mg/kg,口服LD50超过5000 mg/kg。[51][52]
粉状的铕金属有自燃或爆炸的危险。[53]
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 2.0 2.1 2.2 Holleman, A. F.; Wiberg, E. "Inorganic Chemistry" Academic Press: San Diego, 2001. ISBN 978-0-12-352651-9.
- ^ Johansson, Börje; Rosengren, Anders. Generalized phase diagram for the rare-earth elements: Calculations and correlations of bulk properties. Physical Review B. 1975, 11 (8): 2836–2857. Bibcode:1975PhRvB..11.2836J. doi:10.1103/PhysRevB.11.2836.
- ^ Debessai, M.; Matsuoka, T.; Hamlin, J.; Schilling, J.; Shimizu, K. Pressure-Induced Superconducting State of Europium Metal at Low Temperatures. Phys. Rev. Lett. 2009, 102 (19): 197002. Bibcode:2009PhRvL.102s7002D. PMID 19518988. doi:10.1103/PhysRevLett.102.197002.
- ^ Rare-Earth Metal Long Term Air Exposure Test. [2009-08-08]. (原始内容存档于2019-01-30).
- ^ Chemical reactions of Europium. Webelements. [2009-06-06]. (原始内容存档于2009-05-01).
- ^ Cooley, Robert A.; Yost, Don M.; Stone, Hosmer W. Inorganic Syntheses. Inorganic Syntheses 2: 69–73. 1946. ISBN 978-0-470-13233-3. doi:10.1002/9780470132333.ch19.
|chapter=被忽略 (帮助) - ^ Belli, P.; et al. Search for α decay of natural europium. Nuclear Physics A. 2007, 789: 15–29. Bibcode:2007NuPhA.789...15B. doi:10.1016/j.nuclphysa.2007.03.001.
- ^ 9.0 9.1 Nucleonica. Nucleonica: Universal Nuclide Chart. Nucleonica: Universal Nuclide Chart. Nucleonica. 2007–2011 [2011-07-22]. (原始内容存档于2017-02-19).
- ^ Tables of Nuclear Data (页面存档备份,存于互联网档案馆), Japan Atomic Energy Agency
- ^ Oh, S.Y.; Chang, J.; Mughabghab, S. Neutron cross section evaluations of fission products below the fast energy region. 2000. doi:10.2172/759039.
- ^ Inghram, Mark; Hayden, Richard; Hess, David. Activities Induced by Pile Neutron Bombardment of Samarium. Physical Review. 1947, 71 (9): 643–643. Bibcode:1947PhRv...71..643I. doi:10.1103/PhysRev.71.643.
- ^ Hayden, Richard; Reynolds, John; Inghram, Mark. Reactions Induced by Slow Neutron Irradiation of Europium. Physical Review. 1949, 75 (10): 1500–1507. Bibcode:1949PhRv...75.1500H. doi:10.1103/PhysRev.75.1500.
- ^ Meinke, W. W.; Anderson, R. E. Activation Analysis of Several Rare Earth Elements. Analytical Chemistry. 1954, 26 (5): 907–909. doi:10.1021/ac60089a030.
- ^ Farrar, H; Tomlinson, R.H. Cumulative yields of the heavy fragments in U235 thermal neutron fission. Nuclear Physics. 1962, 34 (2): 367–381. Bibcode:1962NucPh..34..367F. doi:10.1016/0029-5582(62)90227-4.
- ^ Inghram, Mark; Hayden, Richard; Hess, David. U235 Fission Yields in the Rare Earth Region. Physical Review. 1950, 79 (2): 271–274. Bibcode:1950PhRv...79..271I. doi:10.1103/PhysRev.79.271.
- ^ Fajans, Kasimir; Voigt, Adolf. A Note on the Radiochemistry of Europium. Physical Review. 1941, 60 (7): 533–534. Bibcode:1941PhRv...60..533F. doi:10.1103/PhysRev.60.533.2.
- ^ 18.0 18.1 18.2 Maestro, Patrick. Lanthanides. Kirk-Othmer Encyclopedia of Chemical Technology 14. : 1096–1120. ISBN 978-0-471-23896-6. doi:10.1002/0471238961.120114201901021.
- ^ Sinha, Shyama P.; Scientific Affairs Division, North Atlantic Treaty Organization. The Europium anomaly. Systematics and the properties of the lanthanides. 1983: 550–553 [2014-06-04]. ISBN 978-90-277-1613-2. (原始内容存档于2014-07-09).
- ^ Bill, H.; Calas, G. Color centers, associated rare-earth ions and the origin of coloration in natural fluorites. Physics and Chemistry of Minerals. 1978, 3 (2): 117–131. Bibcode:1978PCM.....3..117B. doi:10.1007/BF00308116.
- ^ Valeur, Bernard; Berberan-Santos, Mário N. A Brief History of Fluorescence and Phosphorescence before the Emergence of Quantum Theory. Journal of Chemical Education. 2011, 88 (6): 731–738. Bibcode:2011JChEd..88..731V. doi:10.1021/ed100182h.
- ^ Mariano, A; King, P. Europium-activated cathodoluminescence in minerals. Geochimica et Cosmochimica Acta. 1975, 39 (5): 649–660. Bibcode:1975GeCoA..39..649M. doi:10.1016/0016-7037(75)90008-3.
- ^ Sidike, Aierken; Kusachi, I.; Yamashita, N. Natural fluorite emitting yellow fluorescence under UV light. Physics and Chemistry of Minerals. 2003, 30 (8): 478–485. Bibcode:2003PCM....30..478S. doi:10.1007/s00269-003-0341-3.
- ^ Przibram, K. Fluorescence of Fluorite and the Bivalent Europium Ion. Nature. 1935, 135 (3403): 100–100. Bibcode:1935Natur.135..100P. doi:10.1038/135100a0.
- ^ 25.0 25.1 Gupta, C. K.; Krishnamurthy, N. Extractive metallurgy of rare earths. International Materials Reviews. 1992, 37: 197–248 [2014-06-04]. (原始内容存档于2012-10-24).
- ^ Morais, C; Ciminelli, V.S.T. Recovery of europium by chemical reduction of a commercial solution of europium and gadolinium chlorides. Hydrometallurgy. 2001, 60 (3): 247–253. doi:10.1016/S0304-386X(01)00156-6.
- ^ 27.0 27.1 McCoy, Herbert N. Journal of the American Chemical Society. 1936, 58 (9): 1577–1580. doi:10.1021/ja01300a020. 缺少或
|title=为空 (帮助) - ^ Neikov, Oleg D.; Naboychenko, Stanislav; Gopienko, Victor G.; Frishberg, Irina V. Handbook of Non-Ferrous Metal Powders: Technologies and Applications. 2009-01-15: 505 [2014-06-04]. ISBN 978-1-85617-422-0. (原始内容存档于2014-07-09).
- ^ Lawrence J. Drewa, Meng Qingrunb and Sun Weijun. The Bayan Obo iron-rare-earth-niobium deposits, Inner Mongolia, China. Lithos. 1990, 26 (1–2): 43–65. Bibcode:1990Litho..26...43D. doi:10.1016/0024-4937(90)90040-8.
- ^ Xue-Ming Yang, Michael J. Le Bas. Chemical compositions of carbonate minerals from Bayan Obo, Inner Mongolia, China: implications for petrogenesis. Lithos. 2004, 72 (1–2): 97–116. Bibcode:2004Litho..72...97Y. doi:10.1016/j.lithos.2003.09.002.
- ^ Chengyu Wu. Bayan Obo Controversy: Carbonatites versus Iron Oxide-Cu-Au-(REE-U). Resource Geology. 2007, 58 (4): 348 [2014-06-04]. doi:10.1111/j.1751-3928.2008.00069.x. (原始内容存档于2012-12-17).
- ^ Hedrick, J; Sinha, S; Kosynkin, V. Loparite, a rare-earth ore (Ce, Na, Sr, Ca)(Ti, Nb, Ta, Fe+3)O3. Journal of Alloys and Compounds. 1997, 250: 467–470. doi:10.1016/S0925-8388(96)02824-1.
- ^ Archer, R. D.; Mitchell, W. N.; Mazelsky, R. Inorganic Syntheses. Inorganic Syntheses 10: 77–79. 1967. ISBN 978-0-470-13241-8. doi:10.1002/9780470132418.ch15.
|chapter=被忽略 (帮助) - ^ Crookes, W. On the Phosphorescent Spectra of S δ and Europium. Proceedings of the Royal Society of London. 1905, 76 (511): 411–414. Bibcode:1905RSPSA..76..411C. JSTOR 92772. doi:10.1098/rspa.1905.0043.
- ^ Demarçay, Eugène-Anatole. Sur un nouvel élément l'europium. Comptes rendus. 1901, 132: 1484–1486 [2014-06-04]. (原始内容存档于2013-12-24).
- ^ Weeks, Mary Elvira. The discovery of the elements. XVI. The rare earth elements. Journal of Chemical Education. 1932, 9 (10): 1751. Bibcode:1932JChEd...9.1751W. doi:10.1021/ed009p1751.
- ^ 37.0 37.1 Srivastava, A. M.; Ronda, C. R. Phosphors (PDF). The Electrochemical Society Interface. 2003: 48–51 [2014-06-04]. (原始内容存档 (PDF)于2014-06-30).
- ^ Spedding, Frank H. Large-scale separation of rare-earth salts and the preparation of the pure metals. Discussions of the Faraday Society. 1949, 7: 214. doi:10.1039/DF9490700214.
- ^ Corbett, John D. Frank Harold Spedding. Biographical Memoirs National Academy of Sciences (National Academy of Sciences). 1986, 80 (5): 106 [2020-09-20]. Bibcode:1986PhT....39e.106H. doi:10.1063/1.2815016. (原始内容存档于2012-04-05).
- ^ 40.0 40.1 Caro, Paul. Rare earths in luminescence. Rare earths. 1998-06-01: 323–325 [2014-06-04]. ISBN 978-84-89784-33-8. (原始内容存档于2014-05-03).
- ^ Bamfield, Peter. Inorganic Phosphors. Chromic phenomena: technological applications of colour chemistry. 2001: 159–171 [2014-06-04]. ISBN 978-0-85404-474-0. (原始内容存档于2014-05-03).
- ^ Gupta, C. K.; Krishnamurthy, N. Extractive metallurgy of rare earths. International Materials Reviews. 1992, 37: 197–248 [2014-06-04]. (原始内容存档于2012-10-24).
- ^ Lakshmanan, Arunachalam. Persistent Afterglow Phosphors. Luminescence and Display Phosphors: Phenomena and Applications. 2008 [2014-06-04]. ISBN 978-1-60456-018-3. (原始内容存档于2014-07-06).
- ^ Europium and the Euro. [2009-06-06]. (原始内容存档于2009-08-04).
- ^ Cotton, Simon. Euro banknotes. Lanthanide and actinide chemistry. 2006: 77 [2014-06-04]. ISBN 978-0-470-01006-8. (原始内容存档于2014-05-03).
- ^ Richards, Stephen; Hollerton, John. Essential Practical NMR for Organic Chemistry. 2011-02-15 [2014-06-04]. ISBN 978-0-470-71092-0. (原始内容存档于2014-06-06).
- ^ Pavia, Donald L; Lampman, Gary M. Introduction to spectroscopy. 2009 [2014-06-04]. ISBN 978-0-495-11478-9. (原始内容存档于2014-06-07).
- ^ Wenzel, Thomas J. Discrimination of chiral compounds using NMR spectroscopy. 2007 [2014-06-04]. ISBN 978-0-471-76352-9. (原始内容存档于2014-06-06).
- ^ Cotton, Simon. Lanthanide and actinide chemistry. 2006 [2014-06-04]. ISBN 978-0-470-01006-8. (原始内容存档于2014-05-03).
- ^ Gschneidner, Karl A; Bünzli, Jean-Claude; Pecharsky, Vitalij K. Handbook on the Physics and Chemistry of Rare Earths. 2005-09-26 [2014-06-04]. ISBN 978-0-444-52028-9. (原始内容存档于2014-06-07).
- ^ Haley, Thomas J.; Komesu, N.; Colvin, G.; Koste, L.; Upham, H. C. Pharmacology and toxicology of europium chloride. Journal of Pharmaceutical Sciences. 1965, 54 (4): 643–5. PMID 5842357. doi:10.1002/jps.2600540435.
- ^ Bruce, D; Hietbrink, Bernard E.; Dubois, Kenneth P. The acute mammalian toxicity of rare earth nitrates and oxides*1. Toxicology and Applied Pharmacology. 1963, 5 (6): 750. doi:10.1016/0041-008X(63)90067-X.
- ^ Lenntech BV. Europium (Eu) - Chemical properties, Health and Environmental effects. Lenntech Periodic Table. Lenntech BV. [July 20, 2011]. (原始内容存档于2014-06-05).
| 维基共享资源中相关的多媒体资源:铕 |
| 查看维基词典中的词条“europium”。 |
- 元素铕在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 铕(英文)
- 元素铕在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素铕在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 铕(英文)

