钬(拼音:huǒ,注音:ㄏㄨㄛˇ,粤拼:fo2;英语:Holmium;旧译錵),是一种化学元素,其化学符号为Ho,原子序数为67,原子量为164.93033 u,属于镧系元素,也是稀土元素之一。钬在常温常压下是固体。 1878年为索里特(J.L.Soret)发现;1879年又被克利夫(P.T.Cleve)发现。第一电离能6.02电子伏特。有金属光泽。与水能缓慢起作用,溶于稀酸。盐类是黄色。氧化物Ho2O2为淡绿色。溶于矿物酸而产生三价离子黄色盐。由氟化钬HoF3·2H2O用钙还原而制得。它和镝一样,是一种能够吸收核分裂所产生的中子的金属。在核子反应炉中,一方面不断燃烧,一方面控制连锁反应的速度。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钬(holmium)·Ho·67 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 镧系元素 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 不适用 ·6·f | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 164.93033(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [Xe] 4f11 6s2 2, 8, 18, 29, 8, 2 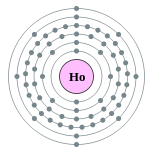 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 马克·德拉方丹(1878年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 8.79 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 8.34 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1734 K,1461 °C,2662 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2873 K,2600 °C,4712 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 17.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 251 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 27.15 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 0,[1] +1, +2, +3 (碱性的氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.23(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:581.0 kJ·mol−1 第二:1140 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 176 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 192±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | poly: 814 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 16.2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | poly: 11.2 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)2760 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 64.8 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 26.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 40.2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.231 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 410–600 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 500–1250 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-60-0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钬的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
物理性质

钬是一种相对柔软且具有延展性的元素,在标准情况下,在干燥空气中具有相当的耐腐蚀性和稳定性。但是,在较高温度的湿气下,钬会迅速氧化,形成黄色的氧化钬。纯钬具有金属般明亮的银色光泽。
氧化钬根据光线的不同,颜色有相当大的变化。在阳光下,它是黄棕色的。在三色光下,它是火红色的,几乎不能和氧化铒区别。这些颜色变化与钬的锐利吸收带有关,可用作磷光体。[3]
钬是所有天然的化学元素中,磁矩最高的, (10.6 µB) 并具有其他不寻常的磁性。当和钇混合时,会形成有极强磁性的混合物。[4]钬在标准情况下是顺磁性的,但在19 K的温度以下是铁磁性的。[5]
化学性质
钬可以在空气中燃烧,发出耀眼白光,产生氧化钬:
钬能与水反应,与冷水反应较缓慢,而与热水反应较快速:
钬也能与卤素反应:
钬较容易溶解于稀硫酸中,生成Ho3+离子,以[Ho(OH2)9]3+配合物出现:[6]
钬最常见的氧化态是+3。钬溶液中的Ho3+被九个水分子环绕。钬能溶解于酸性溶液。[7]
同位素
钬共有35个同位素,其中只有165Ho是稳定的。其余的皆为人工合成的放射性同位素,其中最稳定的是钬-163,半衰期 4570 年。其它基态的钬同位素的半衰期都不超过 2 天,大部分少于 3小时。不过,同核异构体 166m1Ho 的半衰期很长,约为 1200 年,这是由于其高自旋而成的。
钬是由Jacques-Louis Soret和马克·德拉方丹在 1878 年发现的。他们注意到了当时未知的元素(他们称之为元素 X)异常的光谱吸收带。[8][9]
Per Teodor Cleve在研究铒土(氧化铒)时独立发现了该元素,并且是第一个将其分离出来的人。[10][11][12][13][14] 使用Carl Gustaf Mosander 开发的方法,Cleve 首先从 erbia 中去除了所有当时已知的杂质。他得到了两种新的物质,一个是棕色的,另一个是绿色的。他将棕色物质命名为 holmia(以克利夫家乡斯德哥尔摩的拉丁名称命名)和绿色物质 thulia。 后来发现holmia 就是氧化钬,而thulia 就是氧化铥。 [15]
在亨利·莫塞莱关于原子序数的经典论文[16] 中,钬的原子序为 66。显然,他研究的钬样本非常不纯,主要是由旁边(未被列入)的镝影响的。他会看到这两种元素的 X 射线发射线,但他假设这些都是钬,而不是杂质镝。

就像其他的稀土金属一样,钬不会以单质形式出现。钬一般存在于硅铍钇矿、独居石等稀土矿物中。尚未发现以钬为主的矿物。[17]钬的主要产地在中国、美国、巴西、印度、斯里兰卡和澳洲,储量估计为 400,000 吨。[15]
钬组成了地壳的 1.4 ppm(质量计),为第56常见的元素。钬组成了土壤的 1 ppm,海水的 0.4 ppt,几乎不存在于地球大气中。钬是镧系元素中相对罕见的。[18]依质量计,它组成了宇宙的 500 ppt。[19]
钬是通过离子交换从独居石(含0.05% 钬)中提取的,但仍难以与其他稀土分离。它是通过用金属钙还原其无水氯化物或氟化物而分离出来的。[20] 钬在稀土金属中相对便宜,价格为 1000 USD/kg.[21]

钬在任何元素中具有最高的磁矩,可用于产生最强的人工磁场。[22]由于它可以吸收核裂变产生的中子,它也被用作可燃毒物来调节核反应堆。[15]
掺钬的钇铁石榴石 (YIG)和氟化钇锂 (YLF) 应用于固态激光器中,而掺钬的钇铁石榴石也用于光学隔离器和微波器材(例如YIG球体)。钬激光器的发射波长为 2.1 微米。[23] 它们用于医疗、牙科和光纤。[4]
钬是用于立方氧化锆和玻璃的着色剂之一,可提供黄色或红色着色。[24] 含有氧化钬或其溶液(溶剂通常是高氯酸)的玻璃在 200–900 nm 的光谱范围内有尖锐的光吸收峰。因此它们被用作单色器的校准标准[25] ,可以商购。[26]
半衰期较长的放射性同位素 166m1Ho 用于校准伽马射线光谱仪。[27]
在2017年3月,IBM宣布他们已经开发出一种技术,可以在氧化镁上的单个钬原子上存储一位元数据。[28]
凭借足够的量子和经典控制技术,钬可能是制造量子计算机的理想物质。[29]
钬在人体中没有用处,但钬盐能够促进新陈代谢。[20]人体通常每年消耗大约一毫克钬。植物不容易从土壤中吸收钬。一些蔬菜的钬含量已经过测量,达到100 ppt。[7]
毒性
如果吸入、食用或注射大量的钬盐会对人体造成严重损害。钬的长期影响不明。钬的急性毒性较低。[30]
- Category:钬化合物
- ^ Yttrium and all lanthanides except Ce and Pm have been observed in the oxidation state 0 in bis(1,3,5-tri-t-butylbenzene) complexes, see Cloke, F. Geoffrey N. Zero Oxidation State Compounds of Scandium, Yttrium, and the Lanthanides. Chem. Soc. Rev. 1993, 22: 17–24. doi:10.1039/CS9932200017. and Arnold, Polly L.; Petrukhina, Marina A.; Bochenkov, Vladimir E.; Shabatina, Tatyana I.; Zagorskii, Vyacheslav V.; Cloke. Arene complexation of Sm, Eu, Tm and Yb atoms: a variable temperature spectroscopic investigation. Journal of Organometallic Chemistry. 2003-12-15, 688 (1–2): 49–55. doi:10.1016/j.jorganchem.2003.08.028.
- ^ Standard Atomic Weights 2013 (页面存档备份,存于互联网档案馆). Commission on Isotopic Abundances and Atomic Weights
- ^ Yiguo Su; Li, Guangshe; Chen, Xiaobo; Liu, Junjie; Li, Liping. Hydrothermal Synthesis of GdVO4:Ho3+ Nanorods with a Novel White-light Emission. Chemistry Letters. 2008, 37 (7): 762–763. doi:10.1246/cl.2008.762.
- ^ 4.0 4.1 C. K. Gupta; Nagaiyar Krishnamurthy. Extractive metallurgy of rare earths. CRC Press. 2004: 32 [2021-06-06]. ISBN 0-415-33340-7. (原始内容存档于2022-02-06).
- ^ Jiles, David. Introduction to magnetism and magnetic materials. CRC Press. 1998: 228 [2021-06-06]. ISBN 0-412-79860-3. (原始内容存档于2020-11-12).
- ^ Chemical reactions of Holmium. Webelements. [2009-06-06]. (原始内容存档于2021-01-24).
- ^ 7.0 7.1 Emsley, John. Nature's Building Blocks. 2011.
- ^ Jacques-Louis Soret. Sur les spectres d'absorption ultra-violets des terres de la gadolinite. Comptes rendus de l'Académie des sciences. 1878, 87: 1062 [2021-06-06]. (原始内容存档于2014-08-24).
- ^ Jacques-Louis Soret. Sur le spectre des terres faisant partie du groupe de l'yttria. Comptes rendus de l'Académie des sciences. 1879, 89: 521 [2021-06-06]. (原始内容存档于2021-04-21).
- ^ Holmium. Royal Society of Chemistry. 2020 [4 January 2020]. (原始内容存档于2022-01-18).
- ^ Marshall, James L. Marshall; Marshall, Virginia R. Marshall. Rediscovery of the elements: The Rare Earths–The Confusing Years (PDF). The Hexagon. 2015: 72–77 [30 December 2019]. (原始内容存档 (PDF)于2021-10-11).
- ^ Weeks, Mary Elvira. The discovery of the elements 6th. Easton, PA: Journal of Chemical Education. 1956.
- ^ Per Teodor Cleve. Sur deux nouveaux éléments dans l'erbine. Comptes rendus de l'Académie des sciences. 1879, 89: 478–480 [2021-06-06]. (原始内容存档于2021-06-25). Cleve named holmium on p. 480: "Je propose pour ce métal le nom de holmium, Ho, dérivé du nom latinisé de Stockholm, dont les environs renferment tant de minéraux riches en yttria." (I propose for this metal the name of "holmium", Ho, [which is] derived from the Latin name for Stockholm, the environs of which contain so many minerals rich in yttrium.)
- ^ Per Teodor Cleve. Sur l'erbine. Comptes rendus de l'Académie des sciences. 1879, 89: 708 [2021-06-06]. (原始内容存档于2021-10-30).
- ^ 15.0 15.1 15.2 John Emsley. Nature's building blocks: an A-Z guide to the elements. US: Oxford University Press. 2001: 181–182 [2021-06-07]. ISBN 0-19-850341-5. (原始内容存档于2021-06-19).
- ^ Moseley, H.G.J. The high-frequency spectra of the elements. Philosophical Magazine. 6th series. 1913, 26: 1024–1034.
- ^ Hudson Institute of Mineralogy. Mindat.org. www.mindat.org. 1993–2018 [14 January 2018]. (原始内容存档于2011-04-22).
- ^ Emsley, John. Nature's Building Blocks. Oxford University Press. 2011.
- ^ Ltd, Mark Winter, University of Sheffield and WebElements. WebElements Periodic Table » Periodicity » Abundance in the universe » periodicity. www.webelements.com. [27 March 2018]. (原始内容存档于2017-09-29).
- ^ 20.0 20.1 C. R. Hammond. The Elements, in Handbook of Chemistry and Physics 81st. CRC press. 2000. ISBN 0-8493-0481-4.
- ^ James B. Hedrick. Rare-Earth Metals (PDF). USGS. [2009-06-06]. (原始内容存档 (PDF)于2011-01-10).
- ^ R. W. Hoard; S. C. Mance; R. L. Leber; E. N. Dalder; M. R. Chaplin; K. Blair; et al. Field enhancement of a 12.5-T magnet using holmium poles. IEEE Transactions on Magnetics. 1985, 21 (2): 448–450 [2021-06-06]. Bibcode:1985ITM....21..448H. doi:10.1109/tmag.1985.1063692. (原始内容存档于2021-06-06).
- ^ Wollin, T. A.; Denstedt, J. D. The holmium laser in urology. Journal of Clinical Laser Medicine & Surgery. Feb 1998, 16 (1): 13–20. PMID 9728125. doi:10.1089/clm.1998.16.13.
- ^ Cubic zirconia. [2009-06-06]. (原始内容存档于2009-04-24).
- ^ R. P. MacDonald. Uses for a Holmium Oxide Filter in Spectrophotometry (PDF). Clinical Chemistry. 1964, 10 (12): 1117–20 [2021-06-06]. PMID 14240747. (原始内容存档 (PDF)于2011-12-05).
- ^ Holmium Glass Filter for Spectrophotometer Calibration. [2009-06-06]. (原始内容存档于2010-03-14).
- ^ Ming-Chen Yuan; Jeng-Hung Lee & Wen-Song Hwang. The absolute counting of 166mHo, 58Co and 88Y. Applied Radiation and Isotopes. 2002, 56 (1–2): 429–434. PMID 11839051. doi:10.1016/S0969-8043(01)00226-3.
- ^ Coldeway, Devin. Storing data in a single atom proved possible by IBM researchers. TechCrunch. March 9, 2017 [2017-03-10]. (原始内容存档于2021-11-07).
- ^ Forrester, Patrick Robert; Patthey, François; Fernandes, Edgar; Sblendorio, Dante Phillipe; Brune, Harald; Natterer, Fabian Donat. Quantum state manipulation of single atom magnets using the hyperfine interaction. Physical Review B. 2019-11-19, 100 (18): 180405. Bibcode:2019PhRvB.100r0405F. ISSN 2469-9950. doi:10.1103/PhysRevB.100.180405
 (英语).
(英语).
- ^ "Holmium" (页面存档备份,存于互联网档案馆) in Periodic Table v2.5. University of Coimbra, Portugal
- 元素钬在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钬(英文)
- 元素钬在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钬在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钬(英文)

