| 此条目可参照英语维基百科相应条目来扩充。 (2020年9月30日) |
锰(拼音:měnɡ,注音:ㄇㄥˇ,粤拼:maang5;英语:Manganese),是一种化学元素,其化学符号为Mn,原子序数为25,原子量为54.938045 u。锰不会以元素的形式存在于自然界中,它经常以与铁所形成的矿物形式被发现。锰是重要工业用合金所使用的过渡金属,特别是用于不锈钢的材料。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
金属:银色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 锰(Manganese)·Mn·25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 7 ·4·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 54.938045(5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氩] 3d5 4s2 2, 8, 13, 2 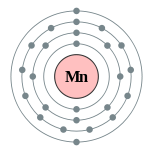 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 卡尔·威廉·舍勒(1774年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 约翰·戈特利布·甘恩(1774年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 7.21 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 5.95 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1519 K,1246 °C,2275 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2334 K,2061 °C,3742 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 12.91 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 221 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 26.32 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 7, 6, 5, 4, 3, 2, 1, -1, -2, -3 (两性 ) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.55(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:717.3 kJ·mol−1 第二:1509.0 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 127 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 139±5(低自旋),161±8(高自旋) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 体心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁化率 | (α) +529.0·10−6 cm3/mol (293 K)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)1.44 µΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 7.81 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)21.7 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)5150 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 198 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 120 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 196 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7439-96-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:锰的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
历史上,锰的名称来自生产软锰矿(pyrolusiteand)以及其他黑色矿物的希腊马格尼西亚(Magnesia in Greece)地区,这个地区的名称来自其生产镁矿(magnesium)以及磁铁矿(iron ore magnetite)。到了大约18世纪中叶时,瑞典裔德国科学家卡尔·威廉·舍勒已经可以利用软锰矿制造氯气。这时,舍勒和其他人已经知道软锰矿(这时还不知道此为二氧化锰)含有其他未被发现的元素,但是他们没办法分离出这个新元素。直到1774年,约翰·戈特利布·甘恩是第一个可以从具有不纯的金属样品分离出锰元素的人,他成功的利用碳还原此氧化物(含二氧化锰的矿物)得到了锰。
锰磷酸化可以用来防止钢铁生锈或者腐蚀。锰离子可以用于各种颜色的工业染剂,离子的颜色决定于其不同的其氧化数(oxidation state)。碱金属过锰酸盐或者碱土族过锰酸盐是很强的氧化剂。二氧化锰可以用在碳锌电池或者碱金属电池中的阴极材料(电子接受者)。
生物上,锰二价离子为具有很多种功能的多样性酵素的辅因子(cofactor)具有锰元素的酵素(manganese enzymes) 特别为必须处理氧元素的生物体内去除造成毒性的过氧化自由基的要素。锰同样作用于光合作用植物中氧元素进化错合物(oxygen-evolving complex)虽然锰是生物体内的必须稀有矿物质,然而,当生物体内的锰浓度过高时也可能造成神经毒性。特别是经过呼吸作用,将造成锰中毒(manganism),这是一种在哺乳动物中可能会发生的不可逆神经伤害的情况。
物理性质
锰是银灰色金属,性坚而脆、难熔、易被氧化。锰金属及其离子皆为顺磁物质。锰在空气中会缓慢失去光泽,在含氧的水中会氧化(像铁生锈)。
化合物
锰的氧化数有-3至+7,其中以氧化数+2、+4和+7的化合物最重要。
Mn2+最稳定,呈粉红色,不容易被氧化,也不容易被还原。硫酸锰(MnSO4)、氯化锰(MnCl2)等属于这氧化数。MnO−4和MnO2有强氧化性。
氧化数+7的高锰酸盐(MnO−4)呈紫色,多数是强氧化剂,如高锰酸钾、高锰酸钠、高锰酸钡等。
在酸性溶液中,Mn3+和MnO2−4均易发生歧化反应:
在碱性溶液中,Mn(OH)2不稳定,易被空气中的氧气氧化为MnO2;MnO2−4也能发生歧化反应,但反应不如在酸性溶液中进行得完全。
锰的氧化物及其水合物酸碱性的递变规律,是过渡金属中最典型的:随锰的氧化数的升高,酸性逐渐增强。[2]
| 锰的氧化物 | 锰的氢氧化物 | 酸碱性 |
|---|---|---|
| MnO(绿) | Mn(OH)2(白) | 碱性 |
| Mn2O3(棕) | Mn(OH)3(棕) | 弱碱性 |
| MnO2(黑) | Mn(OH)4(棕黑) | 两性 |
| — | 不存在(绿) | 酸性 |
| Mn2O7(绿) | HMnO4(紫红) | 强酸性 |
| 锰的氧化数[3] | |
|---|---|
| 0 | Mn2(CO)10 |
| +1 | MnC5H4CH3(CO)3 |
| +2 | MnCl2, MnCO3, MnO |
| +3 | MnF3, Mn(OAc)3, Mn2O3 |
| +4 | MnO2 |
| +5 | K3MnO4 |
| +6 | K2MnO4 |
| +7 | KMnO4, Mn2O7 |
同位素
锰在正常状况下只存在一个稳定同位素——55Mn,此外有二十四个放射性同位素依照原子量从44到69。而具放射性中最稳定的包含半衰期分别为370万年、312.3天、5.591天的53Mn、54Mn和52Mn,剩余的半衰期皆少于三小时,而其中大部分都少于一分钟。在最大量且稳定的锰同位素55Mn,主要的衰变方式为电子捕获,而在其后者主要为β衰变。
铁系元素被认为是超新星爆炸前不久合成巨大恒星的物质,而锰正是其一。铁被宇宙射线冲击会产生53Mn,而53Mn经过半衰期370万年会衰变成53Cr,因为其相对较短的半衰期,所以53Mn较为稀有。锰同位素的含量与铬同位素的含量有关,因此已经在同位素地质学及放射性估年法上有所应用。锰和铬的同位素比强化了26Al和107Pd对太阳系早期历史的证明。许多陨石中53Cr/52Cr和Mn/Cr间比例的差异显示出最初53Mn/55Mn的比例,因此指出相异行星中锰和铬同位素的组成,必定源自于不同的53Cr衰变过程。所以53Mn提供了太阳系合并前核合成过程近一步的证明。
在历史上,锰的名字(manganese)源自于软锰矿(pyrolusite)及其他来自希腊马格尼西亚州(Magnesia in Greece)的黑色矿物。
18世纪后半瑞典化学家舍勒(Carl Wilhelm Scheele)用软锰矿来生成氯气时,尚未知道是二氧化锰,只认为它是一种未知金属的氧化物,但Scheele并没能成功分离此金属。盖恩(Johan Gottlieb Gahn)1774年才利用碳把两个氧还原,成功的分离出锰。并将之命名为Manganese(锰),其拉丁语:magnes,意即“具磁性的”(但只有经过特殊处理的锰才会具有磁性),及元素符号Mn亦从之而来。人们早在1913年就已知锰是组成动物的重要元素之一,但直到1931年才经由动物实验得知和锰有关的症状。
锰在地壳含量约1000ppm(0.1%),居元素分布序列中的第12位。
锰会以软锰矿(MnO2)硬锰矿((Ba.H2O)2Mn5O10)和菱锰矿(MnCO3)等形式存在于自然界中。
对二氧化锰进行铝热反应可得到单质锰:
冶金工业中用以制造特种钢,在钢铁生产上用锰铁合金作为去硫剂和去氧剂。
此外锰也用作合金,电池等。二氧化锰(MnO2)用作催化剂和棕色颜料,高锰酸钾(KMnO4)用作氧化剂及消毒剂。
在不锈钢上用磷酸锰处理可以防锈及防蚀。工业上会使用不同氧化态的锰离子当作不同颜色的染料。含有碱金属或碱土族离子的过锰酸盐类是强氧化剂。在碳锌电池及碱性电池中,二氧化锰会被当作阴极使用。 在生物学中,锰离子可在多种的酵素中担任辅因子的角色。锰酵素对组织中超氧自由基的解毒,清除元素态氧原子非常重要。锰也会在光合植物的氧释放复合体中作用。虽然目前已知所有的有机生命体皆需要微量的锰,但其过量却会变成神经毒素。尤其过度吸入可以导致锰中毒,有时会造成不可逆的神经危害。
| 锰 | |
|---|---|
| 危险性 | |
| GHS危险性符号 none | |
| GHS提示词 | none |
| H-术语 | H401 |
| P-术语 | P273, P501[4] |
| NFPA 704 |
 0
0
0
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
和其他较普遍的金属相比,锰的毒性较低。[5]
锰是身体所必需的微量元素之一,可构成生物体中具重要生理功能之酶或辅酶,每日摄取约3-9mg。 具有以下之功能:
- 促进骨骼之发育以及生长
- 维持脑功能之正常运作
- 维持糖以及脂肪之正常代谢
- 维持细胞线粒体之完整
- 构成辅酶
由于线粒体需要锰,所以锰在线粒体多之组织含量较高,常见于骨骼、肝脏、肾脏、胰脏。然而过量锰之摄取依然会对生物有所影响(神经退行性疾病),常见于职业中,其发生原因为吸入含锰浓度高之锰烟及锰尘。
- ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ 《无机化学》第四版.高等教育出版社.P392. 13.4.2 锰的重要化合物
- ^ Schmidt, Max. VII. Nebengruppe. Anorganische Chemie II.. Wissenschaftsverlag. 1968: 100–109 (德语).
- ^ https://www.sigmaaldrich.com/MSDS/MSDS/DisplayMSDSPage.do?country=US&language=en&productNumber=266167&brand=ALDRICH&PageToGoToURL=https%3A%2F%2Fwww.sigmaaldrich.com%2Fcatalog%2Fproduct%2Faldrich%2F266167%3Flang%3Den
- ^ Hasan, Heather. Manganese. The Rosen Publishing Group. 2008: 31. ISBN 978-1-4042-1408-8.
- 元素锰在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 锰(英文)
- 元素锰在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素锰在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 锰(英文)

