钌(拼音:liǎo,注音:ㄌㄧㄠˇ,粤拼:liu5;英语:Ruthenium),是一种化学元素,其化学符号为Ru,原子序数为44,原子量为101.07 u,是在元素周期表中铂族的稀有过渡金属。钌与铂族的其他金属一样,对大多数其他化学物质都是惰性的。1844年,俄籍的波罗的海德意志科学家卡尔·恩斯特·克劳斯(Karl Ernst Claus)在喀山大学发现了该元素,随后以鲁塞尼亚(Ruthenia)做为此元素的拉丁名称,以此纪念这个被发现于俄罗斯的元素。一般而言,钌是在铂矿石的次要成分中被发现,年产量从2009年的约19吨[3]上升到2017年的约35.5吨[4]。生产出的钌大部分用于制造耐磨电接头和厚膜电阻,其次是用于铂合金和当成化学反应催化剂,另有一项新用途则是当作极紫外光光罩的覆盖层。钌通常和其他铂族金属同时蕴藏在乌拉尔山脉、北美洲和南美洲的矿石中。加拿大安大略省大萨德伯里的镍黄铁矿以及南非辉石岩矿床中,也发现了稀少但有商业重要性的存量[5]。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
金属:银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钌(Ruthenium)·Ru·44 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 8 ·5·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 101.07 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d7 5s1 2, 8, 18, 15, 1 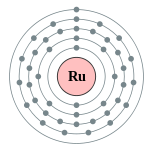 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | Karl Ernst Claus(1844年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | Karl Ernst Claus | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 12.45 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 10.65 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 2607 K,2334 °C,4233 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 4423 K,4150 °C,7502 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 38.59 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 591.6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 24.06 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 8, 7, 6, 4, 3, 2, 1,[1], -2 (弱酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.3(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:710.2 kJ·mol−1 第二:1620 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 134 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 146±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密排晶格 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (0 °C)7.1×10-8 Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 117 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)6.4 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)5970 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 447 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 173 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 220 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.30 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 2160 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-18-8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钌的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 此条目可参照英语维基百科相应条目来扩充。 |
物理性质
冷的时候,钌的延性较小,即使纯粹单晶也很容易弯曲。金属钌可用电弧或电子束熔化。钌通常加热至1500℃时才能加工成细丝或薄板。[6]
化学性质
钌有四种晶态,在标准情况下不会失去光泽,它加热到 800 °C(1,070 K)时氧化。钌溶于熔融碱,产生钌酸盐(RuO2−4)。钌不与酸反应(甚至是王水),但在高温下会被卤素攻击。[7]事实上,钌最容易被氧化剂侵蚀。[8]少量的钌可以增加铂和钯的硬度。钛的腐蚀抗性通过添加少量钌,会显着增加。[7]金属可以通过电镀和热分解镀上钌。已知钌钼合金在低于10.6 K的温度下具有超导性。[7]钌是唯一可以呈现+8氧化态的4d过渡金属。尽管如此,这个价态的稳定性也低于较重的同类物锇。与铁类似但与锇不同,钌可以在+2和+3的较低氧化态下形成水合阳离子。[9]
在钼的最大值之后,钌是第一个在4d过渡金属中的熔点、沸点以及原子化焓呈下降趋势的,因为4d壳层已超过一半,电子对金属键的形成贡献较小。(前一个元素锝有不寻常低的值,因为它的电子排布 [Kr]4d55s2 呈半充满结构,尽管它违背趋势的距离并没有像3d过渡金属中的锰这么远。)[10]与较轻的同类物铁不同,钌在室温下是顺磁性的,因为铁的居里点高于室温。[11]
一些常见的钌离子在酸性水溶液中的还原电位如下:[12]
| 0.455 V | Ru2+ + 2e− | ↔ Ru |
| 0.249 V | Ru3+ + e− | ↔ Ru2+ |
| 1.120 V | RuO2 + 4H+ + 2e− | ↔ Ru2+ + 2H2O |
| 1.563 V | RuO2−4 + 8H+ + 4e− | ↔ Ru2+ + 4H2O |
| 1.368 V | RuO−4 + 8H+ + 5e− | ↔ Ru2+ + 4H2O |
| 1.387 V | RuO4 + 4H+ + 4e− | ↔ RuO2 + 2H2O |
同位素
自然界中存在着7种钌的同位素。此外,目前共发现了34种钌的放射性同位素。在这些放射性同位素当中,较稳定的有106Ru(半衰期373.59天)、103Ru(半衰期39.26天)和97Ru(半衰期2.9天)。[13][14]剩下的钌同位素除了95Ru(半衰期1.643小时)和105Ru(半衰期4.44小时)以外,半衰期都少于五分钟。[13][14]
比最常见的钌同位素102Ru轻的钌同位素的主要衰变方式是电子捕获成锝,而更重的钌同位素则通过β衰变衰变成铑。[13][14]
106Ru是铀和钚的裂变产物。大气中检测到的高浓度106Ru与2017年据称在俄罗斯未申报的核事故有关。[15]
分布与含量
钌在地壳含量非常罕见,约100 ppt(0.1%),居元素分布序列中的第74位。[16][17]
人们每年大约开采30吨钌[18],而钌的世界储量估计为 5,000 吨。[16]开采的铂族金属 (PGM) 混合物的组成变化很大,这取决于地球化学地层。例如,南非开采的铂族金属平均含有 11% 的钌,而前苏联开采的铂族金属仅含有 2%(1992年)。[19][20]钌、锇和铱被认为是少数铂族金属。[11]
与其他铂族金属一样,钌是作为副产品从镍、铜以及铂金属矿石加工中获得的。在铜的电解精炼和镍过程中,银、金和铂族金属等贵金属沉淀为“阳极泥”,提取原材料。[21][22]根据原材料的组成,通过几种方法中的任何一种将金属转化为离子化溶质。一种代表性方法是与过氧化钠融合,然后溶解在王水,一种会放出氯与盐酸的混合物中。[23][24] 锇、钌、铑和铱不溶于王水并沉淀,将其他金属留在溶液中。通过用熔融的硫酸氢钠处理,可从残余物中分离出铑。含有钌、锇和铱的不溶残留物用氧化钠处理,其中铱不溶,产生溶解的钌和锇盐。在氧化成挥发性氧化物之后,RuO4 通过和氯化铵反应,产生 (NH4)3RuCl6 的沉淀与 OsO4 分离,或是用有机溶剂萃取挥发性的四氧化锇。[25] 氢气可用来还原六氯合钌(III)酸铵,产生粉末。[7][26]产物用氢气还原,产生粉末或海绵金属,可以用粉末冶金技术或氩弧焊进行处理。[7][27]
钌在氧化态 0 到 +8和 −2都有化合物。钌和锇的化合物有时类似。其中,钌的 +2、+3和 +4 氧化态是最常见的。钌化合物最普遍的前体是三氯化钌,一种红色固体,化学性质不明确,但在合成其它钌化合物的方面用途广泛。[26]
氧化物与硫属化物
钌可以被氧化成二氧化钌(RuO2,氧化态 +4),之后还可以被高碘酸钠氧化成黄色、挥发性的四氧化钌 RuO4,一种腐蚀性强的氧化剂,其结构和性质类似于四氧化锇。RuO4 主要用作从矿石和放射性废物中提纯钌的中间体。[28]
钌酸钾(K2RuO4,氧化态+6)和高钌酸钾(KRuO4,氧化态+7)都是已知的。[29]不像四氧化锇,四氧化钌较不稳定,氧化性强到足以在室温下氧化稀盐酸和像是乙醇的有机溶剂也容易在碱性水溶液中被还原成钌酸根(RuO2−4),它在超过 100 °C下分解成二氧化钌。不像铁但像锇,钌没有低价的 +2、+3 氧化态氧化物。[30]钌会形成二硫属化物,它们是以黄铁矿结构结晶的抗磁性半导体。[30] 二硫化钌(RuS2)以矿物laurite的形式在天然中存在。
类似铁,钌不容易形成氧阴离子,而是更喜欢与氢氧根离子配合,达到高配位数。四氧化钌可被又稀又冷的氢氧化钾还原成黑色的高钌酸钾 KRuO4,其中钌为 +7氧化态。高钌酸钾也可以由氯气氧化钌酸钾 K2RuO4而成。高钌酸根离子不稳定,会被水还原形成橙色的钌酸根。钌酸钾可以通过金属钌与熔融氢氧化钾和硝酸钾反应而成。[31]
一些混合氧化物也是已知的,例如 MIIRuIVO3、Na3RuVO4、Na2RuV2O7和 MII2LnIIIRuVO6。[31]
卤化物和卤氧化物
已知最高价的卤化钌是六氟化钌,一种熔点 54 °C的深棕色固体。它会剧烈水解,且容易分解成低价氟化钌的混合物,并放出氟气。五氟化钌是一种以四聚体存在的深绿色固体,也很容易水解,熔点 86.5 °C。黄色的四氟化钌可能也是聚合物结构,可以由碘还原五氟化钌而成。在所有二元钌混合物中,只有氧化物和氟化物能形成高氧化态。[32]
三氯化钌是一种著名的化合物,有黑色的α相和深棕色的β相,而三水合物是红色的。[33]在已知的三卤化物中,三氟化钌是深棕色的,超过 650 °C时会分解;三溴化钌是在 400 °C分解的深棕色固体,而三碘化钌是黑色的。[32]在二卤化物中,二氟化钌未知,二氯化钌是棕色的,二溴化钌是黑色的,而二碘化钌是蓝色的。[32]钌唯一已知的卤氧化物是浅绿色的四氟氧化钌 RuOF4。[33]
配位错合物与有机金属

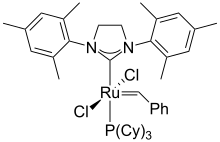
钌有很多配合物,例子有五氨配合物 [Ru(NH3)5L]n+ ,通常存在于 Ru(II) 和 Ru(III)。联吡啶和三联吡啶的衍生物很多,其中最著名的是冷发光的氯化三(双吡啶)合钌(II)。
钌可以形成很多有碳-钌键的化合物,例如用于烯烃复分解反应的格拉布催化剂。[34] 二茂钌的结构类似二茂铁,但表现出独特的氧化还原特性。五羰基钌是无色液体,在没有 CO 的情况下转化为深红色固体十二羰基三钌。三氯化钌和一氧化碳反应,产生很多衍生物如 RuHCl(CO)(PPh3)3 和Ru(CO)2(PPh3)3(Roper配合物)。把三氯化钌的醇溶液和三苯基膦一起加热,可以得到二氯化三(三苯基膦)钌 (RuCl2(PPh3)3),之后还可以转化成氢配合物氢氯化三(三苯基膦)钌(II) (RuHCl(PPh3)3)。[26]
虽然,含有所有六种铂族金属的天然铂合金,被前哥伦布时期美洲人长期使用,从16世纪中叶起,被欧洲化学家称为材料,但直到18世纪中叶,铂才被确认为一个纯元素。天然铂金属在19世纪的第一个十年被发现,里面含有钯、铑、锇、铱[35]。俄罗斯河流冲积沙中的铂,从1828年开始使用于盘子和奖牌以及铸造卢布硬币的原物料[36]。在炼制用于铸币的铂金属过程中,所得到的残留物,在俄罗斯帝国是可以取得的,因此铂的大部分研究是在东欧进行的。
在1807年,从南美的铂金属矿中,波兰化学家约德泽伊•什尼亚代基有可能分离出元素44. (他称之为vestium,是依据在不久前发现的小行星Vesta命名 )。他于1808年出版了一份他的发现公告[37]。然而,他的工作从未获得证实,他后来撤回了他的发现声明[16]。
约恩斯•贝泽柳斯和戈特弗里德•奥桑在1827年几乎发现了钌[38] 。他们试验了以王水溶解乌拉山脉含铂的原矿石后留下的残留物。贝泽柳斯没有发现任何不寻常的金属元素,但奥桑认为他发现了三种新金属元素,称之为pluranium、 ruthenium和polinium。[7]这种差异导致贝尔泽柳斯和奥桑之间关于残留物成分的长期争论。[39]由于Osann无法重复他离析钌的实验,最终放弃了他的主张[39][40]。Osann之所以选择ruthenium这个名字,是因为分析的样本来自俄罗斯的乌拉山脉[41] 。 这个名字本身来源于鲁塞尼亚,拉丁语Ruthenia,一个历史区域,包括今天的乌克兰,白俄罗斯,俄罗斯西部,以及斯洛伐克和波兰的部分地区。[39]
1844年,波罗的-德意志裔俄罗斯科学家卡尔•恩斯特•克劳斯 (Karl Ernst Claus) 发现,戈特弗里德•奥桑备制的化合物中也含有少量的钌,克劳斯于同年曾发现的钌。克劳斯在喀山大学工作时,从卢布硬币制程的铂金属残留物中,分离出钌。就像40年前,在喀山发现钌的更重的同族元素锇一样。克劳斯表明,氧化钌含有一种新的金属元素,并从不溶于王水的粗铂中获得6克的钌。替新元素选择名称,克劳斯说:"我为新元素命名,以纪念我的祖国,Ruthenium。我有权使用这个名字,因为Osann先生放弃了他的钌,所以这个字还不存于化学[39][42]。在这样做的过程中,克劳斯开创了一种延续至今的趋势——以一个国家命名一个元素。[43]
纯金属钌用途很少。钌是铂和钯的有效硬化剂,使用它不会降低铂和钯的抗腐蚀性。含有较大百分数(30%-70%)的钌的合金,包含有其它贵重金属或碱金属,可用在电气触点上和需要抗磨和抗腐蚀的地方,如钢笔尖和工具枢轴上。二氧化钌导电,在有机介质中以粉末状与玻璃料相混合,可用作非金属衬底制成电阻元件。[6]
催化剂

许多含化合物都有催化性。催化剂可方便地两种:可溶于反应介质的叫均相催化剂,而不溶的则叫多相催化剂。
钌的纳米颗粒可以在禾乐石内部形成。这种广泛存在的矿物天然具有卷状纳米片(纳米管)的结构,可以支持钌纳米团簇的合成,用于后续工业催化。[44]
含有三氯化钌的溶液对烯烃复分解反应具有高活性。此类催化剂在商业上用于生产聚降冰片烯。[45]某些钌的卡宾配合物显示出相当的反应性,可提供于工业过程。[46] 例如,格拉布催化剂已用于制备药物和先进材料。
钌配合物用于转移氢化(有时称为借氢反应)的高活性催化剂。该方法用于酮、醛和亚胺的不对称氢化。该反应利用手性钌配合物,它们是野依良治引入的。[47] 举个例子,(cymene)Ru(S,S-TsDPEN)催化氢化二苯基乙二酮,产生 (R,R)-氢化苯偶姻。在该反应中,甲酸盐和水/醇作为H2的来源:[48][49]
野依良治于2001年授予诺贝尔化学奖,以表彰他在不对称氢化领域的贡献。
2012年,Masaaki Kitano及其同事使用有机钌催化剂展示了使用稳定的电子盐来作为电子供体和可逆氢储存进行氨合成。[50]
钌促进的钴催化剂用于费托合成。[51]
新兴应用
Intel 在自家半导体10nm制程上,在后端制程BEOL中首次使用金属钌材料[52]。
人们对钌对健康的影响知之甚少[53],因为人们遇到钌化合物的情况相对较少。[54]金属钌是化学惰性的。[53]一些像是四氧化钌(RuO4)的钌化合物有挥发性且剧毒。[54]
- ^ Ruthenium: ruthenium(I) fluoride compound data. OpenMOPAC.net. [2007-12-10]. (原始内容存档于2011-07-21).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ Platinum 2009 - PMM. www.platinum.matthey.com. [2021-10-04].
- ^ PGM Market Report. platinum.matthey.com, p. 30 (May 2018)
- ^ Platinum–Group Metals (PDF). U.S. Geological Survey, Mineral Commodity Summaries. January 2007 [2008-09-09].
- ^ 6.0 6.1 Henry J. Albert. Encyclopedia of Science&Technology (in 15 Volumes). Mc GRAW-Hill Book Co.,1977,4th
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 Haynes, p. 4.31
- ^ Greenwood and Earnshaw, p. 1076
- ^ Greenwood and Earnshaw, p. 1078
- ^ Greenwood and Earnshaw, p. 1075
- ^ 11.0 11.1 Greenwood and Earnshaw, p. 1074
- ^ Greenwood and Earnshaw, p. 1077
- ^ 13.0 13.1 13.2 Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5 Section 11, Table of the Isotopes
- ^ 14.0 14.1 14.2 Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik, The NUBASE evaluation of nuclear and decay properties, Nuclear Physics A, 2003, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ^ Masson, O.; Steinhauser, G.; Zok, D.; Saunier, O.; Angelov, H.; Babić, D.; Bečková, V.; Bieringer, J.; Bruggeman, M.; Burbidge, C. I.; Conil, S.; Dalheimer, A.; De Geer, L.-E.; De Vismes Ott, A.; Eleftheriadis, K.; Estier, S.; Fischer, H.; Garavaglia, M. G.; Gasco Leonarte, C.; Gorzkiewicz, K.; Hainz, D.; Hoffman, I.; Hýža, M.; Isajenko, K.; Karhunen, T.; Kastlander, J.; Katzlberger, C.; Kierepko, R.; Knetsch, G.-J.; et al. Airborne concentrations and chemical considerations of radioactive ruthenium from an undeclared major nuclear release in 2017. PNAS. 2019, 116 (34): 16750–16759. Bibcode:2019PNAS..11616750M. PMC 6708381
 . PMID 31350352. doi:10.1073/pnas.1907571116
. PMID 31350352. doi:10.1073/pnas.1907571116  .
.
- ^ 16.0 16.1 16.2 Emsley, J. Ruthenium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2003: 368–370. ISBN 978-0-19-850340-8.
- ^ Greenwood and Earnshaw, p. 1071
- ^ 引用错误:没有为名为
usgs的参考文献提供内容 - ^ Hartman, H. L.; Britton, S. G. (编). SME mining engineering handbook. Littleton, Colo.: Society for Mining, Metallurgy, and Exploration. 1992: 69. ISBN 978-0-87335-100-3.
- ^ Harris, Donald C.; Cabri, L. J. The nomenclature of the natural alloys of osmium, iridium and ruthenium based on new compositional data of alloys from world-wide occurrences. The Canadian Mineralogist. 1973, 12 (2): 104–112.
- ^ 引用错误:没有为名为
USGS-YB-2006的参考文献提供内容 - ^ 引用错误:没有为名为
USGS-CS-2008的参考文献提供内容 - ^ Renner, H.; Schlamp, G.; Kleinwächter, I.; Drost, E.; Lüschow, H. M.; Tews, P.; Panster, P.; Diehl, M.; Lang, J.; Kreuzer, T.; Knödler, A.; Starz, K. A.; Dermann, K.; Rothaut, J.; Drieselman, R. Platinum group metals and compounds. Ullmann's Encyclopedia of Industrial Chemistry. Wiley. 2002. ISBN 978-3527306732. doi:10.1002/14356007.a21_075.
- ^ Seymour, R. J.; O'Farrelly, J. I. Platinum-group metals. Kirk Othmer Encyclopedia of Chemical Technology. Wiley. 2001. ISBN 978-0471238966. doi:10.1002/0471238961.1612012019052513.a01.pub2.
- ^ Gilchrist, Raleigh. The Platinum Metals. Chemical Reviews. 1943, 32 (3): 277–372. doi:10.1021/cr60103a002.
- ^ 26.0 26.1 26.2 Cotton, Simon. Chemistry of Precious Metals. Springer-Verlag New York, LLC. 1997: 1–20. ISBN 978-0-7514-0413-5.
- ^ Hunt, L. B.; Lever, F. M. Platinum Metals: A Survey of Productive Resources to industrial Uses (PDF). Platinum Metals Review. 1969, 13 (4): 126–138.
- ^ Swain, P.; Mallika, C.; Srinivasan, R.; Mudali, U. K.; Natarajan, R. Separation and recovery of ruthenium: a review. J. Radioanal. Nucl. Chem. 2013, 298 (2): 781–796. S2CID 95804621. doi:10.1007/s10967-013-2536-5.
- ^ Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2nd Edn.), Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- ^ 30.0 30.1 Greenwood and Earnshaw, pp. 1080–1
- ^ 31.0 31.1 Greenwood and Earnshaw, p. 1082
- ^ 32.0 32.1 32.2 Greenwood and Earnshaw, p. 1083
- ^ 33.0 33.1 Greenwood and Earnshaw, p. 1084
- ^ Hartwig, J. F. (2010) Organotransition Metal Chemistry, from Bonding to Catalysis, University Science Books: New York. ISBN 1-891389-53-X
- ^ Weeks, Mary Elvira. The discovery of the elements. VIII. The platinum metals. Journal of Chemical Education. 1932, 9 (6): 1017. Bibcode:1932JChEd...9.1017W. doi:10.1021/ed009p1017.
- ^ Raub, Christoph J. The Minting of Platinum Roubles. Part I: History and Current Investigations 48 (2): 66–69. 2004. Archive
- ^ Jędrzej Śniadecki. Rosprawa o nowym metallu w surowey platynie odkrytym. Wilno: Nakł. i Drukiem J. Zawadzkiego. 1808 (波兰语). (Dissertation about the new metal discovered in raw platinum.)
- ^ New Metals in the Uralian Platina. The Philosophical Magazine. 1827, 2 (11): 391–392. doi:10.1080/14786442708674516.
- ^ 39.0 39.1 39.2 39.3 Pitchkov, V. N. The Discovery of Ruthenium. Platinum Metals Review. 1996, 40 (4): 181–188 [2019-07-13]. (原始内容存档于2011-06-09).
- ^ Osann, Gottfried. Berichtigung, meine Untersuchung des uralschen Platins betreffend. Poggendorffs Annalen der Physik und Chemie. 1829, 15: 158. doi:10.1002/andp.18290910119.
- ^ Osann, Gottfried. Fortsetzung der Untersuchung des Platins vom Ural. Poggendorffs Annalen der Physik und Chemie. 1828, 14 (6): 283–297. Bibcode:1828AnP....89..283O. doi:10.1002/andp.18280890609. The original sentence on p. 339 reads: "Da dieses Metall, welches ich nach den so eben beschriebenen Eigenschaften als ein neues glaube annehmen zu müssen, sich in größerer Menge als das früher erwähnte in dem uralschen Platin befindet, und auch durch seinen schönen, dem Golde ähnlichen metallischen Glanz sich mehr empfiehlt, so glaube ich, daß der Vorschlag, das zuerst aufgefundene neue Metall Ruthenium zu nennen, besser auf dieses angewendet werden könne."
- ^ Claus, Karl. О способе добывания чистой платины из руд. Горный журнал (Mining Journal). 1845, 7 (3): 157–163 (俄语).
- ^ Meija, Juris. Politics at the periodic table. Nature Chemistry. 2021, 13 (9): 814–816. Bibcode:2021NatCh..13..814M. PMID 34480093. S2CID 237405162. doi:10.1038/s41557-021-00780-5.
- ^ 44.0 44.1 Vinokurov, Vladimir A.; Stavitskaya, Anna V.; Chudakov, Yaroslav A.; Ivanov, Evgenii V.; Shrestha, Lok Kumar; Ariga, Katsuhiko; Darrat, Yusuf A.; Lvov, Yuri M. Formation of metal clusters in halloysite clay nanotubes. Science and Technology of Advanced Materials. 2017, 18 (1): 147–151. Bibcode:2017STAdM..18..147V. PMC 5402758
 . PMID 28458738. doi:10.1080/14686996.2016.1278352.
. PMID 28458738. doi:10.1080/14686996.2016.1278352.
- ^ Delaude, Lionel and Noels, Alfred F. Kirk-Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. 2005. ISBN 978-0471238966. doi:10.1002/0471238961.metanoel.a01.
|chapter=被忽略 (帮助) - ^ Fürstner, Alois. Olefin Metathesis and Beyond. Angewandte Chemie International Edition. 2000, 39 (17): 3012–3043. PMID 11028025. doi:10.1002/1521-3773(20000901)39:17<3012::AID-ANIE3012>3.0.CO;2-G.
- ^ Noyori, R.; Ohkuma, T.; Kitamura, M.; Takaya, H.; Sayo, N.; Kumobayashi, H.; Akutagawa, S., Asymmetric hydrogenation of .beta.-keto carboxylic esters. A practical, purely chemical access to .beta.-hydroxy esters in high enantiomeric purity, Journal of the American Chemical Society, 1987, 109 (19): 5856, doi:10.1021/ja00253a051
- ^ Ikariya, Takao; Hashiguchi, Shohei; Murata, Kunihiko and Noyori, Ryōji (2005). "Preparation of Optically Active (R,R)-Hydrobenzoin from Benzoin or Benzil". Org. Synth.: 10.
- ^ Chen, Fei. Synthesis of Optically Active 1,2,3,4-Tetrahydroquinolines via Asymmetric Hydrogenation Using Iridium-Diamine Catalyst. Org. Synth. 2015, 92: 213–226. doi:10.15227/orgsyn.092.0213
 .
.
- ^ Kitano, Masaaki; Inoue, Yasunori; Yamazaki, Youhei; Hayashi, Fumitaka; Kanbara, Shinji; Matsuishi, Satoru; Yokoyama, Toshiharu; Kim, Sung-Wng; Hara, Michikazu; Hosono, Hideo. Ammonia synthesis using a stable electride as an electron donor and reversible hydrogen store. Nature Chemistry. 2012, 4 (11): 934–940. Bibcode:2012NatCh...4..934K. PMID 23089869. doi:10.1038/nchem.1476.
- ^ Schulz, Hans. Short history and present trends of Fischer–Tropsch synthesis. Applied Catalysis A: General. 1999, 186 (1–2): 3–12. doi:10.1016/S0926-860X(99)00160-X.
- ^ techinsights.com. Intel 10 nm Logic Process. www.techinsights.com. [2018-06-22].
- ^ 53.0 53.1 Ruthenium. espimetals.com. [2020-07-26].
- ^ 54.0 54.1 Ruthenium (Ru) - Chemical properties, Health and Environmental effects. lenntech.com. [2020-07-26].
- 元素钌在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钌(英文)
- 元素钌在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钌在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钌(英文)

