

| 此条目尚未参照元素专题之格式编写。 欢迎您参照元素专题的建议格式来修订这个条目,以提高条目质量。 |
硒(拼音:xī,注音:ㄒ丨,粤拼:sai1;英语:Selenium),是一种化学元素,其化学符号为Se,原子序数为34,原子量为78.971 u。硒是一种非金属(偶尔被认为是类金属),具有的性质介于元素周期表中上下两元素硫和碲之间,且与砷也有相似性。它罕见以元素状态存在,亦甚少在地壳中以纯化合物的矿石存在。 Selenium(来自古希腊语σελήνη(selḗnē)“月神名”)于1817年由永斯·雅各布·贝吉里斯(Jöns Jacob Berzelius)发现,他注意到此新元素与先前发现的碲(以地球命名)具有相似性质。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 硒的两种同素异形体 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 硒(Selenium)·Se·34 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 非金属 有人认为其为类金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 16 ·4·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 78.971(8) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氩] 3d10 4s2 4p4 2, 8, 18, 6 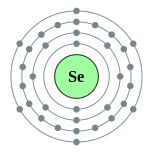 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 贝采里乌斯 和 约翰·甘恩(1817年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 贝采里乌斯 和 约翰·甘恩(1817年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (灰硒) 4.81 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (红硒) 4.39 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) (黑硒) 4.28 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 3.99 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 494 K,221 °C,430 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 958 K,685 °C,1265 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 1766 K,27.2 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (灰硒) 6.69 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 95.48 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 25.363 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 6, 4, 2, 1, -2 (强酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.55(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:941.0 kJ·mol−1 第二:2045 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 120 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 120±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 190 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | (无定形硒) 0.519 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)(无定形硒) 37 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)3350 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 10 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 3.7 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 8.3 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 2.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 736 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7782-49-2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:硒的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
硒存在于金属硫化物矿石(英语:Sulfide minerals)中,矿石中金属应与硫原子键结的位置,部分由硒原子取代。在商业上,硒经常是得自这些矿石的精炼过程中所产生的副产物。纯的硒化物或硒酸盐化合物矿物是已知的,但很少见。现今硒的主要商业用途是在玻璃制造(英语:Glass production)和色素。硒是一种半导体,用于光电池,曾经是很重要的电子学应用,现已大部分被硅半导体的装置取代,但硒仍用于少数几种类型的直流电源突波保护器和一种萤光量子点。
服用大量硒盐可能引起中毒,但微量的硒是许多生物(包括所有动物)细胞功能所必需的。硒是许多多种维生素和其他膳食补充剂中的一个成分,包括婴儿配方奶粉。它是抗氧化酶麸胱甘肽过氧化酶和硫氧化还原蛋白还原酶的组成成分(间接还原动物和一些植物中的某些氧化分子)。它也存在于三种脱碘酶(英语:Deiodinase)中,它们将一种甲状腺激素转化为另一种。植物中硒的需求因物种而异,某些植物需要相对较大的量,而另一些则显然不需要。[1]
物理性质
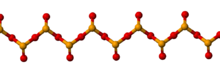
硒可形成几种同素异形体,它们随温度变化而相互转换,并与温度变化的速率有关。以化学反应制备所得之硒通常是非晶质的砖红色粉末。当迅速融化时,它形成黑色的玻璃态,贩卖时常以珠子状出售。[2]黑硒的结构是不规则和复杂的,由众多可达1000个原子的聚合物环所组成。黑硒是一种脆性,有光泽的固体,微溶于二硫化碳。加热时,它在50 ℃ 软化并在180 ℃转化为灰硒;当有卤素和胺的存在时,会降低其转化温度。[3]
通过改变溶剂(通常为二硫化碳)的蒸发速率,可从黑硒溶液产生红色α,β和γ形式。它们都属单斜晶体对称性,并且类似硫由折叠状的Se8环以不同的方式排列而成。α形式中的排列最紧密。在Se8环中,Se-Se距离为233.5 pm,Se-Se-Se角为105.7°。其他硒同素异形体可能含有Se6或Se7环。[3]
最稳定和致密形式的硒是灰色的并且具有由螺旋聚合物链组成的六方晶格,其中Se-Se距离为237.3 pm,Se-Se-Se角为130.1°,链条之间的最小距离为343.6 pm。灰硒的形成可透过以下的方式:温和加热其它同素异形体、缓慢冷却熔融的硒、或者冷凝恰好低于熔点的硒蒸气。相对于其他硒形式的绝缘体性质,灰色硒是半导体,具有可观的光电导性。另一个与其他同素异形体不同之处是它不溶于二硫化碳。[3]它可抵抗空气氧化,不会受到非氧化性酸的侵蚀,使用强还原剂,则形成聚硒化物。硒不会表现出如硫在逐渐加热时产生的粘度变化。[2][4]
光学性质
由于可在平板X射线探测器(见下文)中用作光电导体,非晶质的硒(α-Se)薄膜之光学性质已成为深入研究的主题。[5][6][7]
同位素
硒有七种天然存在的同位素。其中五个:74Se、76Se、77Se、78Se和80Se是稳定的,而80Se是最丰富的(天然丰度为49.6%)。同样天然存在的是长寿命的原始放射性核种(英语:Primordial nuclide) 82Se,其半衰期为9.2×1019年。非原始放射性同位素硒-79(英语:Selenium-79)也以微量存在于铀矿石中,是核分裂的产物。硒还有许多不稳定的合成同位素(英语:Synthetic radioisotope),范围从64Se到95Se;最稳定的两种是75Se,半衰期为119.78天,和72Se,半衰期为8.4天。比稳定同位素更轻的同位素主要透过正电子发射生成砷的同位素,而比稳定同位素更重的同位素则进行β衰变生成溴的同位素,在已知最重的同位素中,会有少数进行中子发射的支线。
| 同位素 | 天然 | 来源 | 半衰期 |
|---|---|---|---|
| 74Se | 天然 | 稳定 | |
| 76Se | 天然 | 稳定 | |
| 77Se | 天然 | 核分裂产物 | 稳定 |
| 78Se | 天然 | 核分裂产物 | 稳定 |
| 79Se | 微量 | 核分裂产物 | 327000 年[8][9] |
| 80Se | 天然 | 核分裂产物 | 稳定 |
| 82Se | 天然 | 核分裂产物[10] | ~1020 年 |
硒在化合物中通常的氧化态为−2、+2、+4和+6。
氧族元素化合物
硒有两种氧化物——二氧化硒(SeO2)和三氧化硒(SeO3)。二氧化硒可以由硒和氧气直接反应而成:[2]
它是由SeO2单体组成的聚合物固体,在气态下则解离成固体,溶于水生成亚硒酸 H2SeO3。亚硒酸也可以由硒和硝酸反应而成:[11]
不像形成稳定三氧化物的硫,三氧化硒在热力学上不稳定,超过185 °C时分解成二氧化硒:[2][11]
在实验室里,三氧化硒可以由无水硒酸钾(K2SeO4)和三氧化硫(SO3)反应而成。[12]
亚硒酸的盐叫做亚硒酸盐,例子包括亚硒酸银(Ag2SeO3)和亚硒酸钠(Na2SeO3)。
硫化氢会和亚硒酸反应,生成二硫化硒:
二硫化硒由八元环组成,组成约为 SeS2,其中的八元环的成分可变,例如Se4S4和Se2S6。二硫化硒已在洗发水中用作抗头皮屑剂、聚合抑制剂、玻璃染料和烟花中的还原剂。[11]
三氧化硒可以由硒酸 H2SeO4脱水而成,而后者可以由二氧化硒和过氧化氢反应而成:[13]
热浓硒酸可以和金反应,生成硒酸金。[14]
卤素化合物
硒唯一稳定的氯化物是二氯化二硒(Se2Cl2),类似的溴化物也是已知的。这些化合物的结构类似二氯化二硫。二氯化硒是制备硒化合物(例如Se7)的重要试剂。它可以由硒和硫酰氯(SO2Cl2)反应而成。[15]硒和氟气反应,生成六氟化硒:
相较于对应的硫化合物六氟化硫,六氟化硒(SeF6)更活泼,有毒,会刺激肺部。[16] 一些硒的卤氧化物如:二氟氧化硒(SeOF2)和二氯氧化硒(SeOCl2)都用于特殊溶剂。[2]
硒化物
和其它氧族元素一样,硒也有对应的氢化合物硒化氢 H2Se。它是极臭、有毒的无色气体,酸性比H2S更强。在溶液中,它会电离成HSe−。硒离子Se2−可以形成各种化合物,包括硒化汞(HgSe)、硒化铅(PbSe)、硒化锌(ZnSe)和硒化铜铟镓(英语:copper indium gallium diselenide)(Cu(Ga,In)Se2)。这些材料都是半导体。例如铝的高电正性元素的硒化物会水解:[2]
碱金属硒化物可以继续和硒反应,形成含有Se2−n链的多硒化物。
硒化物可以由硒和金属反应而成[17]:
其它化合物
四氮化四硒 Se4N4是橙色的爆炸性化合物,是四氮化四硫(S4N4)的衍生物。[2][18][19]它可以由四氯化硒(SeCl4)和[((CH3)3Si)2N]2Se(英语:Metal bis(trimethylsilyl)amides)反应而成。[20]
硒和氰化物反应,生成硒氰酸盐:[2][17]
和过渡金属氰化物在液氨中反应,会有不同的反应发生,如[17]:
有机硒化合物
硒,特别是II氧化态的硒能与碳形成稳定的键,其结构类似于相应的有机硫化合物。硒和硫有类似的性质,因此,许多有机硫化合物都有对应的有机硒化合物。其中,最常见的是硒醚(R2Se,硫醚的类似物)、二硒化物(R2Se2,二硫化物的类似物)和硒醇(RSeH,硫醇的类似物)。有机硫化学中的亚砜在有机硒化学中对应的化合物是硒代亚砜(RSe(O)R),是有机合成的中间体,例如硒代亚砜消除反应(英语:selenoxide elimination)。由于双键规则(英语:double bond rule),硒酮 R(C=Se)R和硒醛 R(C=Se)H都很罕见。[21]
硒(Selenium名称来自希腊文的σελήνη selene,意思是“月亮”)于1817年由永斯·贝吉里斯(Jöns Jakob Berzelius) 与约翰·戈特利布·甘恩(Johan Gottlieb Gahn)两位化学家发现。[22]这两位化学家在瑞典格利普霍姆堡(Gripsholm)附近拥有一家以铅室法制造硫酸的工厂。从瑞典法伦的大铜山矿区来的黄铁矿用铅室法会产生被认为是砷化物的红色沉淀,此黄铁矿因而不再用来制备硫酸。不过贝吉里斯与甘恩仍然想使用这里的黄铁矿而且察觉到红色沉淀物燃烧时会释放出类似辣根的气味,这种气味并非典型砷化物具有的,而像是碲化物的气味。所以贝吉里斯最初写给亚历山大·马西特(英语:Alexander_Marcet)(Alexander Marcet)的信上说到这是碲化物。但是在法伦矿区矿物少有碲化物的事实让贝吉里斯重新分析这些红色沉淀物,在1818年他写给马西特的第二封信就提到这是一种类似硫与碲的新元素。由于碲是以地球命名,贝吉里斯就以月球来命名这个新元素。[23][24]
1873年卫勒比·史密斯(英语:Willoughby_Smith)(Willoughby Smith)发现灰硒的电阻与所在环境的光度有关,[25]这个特性让硒被用来当作感光元件。在1870年代中期,第一个用到硒的商业产品由维尔纳·冯·西门子(Werner von Siemens)开发出来,亚历山大·格拉汉姆·贝尔(Alexander Graham Bell)1879年发明的光电话机(Photophone)也用到了硒元件,硒传输的电流正比于照在其上的光线强度,这种现象也被用在测光表与类似装置的设计。硒的半导体性质应用在许多电子设备,[26][27][28]1930年代初期开始有以硒设计的硒整流器(英语:Selenium_rectifier) ,因为效率较好[29][30][31] 取代了氧化铜整流器。此商业运用持续到1970年代,之后又被更便宜且更有效率的硅整流器所取代。
硒的毒性危害到工人,在医疗上引发关注。从动物食用高硒含量的作物而发现硒对动物有毒性。1954年生化学家珍·平森(英语:Jane_Gibson)(Jane Pinsent)首先发现微生物中硒与特定生物功能的关联,[32][33]1957年发现对哺乳动物相当重要。[34][35]1970年代硒被发现出现在两组不同的酶之中。后来又发现蛋白质中含有硒半胱胺酸。1980年代硒半胱胺酸被发现在密码子UGA中,其作用于细菌的转录机制最早被解开,后来也发现作用在哺乳动物的机制。(参看SECIS元件)[36]

天然(即元素态)硒是一种少见的矿物,通常不会形成良好的晶体,但是当它生成时,会是陡峭的菱面体或微小的针状(毛发状)晶体。[37] 由于其他化合物和元素的存在,硒的分离常常变得复杂。
硒在天然界以多种无机物形式存在,包括硒化物、硒酸盐和亚硒酸盐,但这些矿物很少见。 常见的透石膏(selenite)并不是硒的矿物质,不含亚硒酸根离子,而是早在发现硒之前,就像硒一样被称为月亮的一种石膏(硫酸钙水合物)。硒是许多金属硫化物矿物中最常见的杂质,它取代了一小部分的硫。[38][39]
在生命系统中,硒存在于氨基酸:硒代甲硫胺酸、硒代半胱胺酸和甲基硒代半胱胺酸(英语:methylselenocystein)中。在这些化合物中,硒扮演类似于硫的作用。 另一种天然存在的有机硒化合物是二甲基硒。[40][41]
某些土壤富含硒,而硒可以被某些植物进行生物累积。在土壤中,硒最常以可溶形式存在,例如硒酸盐(类似于硫酸盐),它们很容易透过淋溶进入河流,[38][39]海水含有相当量的硒。[42][43]
人为的硒来源包括燃煤,以及硫化矿石的开采和冶炼。[44]
如铜、镍或铅一般,硒最常由许多硫化物矿石中的硒化物而得。取得硒的特别有效方法是来自电解法进行金属精炼的副产物,例如由铜精炼厂的阳极泥来获得。另一个来源是来自硫酸厂的铅室泥浆,但这是一个不再使用的制程。虽可以透过许多方法从这些泥中精制硒,然而,大多数元素态硒是精炼铜或生产硫酸的副产品。[45][46]自铜的溶剂萃取和电解提炼(英语:Solvent extraction and electrowinning)(SX / EW)法发明以来,在全球铜的生产供应中所占的份额越来越大,[47]这限缩了硒的来源,因为矿石中的硒,只有相当少的部分与铜一起被淋溶出。[48]
硒的工业生产,通常涉及从纯化铜的过程中所获得的残余物提取二氧化硒;此法通常先将精炼铜所得之残余物氧化,以产生二氧化硒,二氧化硒与水混合并酸化以形成亚硒酸,接着将二氧化硫气泡通入亚硒酸溶液(还原步骤)得到元素态硒。[49][50]
硒的总储量估计为93,000吨。2011年全球约生产了2,000吨硒,主要集中在德国(650吨)、日本(630吨)、比利时(200吨)和俄罗斯(140吨),这些数据不包括两个主要生产国,美国和中国。其价格于2004年急剧从4-5增长至27美元/磅。2004–2010年价格相对稳定,每磅约30美元(100磅包装),但2011年增加到65美元/磅。2010年的消费量分别为:冶金--30%,玻璃制造--30% ,农业 - 10%,化学品和颜料 - 10%,电子产品 - 10%。中国是硒的主要消费国,每年用量为1,500-2,000吨。[51]
锰电解
在锰的电解提炼(英语:electrowinning)过程中,添加二氧化硒降低了操作电解池所需的能量。为此目的,中国成为最大的二氧化硒消费国。为了产出每吨锰,平均使用2公斤的氧化硒。[51][52]
玻璃制造
硒的最大商业用途是在于生产玻璃,这占了其消费量的约50%。 硒化合物赋予玻璃红的色泽,这种颜色可抵消大多数玻璃通常存在的铁杂质所引起的绿色或黄色色调。为此目的,可加入各种亚硒酸盐和硒酸盐。对于其它应用可能需要红色时,能由加入CdSe和CdS的混合物来得到。[53]
合金
在黄铜中硒与铋一起使用来取代毒性较高的铅。美国根据例如1974年通过的“安全饮用水法(英语:Safe Drinking Water Act)”对饮用水中的铅进行管控,这使得减少黄铜中的铅含量成为必要;新款黄铜以EnviroBrass的名义上市销售。[54] 与铅和硫一样,硒在0.15%左右的浓度下提高了钢的可加工性;[55][56] 硒在铜合金中亦可产生相同的机械加工性能。[57]
锂硒电池
锂硒(Li-Se)电池是锂电池系列中最有前途的储能系统之一,[58] 它有机会成为锂硫电池(英语:Lithium–sulfur battery)之外的的另一选择,具有高电流的优点。
太阳能电池
铜铟镓硒(英语:copper indium gallium selenide solar cells)是用于太阳能电池的材料。[59]
光电导体
非晶质的硒(α-Se)薄膜可用作平板X射线探测器(英语:Flat panel detector)中的光电导体,[60] 这些探测器使用非晶质的硒将入射的X射线光子直接捕获并转换成电荷。[61]
整流器
硒整流器(英语:Selenium rectifier)最早在1933年使用,它们的使用一直持续到20世纪的90年代。
其它用途
制造橡胶中的硫化过程所使用的催化剂,可用少量有机硒化合物来改进。[48]
电子业对硒的需求正在减少。[48] 它的太阳能光电和光电导效应仍可用于影印机、[62][63][64][65] 光电池、照度计和太阳能电池。它在单纯复印纸的机器中作为光电导体的用途,曾经是主要的应用,但在20世纪的80年代,随着越来越多的复印机转成使用有机光电导体,光电导体的应用下降(尽管这仍然是一个大量的最终用途)。虽然曾经被广泛使用,硒整流器(英语:Selenium rectifier)大部分已被基于硅的整流器取代(或正在被替换)。最值得注意的例外是直流电源突波保护(英语:Surge protector),其中硒抑制器的卓越能量耐受力,使其比金属氧化物型的压敏电阻更适用。
硒化锌是蓝光发光二极管(LED)的第一种材料,但现在氮化镓占据了市场的主导地位。[66] 硒化镉曾是量子点中的重要成分。在X射线照术(英语:Xeroradiography)和固态平板X射线照相机中,无晶质的硒片被用来将X射线影像转换为电荷分布图。[67] 游离硒(Se24+)是X射线激光中使用的活性介质之一。[68]
硒是一些化学反应中的催化剂,但由于毒性问题,它没有被广泛使用。在 X射线晶体学中,掺入一个或多个硒原子代替硫,有助于多波长反常色散和单波长反常色散(英语:Single-wavelength anomalous diffraction)的定相。[69]
硒用于照相印刷品的调色(英语:Photographic print toning),并且由许多摄影制造商作为色剂出售。硒增强并扩展了黑白摄影图像的色调范围,并提高了打印的持久性。[70][71][72]
硒-75在工业射线照相中用作加马射线源。[73]
| 硒 | |
|---|---|
| 危险性 | |
| NFPA 704 |
 0
2
0
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
硒是人体必需的微量矿物质营养素[74],多以氧化态Se(Ⅱ)、Se(Ⅳ)、和Se(Ⅵ)存在,化学性质与硫相似,许多含硫氨基酸,如甲硫胺酸(Met)、半胱氨酸(Cys)、胱氨酸也可用硒取代硫。
硒在动物组织中最常以硒甲硫氨酸(selenomethionine,简称SeMet)和硒半胱氨酸(selenocysteine,简称SeCys)的形态存在,其中甲硒胺酸无法由人体合成,仅能由植物合成后经摄食再经消化代谢而获得,故食材动植物来源组成将决定硒在饮食中的形式,此外,人体中甲硒胺酸可以取代甲硫胺酸;但硒半胱胺酸不能取代半胱胺酸。硒在生理上的功能除了抗氧化外,还调控了甲状腺的代谢和维他命C的氧化还原态,也曾被提出和抗癌相关的可能性。在食材成分含量里,同种植物性食材含硒成分变化相当大,乃因各原植物生长地的土壤中硒的浓度不同,当地的动物也随之反映相应情形,因此硒营养缺乏或过量情形常有地域性关系。
然而,纯硒元素和金属硒化物的毒性相对上不大,而且有些为重要的微量元素之一。严重缺乏可引致克山症和溪山症,病征包括心肌坏死、萎缩、软骨组织坏死。另外又与甲状腺肿、呆小症和习惯性流产有关。
含量与分布
人体本身的硒总含量为15mg。男性体内的硒多集中在睾丸及前列腺输精管中,会随精液一起排出体外。人体与动物有二个硒储存库,一为身体蛋白质的硒甲硫氨酸(SeMet),它的储存量视饮食中SeMet量而定,其提供硒的量,取决于甲硫胺酸的转换率;二为肝脏酵素谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)的硒。
食物来源
硒存在于土壤中,而世界各地的土壤硒含量皆不相同,各地植物所含的硒浓度也因此不同。一般而言,食物中的瘦肉、柿子、蒜头、海产、葱、南瓜等含有多量的硒。动物制品的硒含量(约0.4-1.5μg/g)比植物体高;一般植物谷类的硒含量范围可在<0.1μg/g─>0.8μg/g;在海洋生物中,硒类的含量也比植物多,但由于鱼类(尤其是体内含汞的鱼类)会形成汞─硒复合体,造成对硒的生物利用性极低,故虽然硒在鱼类的含量多但对于鱼类本身的利用性极低;至于肉类会提供0.1-0.4μg/g;乳制品的硒含量则为<0.3μg/g。
另外,全谷物和核果种子也是好的来源。在饮水中提供的硒摄取量十分有限,除非水流经含硒量高的土壤地区才可能有较高的含量。
植物中的硒是因硒取代硫而进入植物体,硒型态有甲硒胺酸、硒胺酸与其代谢产物等。动物生长需要硒,在摄食植物时获得甲硒胺酸。饮食中硒的形式取决于动植物食品的组合。
| 食品名称/重量 | 硒(μg) |
|---|---|
| 鲔鱼 / 3 oz | 68 |
| 火腿(瘦肉)/ 3 oz | 42 |
| 蛤蜊 / 3 oz | 41 |
| 鲑鱼 / 3 oz | 40 |
| 意大利蛋面 /1杯 | 35 |
| 沙朗牛排 / 3 oz | 28 |
| 鸡胸肉 / 3 oz | 20 |
| Special K cereal | 17 |
| 麸燕麦片 / 1杯 | 14 |
| 全麦面包 / 1片 | 10 |
| 燕麦糊 / 1/2杯 | 10 |
| 白面包 / 1片 | 9 |
| 葡萄干麦片 / 1杯 | 4 |
建议量
民众的实际硒摄取量会因地而异,美国平均每日81μg、加拿大每日113–220μg,高于RDA。均饮食估计可提供约104-124 μg的硒。成人之上限摄取量(UL)订为400μg。
硒的建议量在1980年只能根据估计而得,称为Estimated safe and adequate dietary intake(ESADDI);2000年则根据需要量之科学研究而订定每日建议摄取量(RDA)。
过去曾有关于台湾境内硒之饮食摄取量的研究[76],分析结果六日饮食的硒摄取范围在104~124μg(1.3~1.6μmol)/day,平均值为112μg(1.4μmol)/day,加上台湾非低硒区域,且食品贸易进出口抹去食品在硒含量上的地域性限制,推测台湾境内应无硒营养缺乏的问题。
- 硒的营养来源:
- 有机型式:甲硒胺酸(selenomethione)、硒半胱胺酸(selenocysteine)
- 无机型式:硒酸盐(selenate)、亚硒酸盐(selenite)
- 影响硒营养需求量的因素[77]
- 1.生物吸收率:见“吸收”。
- 2.性别:早期来自中国研究报告,当时硒缺乏现象比现在严重,在此情形显示产龄女性较易罹患克山病(Keshan disease);另外,过去20年报告显示孩童不论男女有相同的比例罹患克山病;性别的影响必须在硒摄取量极低的情下才会显现,假设考虑女性有较高几率罹患克山病,硒对各年龄层的需求量将以男性参考体重为基准。
| 年龄 | 美国 (μg/day)[77] | 台湾 (μg/day)[76] |
|---|---|---|
| 0 个月~ | AI=15 | 15 |
| 6个月~ | AI=20 | 20 |
| 1岁~ | 20 | 20 |
| 4岁~ | 30 | 25 |
| 7岁~ | 30 | 30 |
| 10岁~ | 40 | 40 |
| 13岁~ | 40 | 50 |
| 14岁~ | 55 | 50 |
| 孕妇 | 60 | 60 |
| 哺乳 | 70 | 70 |
- RDA(建议摄取量 Recommanded Dietary Allowances):美国原始的饮食标准,代表同年龄层中,97~98%人的营养需求量。
- AI(足够摄取量 Adequate Intake):未能有足够的实验资讯建立EAR的情形下,所推估维持健康状态的量,常用在一岁以下的婴儿。
| 年龄 | 美国 (μg)[77] | 台湾 (μg)[76] |
|---|---|---|
| 0月~ | 45 | 35 |
| 3月~ | 45 | 50 |
| 6月~ | 60 | 60 |
| 9月~ | 60 | 65 |
| 1岁~ | 90 | 90 |
| 4岁~ | 150 | 135 |
| 7岁~ | 150(4~8岁) | 185 |
| 10岁~ | 280 | 280 |
| 13岁~ | 400(14岁~) | 360 |
| 16岁~ | 400 | 400 |
| 19岁~ | 400 | 400 |
| 怀孕期 | 400 | 400 |
| 哺乳期 | 400 | 400 |
- UL(Tolerable Upper Intake Level 上限摄取量):对于97~98%的人不可能产生不良健康影响之每日最大营养摄取量。
对硒的特殊需求者
- 以全静脉注射营养(TPN,Total Parenteral Nutrition)为唯一营养来源者,需要硒的营养补充剂。
- 有严重肠胃道疾病(例如:克隆氏症)或曾移去一大段小肠者有硒营养缺乏的风险。
- 碘营养缺乏者。研究指出硒缺乏会恶化碘缺乏的症状,适当补充硒可以缓解碘缺乏症状以及在神经系统的影响。
- 使用化疗药物者需要硒营养的补充。有研究指出,多种型态的硒可以减少化疗药物(例如:顺铂,cisplatin)所引发肾和骨髓的伤害。
资料来源:[78]
吸收
有机和无机形式的硒都可以很有效率的被吸收,只是发生在不同的肠道部位;吸收率并非调控动物体硒之恒态的机制。十二指肠是硒主要的吸收位置,空肠和回肠则有少量的吸收,但胃则没有吸收硒之能力。甲硒胺酸的吸收效率比亚硒酸盐(selenite)来得好。含有硒的氨基酸吸收是利用氨基酸运送系统,吸收率可达到80%。甲硒胺酸的吸收率比硒胺酸好。在某些研究中,亚硒酸盐的吸收率可达到85%以上,因与肠道中物质的交互作用,吸收率较有变化。一旦吸收后,保留程度高于硒酸盐。硒酸盐(selenate)的吸收又比亚硒酸盐好,几乎被完全吸收;但并入组织前,大部分会由尿中排除。
维生素A、维生素C、维生素E都会增加硒的吸收,当在小肠腔的谷胱甘肽(glutathione,GSH)浓度低时也会增加吸收。重金属(例:水银)和植酸被认为会抑制硒的吸收。
高剂量的维生素C、锌及重金属(例如:汞)会减少硒的吸收;但若在饮食中合并食用硒及维生素C,硒可以和饮食中的氨基酸形成保护结构进而不影响其吸收[79]。
转运
小肠吸收之硒会和运输蛋白结合经血液携带至肝和其他组织。肾脏、肝脏、心脏、胰脏和肌肉都是硒含量较高的组织,肺脏、脑部、骨骼和红血球也含有硒。目前如何调控硒从组织释放到血浆里或是组织从血浆里吸收的作用机制仍然不明。存在血浆中的硒,与许多不同分子结合成不同的形式存在着。其中最多的就是硒半胱氨酸(Selenocysteine,Sec):由硒原子取代原本在半胱氨酸中的硫原子而存在,由硒蛋白质P(Selenoprotein P)这个运输蛋白所携带,而这个运输形式在血浆中也占了一半以上。其它类型的运输形式还有甲硒氨酸(Selenomethionine),由硒原子取代原本在甲硫氨酸中的硫原子而存在,也是由硒蛋白质P所携带;除了这两种有机硒之外,也有无机硒的运输形式:硒酸盐、亚硒酸盐、硒化氢,与在人体血液中α球蛋白及β球蛋白的巯基(sulfhydryl groups)结合,例如:极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)。
而前述各种带有硒且存在于血浆中的分子,均会被细胞所吸收。而细胞则释放甲基化的硒化物至血浆中,再经由尿液将其排出体外。
- 分子特性
- 硒蛋白质P(Selenoprotein P)- 是一种含有硒半胱氨酸的血浆蛋白,也是一种运输蛋白,主要是由肝脏合成,在血浆中大约有50%以上的硒是和含硒蛋白质P结合。含硒蛋白质P的结构最多可以带有十个Sec残基,当硒量下降时也会使残基合成量下降。
- α球蛋白(α-globulin)- 其中又分成α 1-globulin及α 2-globulin。两者均为糖蛋白,亦皆可帮助脂质的运输。其中α 2-globulin又有一些不同的功能:帮助血红素的运输、铜运输、血液凝集以及调控氧化酶的活性。
- β球蛋白(β-globulin)- 可以帮助脂质的运输以及铁和其他矿物质的运输。
代谢
含硒氨基酸和无机态硒都会在组织中进行代谢。从饮食而来的甲硒胺酸其利用情形和甲硫胺酸相似,可储存在氨基酸代谢池中,用于合成蛋白质,也可代谢成硒半胱氨酸和硒胱胺酸。
硒胺酸可以从饮食中直接得到,或是经由甲硒胺酸代谢而来。硒半胱氨酸经由β-硒半胱氨酸裂解酶作用之后产生游离态硒。游离态硒可以从谷胱甘肽(GSH)得到氢,然后生成硒化物(selenide)。硒化物有两个代谢途径,其一是经过甲基化作用后借由尿液排出体外,或是形成硒代磷酸盐(selenophosphate),这是体内重要含硒酵素的前驱物,例如5'-脱碘酶(5'-deiodinase)或榖胱甘肽过氧化酶(glutathione peroxidase)。
从食物中得来的硒酸盐在体内可转换成亚硒酸盐,更进一步代谢成硒代谷胱甘肽(selenodiglutathione)及硒离子,后者成为硒蛋白或酵素的原料。
生化功能
硒最主要的功能是作为各种硒蛋白(selenoprotein)的组成分,进而影响其酵素活性或功能。
- 谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)
- 这是研究最多的含硒酵素,因为最早发现硒的生化功能就是作为谷胱甘肽过氧化酶的辅基。谷胱甘肽过氧化酶有五种亚型,通常标记为GPX1, 2, 3, 4, 5,每一种的亚型存在于不同的组织,但是催化相同的反应。主要的功能是消除组织中的过氧化氢(H2O2)和其他有机态过氧化物。还原过氧化物时,同时利用谷胱甘肽提供还原力(图[80])。
- 甲状腺素脱碘酶(Iodothyronine Deiodinases(英语:deiodinases),IDI或DI)
- 脱碘酶是含硒蛋白质,酵素的活性区是硒半胱氨酸。已知有三种亚型。第一型存在肝脏、肾脏和肌肉,第二型及第三型存在皮肤、脑下垂体、脂肪细胞和脑。主要功能是催化甲状腺素和相关代谢物脱去碘原子(图),例如:5'-deiodinase(5'-DI)将T4型甲状腺素脱碘转换成T3型甲状腺素,后者是体内活性最高的甲状腺素,可调节代谢、生长及发育。去碘酶也会将T4转换反式T3(reverse T3),催化产生反式T3的酵素是5-deiodinase。T3或是反式T3都可进一步脱碘产生T2或是3,3'-diiodothyronine,这些都是没有活性的代谢物。
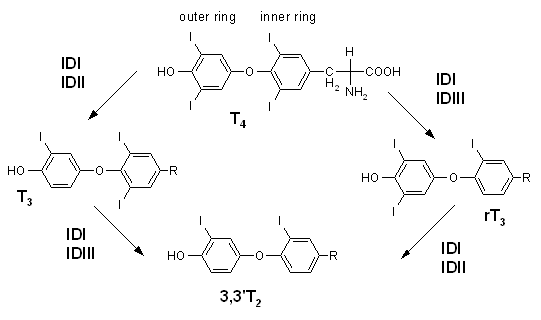 甲状腺素脱碘酶的作用
甲状腺素脱碘酶的作用
- 脱碘酶是含硒蛋白质,酵素的活性区是硒半胱氨酸。已知有三种亚型。第一型存在肝脏、肾脏和肌肉,第二型及第三型存在皮肤、脑下垂体、脂肪细胞和脑。主要功能是催化甲状腺素和相关代谢物脱去碘原子(图)
- “硫氧化还原蛋白”还原酶(硫氧还蛋白还原酶,TrxR)
- 酵素的活性区有硒半胱氨酸,并含有FAD。此酵素存在血液、皮肤和肝脏等组织。主要反应是将氧化态的“硫氧化还原蛋白”(thioredoxin(英语:thioredoxin))中的双硫键(disulfide bond)予以还原。还原态的“硫氧化还原蛋白”可以将氢原子提供给其他化合物(图[81])。
- 硒代磷酸盐合成酶(Selenophosphate synthetase(英语:Selenophosphate synthetase 1))
- 硒代磷酸盐合成酶有两种亚型,其中一型含硒半胱氨酸,催化硒离子磷酸化成硒代磷酸盐的反应,这是合成含硒蛋白质的必备原料(图[82])。
- 硒蛋白质P(Selenoprotein P)
- 这是硒的运输蛋白质。有移除自由基的作用,具有抗氧化剂的功能。当体内的硒含量不足时,硒蛋白质P会优先获得硒。
- 硒蛋白质W(Selenoprotein W)
- 含有硒半胱氨酸,主要存在心肌、骨骼肌和其它组织的细胞质中,可能扮演抗氧化剂的功能。
硒蛋白生合成分子机制
硒蛋白的硒胺酸是在转译过程合成并直接利用的,称为转译插入反应(translational incorporation)。合成途径需要的蛋白质有:硒胺酸合成酶selenocysteine synthase(英语:L-seryl-tRNASec_selenium_transferase)、硒半胱胺酸专用延长因子selenocysteine-specific elongation factor、selenocysteine-specific tRNA(tRNASec)、硒代磷酸盐合成酶 selenophosphate synthetase(英语:selenophosphotate synthase 1)。硒胺酸对应的基因密码是UGA,此密码通常当做终止密码,但若配合mRNA序列3’端未转译区域具有独特的二级结构selenocysteine insertion sequence(英语:selenocysteine insertion sequence),则成为转译硒胺酸的密码。
自然界中有许多细菌、植物或动物都能利用硒化氢(hydrogen selenide)合成多种有机化合物,如大蒜中的selenide garlic就是含有高单位的Se-methylselenocysteine。人类需要直接摄取有机的硒化物。自然界中甲硒甲硫胺酸(selenomethionine)插入硒蛋白(selenoprotein)中是直接取代甲硫胺酸(methionine)的位置而得。也就是说在含甲硒胺酸的蛋白质合成过程是直接把甲硒胺酸当作甲硫胺酸编入,并没有特殊密码。人类再利用甲硒胺酸释出的硒,先合成磷酸硒(selenophosphate)再生成硒半胱胺酸(selenocysteine,Sec)或其他小分子,再利用UGA的密码将Sec编入人体的特殊蛋白硒蛋白质。人体硒的储存者可能是硒蛋白质 P(selenoprotein p),在已被发现的14种硒蛋白质中只有硒蛋白质 P含有10到12个Sec,其Sec数可以随血中硒的浓度而改变。其他的硒蛋白质都只有单一个Sec。所以硒带蛋白质 P可能是人类硒的储存池,当食物中硒供应不足时硒蛋白质 P就会释出硒供人体利用,但是 至今仍无法证实其功能。
合成反应主要有四个步骤(图示[83])
- 步骤一:tRNASec与Serine经由Seryl-tRNA synthetase作用,生成Seryl-tRNASec。
- 步骤二: 硒离子和ATP经由硒代磷酸盐(英语:selenophosphotate synthase 1)合成酶反应生成硒代磷酸盐。
- 步骤三:Seryl-tRNASec和硒代磷酸盐经由硒胺酸合成酶作用,产生含硒氨基酸残基Selenocysteyl-tRNASec。
- 步骤四:转译时由SBP2和SECIS结合,继而和tRNASec-eEFsec复合物结合,再与核糖体作用而诱导硒胺酸插入蛋白质(图示[84])。
缺乏与毒性
- 动物缺硒
硒缺乏会引起牲畜类动物疾病。硒缺乏造成硒蛋白质酵素活性下降。若硒以外之营养状况良好,硒缺乏仅造成轻微的临床症状。若伴有营养不良、化学药物、感染等压力,则会动物会出现严重病症。例如:硒缺乏加上维生素 E缺乏可导致大鼠与猪的之脂质过氧化与肝脏坏死,使猪、牛、羊的心脏损伤。在受感染的小鼠体内,硒缺乏可导致非致病性的coxsackie B3病毒转变为具致病性的病毒,而造成小鼠的心肌炎。
- 人体缺硒
- 化合物形式与毒性
元素态的硒和大部分的金属硒化物毒性较小,因为生物可用性(bioavailability)小。硒酸盐和亚硒酸盐的毒性较大,硒化氢(hydrogen selenide)的毒性最大,是一种气状的硒化合物。有机态硒化物如甲硒胺酸和硒胺酸与含硫氨基酸相似,因此毒性较无机态硒为低,但其吸收率高,虽不致造成急性毒害,但长期大量摄取,会产生与无机硒相似的中毒症状。
硒中毒(selenosis)可能发生在工人以及摄取过多硒的族群。目前订定硒的上限摄取量为每天400μg;硒的副作用发生最低量(LOAEL)为910 μg。摄食过量时,极易导致毛发异样、指甲脱落、脚趾甲异样等副作用,不过并无饮食硒中毒的案例。
中毒的严重程度与所摄取的硒含量成正比的关系。中毒的症状包含:反胃呕吐、疲劳、腹泻、头发与指甲损坏、异常刺痛感等,也会干扰硫的正常代谢以及抑制蛋白质合成。服用含有高量硒的药物会造成急性硒中毒,严重过量会导致肝硬化、pulmonary edema(英语:肺水腫),甚至丧命。治疗硒在体内不平衡所造成的症状目标:1.降低关节炎症状;2.降低血压;3.改善皮肤、毛发及指(趾)甲问题。
食物硒含量取决于土壤硒含量。美国虽有高硒地区,但农业部(USDA)已确认这些地区,并禁止饲养动物作为食物来源。美加地区食物运销系统发达,可确保个人不会只摄食到当地农产,保障民众硒摄取量不致过高或过低。
- 硒中毒的生化指标
硒蛋白质含量在硒需要量达到后,即呈现饱和状态,不再随硒摄取量增加而上升,因此无法被用于评估硒的毒性。测量组织(血液、血浆)的硒含量有助于评估硒中毒的危险性。尿液硒排除量在特定控制之条件下,可作为硒毒性的指标。临床症状如毛发、指甲易碎裂脱落等常被报导,是主要的评估终点。硒的甲基化代谢物因测量误差大,且受许多因素影响,不适用于硒中毒指标。
与其他营养素的关系
体内含铅量增多时会有硒浓度下降的现象。铜不足会降低榖胱甘肽过氧化酶和5'-脱碘酶的活性。硒与甲硫胺酸的利用有关。从食物摄取的硒有一部分是甲硒胺酸的形式,可作为合成蛋白质的材料。当甲硫胺酸供应不足时,甲硒胺酸会成为它的替代物而用在蛋白质的合成,而不会代谢成为硒离子以供利用,间接引发硒的不足。铁的缺乏会减少榖胱甘肽过氧化酶的合成,减少组织中的硒浓度。维生素E和榖胱甘肽过氧化酶同样有抗氧化的功能,在使细胞膜和DNA免于自由基的攻击机制上,硒和维生素E常一起作用,在功能上也有互补作用,其中一者浓度较高会减低另一浓度较低者所造成的影响[85]。
- 地球的地壳元素丰度列表
- 塞勒涅
- ^ Ruyle, George. Poisonous Plants on Arizona Rangelands (PDF). The University of Arizona. [2009-01-05]. (原始内容 (PDF)存档于2004-07-15).
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 2.6 2.7 House, James E. Inorganic chemistry. Academic Press. 2008: 524. ISBN 978-0-12-356786-4.
- ^ 3.0 3.1 3.2 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ YouTube上的加热硒影片
- ^ Jafar, Mousa M. Abdul-Gader; Saleh, Mahmoud H.; Ahmad, Mais Jamil A.; Bulos, Basim N.; Al-Daraghmeh, Tariq M. Retrieval of optical constants of undoped amorphous selenium films from an analysis of their normal-incidence transmittance spectra using numeric PUMA method. Journal of Materials Science: Materials in Electronics. 2016-04-01, 27 (4): 3281–3291. ISSN 0957-4522. doi:10.1007/s10854-015-4156-z (英语).
- ^ Saleh, Mahmoud H.; Ershaidat, Nidal M.; Ahmad, Mais Jamil A.; Bulos, Basim N.; Jafar, Mousa M. Abdul-Gader. Evaluation of spectral dispersion of optical constants of a-Se films from their normal-incidence transmittance spectra using Swanepoel algebraic envelope approach. Optical Review. 2017-06-01, 24 (3): 260–277. Bibcode:2017OptRv..24..260S. ISSN 1340-6000. doi:10.1007/s10043-017-0311-5 (英语).
- ^ Minkov, D.A.; Gavrilov, G.M.; Angelov, G.V.; Moreno, J.M.D.; Vazquez, C.G.; Ruano, S.M.F.; Marquez, E. Optimisation of the envelope method for characterisation of optical thin film on substrate specimens from their normal incidence transmittance spectrum. Thin Solid Films. 2018, 645: 370–378. Bibcode:2018TSF...645..370M. doi:10.1016/j.tsf.2017.11.003.
- ^ The half-life of 79Se. Physikalisch-Technische Bundesanstalt. 2010-09-23 [2012-05-29]. (原始内容存档于2011-09-27).
- ^ Jörg, Gerhard; Bühnemann, Rolf; Hollas, Simon; et al. Preparation of radiochemically pure 79Se and highly precise determination of its half-life. Applied Radiation and Isotopes. 2010, 68 (12): 2339–2351. PMID 20627600. doi:10.1016/j.apradiso.2010.05.006.
- ^ 82Se对于所有实际用途都可看做稳定
- ^ 11.0 11.1 11.2 Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick. Inorganic chemistry. San Diego: Academic Press. 2001: 583. ISBN 978-0-12-352651-9.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997: 780. ISBN 0-7506-3365-4.
- ^ Seppelt, K.; Desmarteau, Darryl D. Selenoyl difluoride. Inorganic Syntheses 20. 1980: 36–38. ISBN 978-0-471-07715-2. doi:10.1002/9780470132517.ch9. The report describes the synthesis of selenic acid.
- ^ Lenher, V. Action of selenic acid on gold. Journal of the American Chemical Society. April 1902, 24 (4): 354–355. doi:10.1021/ja02018a005.
- ^ Xu, Zhengtao. Devillanova, Francesco A. , 编. Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium. Royal Society of Chemistry. 2007: 460. ISBN 978-0-85404-366-8.
- ^ Proctor, Nick H.; Hathaway, Gloria J. Hughes, James P. , 编. Proctor and Hughes' chemical hazards of the workplace 5th. Wiley-IEEE. 2004: 625. ISBN 978-0-471-26883-3.
- ^ 17.0 17.1 17.2 《化学元素反应手册》. P528. 第三节 硒
- ^ Woollins, Derek; Kelly, Paul F. The Reactivity of Se4N4 in Liquid Ammonia. Polyhedron. 1993, 12 (10): 1129–1133. doi:10.1016/S0277-5387(00)88201-7.
- ^ Kelly, P.F.; Slawin, A.M.Z.; Soriano-Rama, A. Use of Se4N4 and Se(NSO)2 in the preparation of palladium adducts of diselenium dinitride, Se2N2; crystal structure of [PPh4]2[Pd2Br6(Se2N2)]. Dalton Transactions. 1997, (4): 559–562. doi:10.1039/a606311j.
- ^ Siivari, Jari; Chivers, Tristram; Laitinen, Risto S. A simple, efficient synthesis of tetraselenium tetranitride. Inorganic Chemistry. 1993, 32 (8): 1519–1520. doi:10.1021/ic00060a031.
- ^ Erker, G.; Hock, R.; Krüger, C.; Werner, S.; Klärner, F.G.; Artschwager-Perl, U. Synthesis and Cycloadditions of Monomeric Selenobenzophenone. Angewandte Chemie International Edition in English. 1990, 29 (9): 1067–1068. doi:10.1002/anie.199010671.
- ^ Berzelius, J.J. Lettre de M. Berzelius à M. Berthollet sur deux métaux nouveaux [Letter from Mr. Berzelius to Mr. Berthollet on two new metals]. Annales de Chimie et de Physique. 2nd series. 1818, 7: 199–206 [2019-08-03]. (原始内容存档于2020-03-11) (法语). From p. 203: "Cependant, pour rappeler les rapports de cette dernière avec le tellure, je l'ai nommée sélénium." (However, in order to recall the relationships of this latter [substance (viz, selenium)] to tellurium, I have named it "selenium".)
- ^ Weeks, Mary Elvira. The discovery of the elements. VI. Tellurium and selenium. Journal of Chemical Education. 1932, 9 (3): 474. Bibcode:1932JChEd...9..474W. doi:10.1021/ed009p474.
- ^ Trofast, Jan. Berzelius' Discovery of Selenium. Chemistry International. 2011, 33 (5): 16–19 [2019-08-03]. (原始内容存档于2018-06-29). PDF (页面存档备份,存于互联网档案馆)
- ^ See:
- Smith, Willoughby. The action of light on selenium. Journal of the Society of Telegraph Engineers. 1873, 2 (4): 31–33 [2019-08-03]. doi:10.1049/jste-1.1873.0023. (原始内容存档于2021-01-03).
- Smith, Willoughby. Effect of light on selenium during the passage of an electric current. Nature. 20 February 1873, 7 (173): 303 [2019-08-03]. Bibcode:1873Natur...7R.303.. doi:10.1038/007303e0. (原始内容存档于2021-01-03).
- ^ Bonnier Corporation. Action of light on selenium. Popular Science. 1876, 10 (1): 116 [2019-08-03]. (原始内容存档于2020-03-17).
- ^ Levinshtein, M. E.; Simin, G. S. Earliest semiconductor device. Getting to Know Semiconductors. 1992-12-01: 77–79 [2019-08-03]. ISBN 978-981-02-3516-1. (原始内容存档于2020-03-17).
- ^ Winston, Brian. Media Technology and Society: A History: From the Telegraph to the Internet. 1998-05-29: 89 [2019-08-03]. ISBN 978-0-415-14229-8. (原始内容存档于2020-03-14).
- ^ Morris, Peter Robin. A History of the World Semiconductor Industry. 1990: 18 [2019-08-03]. ISBN 978-0-86341-227-1. (原始内容存档于2020-03-09).
- ^ Bergmann, Ludwig. Über eine neue Selen-Sperrschicht-Photozelle. Physikalische Zeitschrift. 1931, 32: 286–288.
- ^ Waitkins, G. R.; Bearse, A. E.; Shutt, R. Industrial Utilization of Selenium and Tellurium. Industrial & Engineering Chemistry. 1942, 34 (8): 899–910. doi:10.1021/ie50392a002.
- ^ Pinsent, Jane. The need for selenite and molybdate in the formation of formic dehydrogenase by members of the Coli-aerogenes group of bacteria. Biochem. J. 1954, 57 (1): 10–16. PMC 1269698
 . PMID 13159942. doi:10.1042/bj0570010.
. PMID 13159942. doi:10.1042/bj0570010.
- ^ Stadtman, Thressa C. Some Functions of the Essential Trace Element, Selenium. Trace Elements in Man and Animals 10. Trace Elements in Man and Animals 10. 2002: 831–836. ISBN 978-0-306-46378-5. doi:10.1007/0-306-47466-2_267.
- ^ Schwarz, Klaus; Foltz, Calvin M. Selenium as an Integral Part of Factor 3 Against Dietary Necrotic Liver Degeneration. Journal of the American Chemical Society. 1957, 79 (12): 3292–3293. doi:10.1021/ja01569a087.
- ^ Oldfield, James E. Selenium: A historical perspective. Selenium. Selenium. 2006: 1–6. ISBN 978-0-387-33826-2. doi:10.1007/0-387-33827-6_1.
- ^ Hatfield, D. L.; Gladyshev, V. N. How Selenium Has Altered Our Understanding of the Genetic Code. Molecular and Cellular Biology. 2002, 22 (11): 3565–3576. PMC 133838
 . PMID 11997494. doi:10.1128/MCB.22.11.3565-3576.2002.
. PMID 11997494. doi:10.1128/MCB.22.11.3565-3576.2002.
- ^ Native Selenium. Webminerals. [2009-06-06]. (原始内容存档于2009-07-15).
- ^ 38.0 38.1 Kabata-Pendias, A. Geochemistry of selenium. Journal of Environmental Pathology, Toxicology and Oncology. 1998, 17 (3–4): 173–177. PMID 9726787.
- ^ 39.0 39.1 Fordyce, Fiona. Selenium Geochemistry and Health. AMBIO: A Journal of the Human Environment. 2007, 36: 94–97. doi:10.1579/0044-7447(2007)36[94:SGAH]2.0.CO;2.
- ^ Wessjohann, Ludger A.; Schneider, Alex; Abbas, Muhammad; Brandt, Wolfgang. Selenium in chemistry and biochemistry in comparison to sulfur. Biological Chemistry. 2007, 388 (10): 997–1006. PMID 17937613. doi:10.1515/BC.2007.138.
- ^ Birringer, Marc; Pilawa, Sandra; Flohé, Leopold. Trends in selenium biochemistry. Natural Product Reports. 2002, 19 (6): 693–718. PMID 12521265. doi:10.1039/B205802M.
- ^ Amouroux, David; Liss, Peter S.; Tessier, Emmanuel; et al. Role of oceans as biogenic sources of selenium. Earth and Planetary Science Letters. 2001, 189 (3–4): 277–283. Bibcode:2001E&PSL.189..277A. doi:10.1016/S0012-821X(01)00370-3.
- ^ Haug, Anna; Graham, Robin D.; Christophersen, Olav A.; Lyons, Graham H. How to use the world's scarce selenium resources efficiently to increase the selenium concentration in food. Microbial Ecology in Health and Disease. 2007, 19 (4): 209–228. PMC 2556185
 . PMID 18833333. doi:10.1080/08910600701698986.
. PMID 18833333. doi:10.1080/08910600701698986.
- ^ Public Health Statement: Selenium (PDF). Agency for Toxic Substances and Disease Registry. [2009-01-05]. (原始内容存档 (PDF)于2009-01-15).
- ^ Public Health Statement: Selenium – Production, Import/Export, Use, and Disposal (PDF). Agency for Toxic Substances and Disease Registry. [2009-01-05]. (原始内容存档 (PDF)于2009-01-15).
- ^ Chemistry: Periodic Table: selenium: key information. webelements. [2009-01-06]. (原始内容存档于2008-05-09).
- ^ Bartos, P. J. SX-EW copper and the technology cycle. Resources Policy. 2002, 28 (3–4): 85–94. doi:10.1016/S0301-4207(03)00025-4.
- ^ 48.0 48.1 48.2 Naumov, A. V. Selenium and tellurium: State of the markets, the crisis, and its consequences. Metallurgist. 2010, 54 (3–4): 197–200. doi:10.1007/s11015-010-9280-7.
- ^ Hoffmann, James E. Recovering selenium and tellurium from copper refinery slimes. JOM. 1989, 41 (7): 33–38. Bibcode:1989JOM....41g..33H. doi:10.1007/BF03220269.
- ^ Hyvärinen, Olli; Lindroos, Leo; Yllö, Erkki. Recovering selenium from copper refinery slimes. JOM. 1989, 41 (7): 42–43. Bibcode:1989JOM....41g..42H. doi:10.1007/BF03220271.
- ^ 51.0 51.1 Selenium and Tellurium: Statistics and Information. United States Geological Survey. [2012-05-30]. (原始内容存档于2012-05-08).
- ^ Sun, Yan; Tian, Xike; He, Binbin; et al. Studies of the reduction mechanism of selenium dioxide and its impact on the microstructure of manganese electrodeposit. Electrochimica Acta. 2011, 56 (24): 8305–8310. doi:10.1016/j.electacta.2011.06.111.
- ^ Bernd E. Langner "Selenium and Selenium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. doi:10.1002/14356007.a23_525.
- ^ Davis, Joseph R. Copper and Copper Alloys. ASM Int. 2001: 91 [2019-08-10]. ISBN 978-0-87170-726-0. (原始内容存档于2020-03-08).
- ^ Isakov, Edmund. Cutting Data for Turning of Steel. 2008-10-31: 67 [2019-08-10]. ISBN 978-0-8311-3314-6. (原始内容存档于2020-03-18).
- ^ Gol'Dshtein, Ya. E.; Mushtakova, T. L.; Komissarova, T. A. Effect of selenium on the structure and properties of structural steel. Metal Science and Heat Treatment. 1979, 21 (10): 741–746. Bibcode:1979MSHT...21..741G. doi:10.1007/BF00708374.
- ^ Davis, Joseph R. Copper and Copper Alloys. ASM International. 2001: 278 [2019-08-10]. ISBN 978-0-87170-726-0. (原始内容存档于2020-03-21).
- ^ Eftekhari, Ali. The rise of lithium–selenium batteries. Sustainable Energy & Fuels. 2017, 1: 14–29. doi:10.1039/C6SE00094K.
- ^ Deutsche Gesellschaft für Sonnenenergie. Copper indium diselenide (CIS) cell. Planning and Installing Photovoltaic Systems: A Guide for Installers, Architects and Engineers. Earthscan. 2008: 43–44 [2019-08-10]. ISBN 978-1-84407-442-6. (原始内容存档于2020-03-16).
- ^ Wee Chong Tan. Optical Properties of Amorphous Selenium Films (PDF) (Master of Science论文). University of Saskatchewan. July 2006 [2019-08-10]. (原始内容 (PDF)存档于2015-11-29).
- ^ Direct vs. Indirect Conversion 互联网档案馆的存档,存档日期January 2, 2010,.
- ^ Springett, B. E. Application of Selenium-Tellurium Photoconductors to the Xerographic Copying and Printing Processes. Phosphorus and Sulfur and the Related Elements. 1988, 38 (3–4): 341–350. doi:10.1080/03086648808079729.
- ^ Williams, Rob. Computer Systems Architecture: A Networking Approach. Prentice Hall. 2006: 547–548 [2019-08-10]. ISBN 978-0-321-34079-5. (原始内容存档于2020-03-21).
- ^ Diels, Jean-Claude; Arissian, Ladan. The Laser Printer. Lasers. Wiley-VCH. 2011: 81–83 [2019-08-10]. ISBN 978-3-527-64005-8. (原始内容存档于2020-03-16).
- ^ Meller, Gregor & Grasser, Tibor. Organic Electronics. Springer. 2009: 3–5 [2019-08-10]. ISBN 978-3-642-04537-0. (原始内容存档于2020-03-09).
- ^ Normile, Dennis. The birth of the Blues. Popular Science. 2000: 57 [2019-08-10]. (原始内容存档于2020-03-21).
- ^ Kasap, Safa; Frey, Joel B.; Belev, George; et al. Amorphous selenium and its alloys from early xeroradiography to high resolution X-ray image detectors and ultrasensitive imaging tubes. Physica Status Solidi B. 2009, 246 (8): 1794–1805. Bibcode:2009PSSBR.246.1794K. doi:10.1002/pssb.200982007.
- ^ Svelto, Orazio. Principles of LASERs fourth ed. Plenum. 1998: 457. ISBN 978-0-306-45748-7.
- ^ Hai-Fu, F.; Woolfson, M. M.; Jia-Xing, Y. New Techniques of Applying Multi-Wavelength Anomalous Scattering Data. Proceedings of the Royal Society A: Mathematical, Physical and Engineering Sciences. 1993, 442 (1914): 13–32. Bibcode:1993RSPSA.442...13H. doi:10.1098/rspa.1993.0087.
- ^ MacLean, Marion E. A project for general chemistry students: Color toning of photographic prints. Journal of Chemical Education. 1937, 14 (1): 31. Bibcode:1937JChEd..14...31M. doi:10.1021/ed014p31.
- ^ Penichon, Sylvie. Differences in Image Tonality Produced by Different Toning Protocols for Matte Collodion Photographs. Journal of the American Institute for Conservation. 1999, 38 (2): 124–143. JSTOR 3180042. doi:10.2307/3180042.
- ^ McKenzie, Joy. Exploring Basic Black & White Photography. Delmar. 2003: 176 [2019-08-10]. ISBN 978-1-4018-1556-1. (原始内容存档于2020-05-02).
- ^ Hayward, Peter; Currie, Dean. Radiography of Welds Using Selenium 75, Ir 192 and X-rays (PDF). [2019-08-10]. (原始内容存档 (PDF)于2019-05-30).
- ^ Gropper SS, Groff JL, et al. (2005)Advanced Nutrition and Human Metabolism, 4th ed., pp. 456-461. Wardswirth, ISBN 0-534-55986-7
- ^ Gordon M. Wardlaw, Jeffery S. Hampl Perspectives in Nutrition, 7th edition, P.422
- ^ 76.0 76.1 76.2 行政院卫生署(2003)国人膳食营养素参考摄取量及其说明,修订第六版,pp. 422-447。台湾行政院卫生署,ISBN 957-01-4677-X
- ^ 77.0 77.1 77.2 Institute of Medicine (2000) Dietary Reference Intakes for Vitamin C, Vitamin E, Selenium, and Carotenoids, pp. 284-324. National Academy Press, ISBN 0-309-06949-1
- ^ 存档副本. [2008-11-14]. (原始内容存档于2007-08-08).
- ^ 存档副本. [2008-11-14]. (原始内容存档于2008-02-20).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2010-06-03).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2005-04-09).
- ^ 存档副本. [2008-01-10]. (原始内容存档于2009-01-13).
- ^ http://www.freepatentsonline.com/20050048548-0-large.jpg
- ^ http://www.nature.com/ng/journal/v37/n11/images/ng1105-1162-F1.gif
- ^ Gropper SS, Groff JL, et al. Advanced Nutrition and Human Metabolism, 5th ed., pp. 511,318.
| 维基共享资源中相关的多媒体资源:硒 |
| 查看维基词典中的词条“selenium”。 |
- 元素硒在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 硒(英文)
- 元素硒在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素硒在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 硒(英文)
- Selenium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos (University of Nottingham)
- National Institutes of Health page on Selenium (页面存档备份,存于互联网档案馆)
- Assay (页面存档备份,存于互联网档案馆)
- ATSDR – Toxicological Profile: Selenium (页面存档备份,存于互联网档案馆)
- CDC - NIOSH Pocket Guide to Chemical Hazards (页面存档备份,存于互联网档案馆)