碲(拼音:dì,注音:ㄉㄧˋ,粤拼:dai3;英语:Tellurium),是一种化学元素,其化学符号为Te,原子序数为52,原子量为127.6 u,是银白色的类金属。碲的化学性质与硒及硫类似,它们都是氧族元素。它偶尔会以天然的元素晶体被发现。碲在整个宇宙中比在地球上常见得多。它在地壳中极端稀有,可与铂相比,部分原因是因为它会形成挥发性氢化物,导致碲在地球热星云形成过程中就流失到太空,[3]而且碲对氧的亲和力低,这导致它优先与沉入核心的致密矿物中的其他亲硫元素结合。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银灰色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 碲(Tellurium)·Te·52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 类金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 16 ·5·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 127.6(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪]4d10 5s2 5p4 2, 8, 18, 18, 6 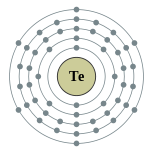 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 弗朗茨-约瑟夫·米勒·冯·赖兴施泰因(1782年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 马丁·克拉普罗特 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 6.24 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 5.70 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 722.66 K,449.51 °C,841.12 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 1261 K,988 °C,1810 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 17.49 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 114.1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 25.73 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 6, 5, 4, 2, -2 (弱酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.1(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:869.3 kJ·mol−1 第二:1790 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 140 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 138±4 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 206 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 1.97–3.38 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)2610 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 43 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 16 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 65 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 2.25 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 180 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 13494-80-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:碲的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
碲化物矿物于1782年首次在特兰西瓦尼亚的Kleinschlatten(今罗马尼亚的兹拉特纳)的一个金矿中由奥地利矿物学家弗朗茨-约瑟夫·米勒·冯·赖兴施泰因发现的,尽管是马丁·克拉普罗特在1798年以拉丁语"tellus"(意为地球)命名了这个新元素。碲化金矿物是最显着的天然金化合物。然而,它们本身并不是碲的重要商业来源,它通常是作为铜和铅生产的副产品提取的。
在商业上,碲的主要用途是制造铜(碲铜)和钢合金,可以提高机械加工性。碲化镉太阳能板和碲化镉半导体中的应用也消耗了相当一部分碲生产。碲被认为是技术关键元素。
碲没有生物学功能,尽管真菌可以用它代替氨基酸中的硫和硒,例如碲半胱氨酸和碲甲硫氨酸。[4]在人体中,碲会部分代谢为二甲基碲 (CH3)2Te,一种具有大蒜味的气体,存在于暴露于碲或碲中毒的受害者的呼吸中。
物理性质
碲有两种同素异形体,晶体和无定形体。碲晶体是银白色的,有金属光泽。这些晶体是三方晶系的,具有手性(空间群为152或154),这点类似灰硒。它是一种脆且容易粉碎的类金属。无定形碲是从亚碲酸或碲酸(Te(OH)6)溶液中沉淀出来的黑褐色粉末。[5] 碲是一种半导体,根据原子的排列,它在某些方向上会显示出更大的导电性。当暴露在光线下时,碲的电导率略有增加(光电导效应)。[6]熔化的碲对铜、铁和不锈钢具有腐蚀性。在氧族元素中,碲有最高的熔点和沸点,分别为722.66 K(449.51 °C) 和1,261 K(988 °C)。[7]
化学性质
碲不溶于水和盐酸,可以和硝酸或硫酸反应。和金反应产生碲化金。碲和同族的硫、硒一样,在空气中燃烧的产物是二氧化物——TeO2。[8]
同位素
有八种碲的同位素在自然界中存在。其中六种——120Te、122Te、123Te、124Te、125Te和126Te是稳定的。剩下的两种——128Te 和130Te有微弱的放射性,[9][10][11]半衰期极长,其中128Te的半衰期为2.2 × 1024年,为所有放射性同位素中最长的。[12]这约为宇宙年龄的160 兆 (1012) 倍。稳定同位素只占了天然碲的33.2%。
除了这些同位素,碲还有31种放射性同位素,原子量在104至142之间,半衰期都在19天以下。此外,碲也有17种同核异构体,半衰期可达154天。除了铍-8和一些较轻的核素中的β延迟α衰变分支,碲(104Te 至109Te)是会进行α衰变的最轻元素。[9]
碲的原子量 (127.60 g·mol−1) 比下一个元素碘 (126.90 g·mol−1)还高。[13]
存在


在地球地壳中,碲是最稀有的固体元素之一,可以和铂比较(约 1 µg/kg)。[14]作为比较,即使是稳定镧系元素中丰度最低的铥也有 500 µg/kg的丰度。[15]
地壳中碲的这种稀有性并不是其宇宙丰度的反映。在宇宙中碲比铷常见,尽管在地壳中铷的丰度是碲的10000倍。地球上碲很稀有的原因被认为是由太阳星云中吸积前分选过程中的条件引起的。当时某些元素的稳定形式在没有氧气和水的情况下,由还原性的自由氢控制。在这种情况下,会形成挥发性氢化物的某些元素,例如碲,会通过这些氢化物的蒸发而严重耗尽。碲和硒是在这个过程中消耗最严重的重元素。[3]
碲有时以单质存在,但更常见的是作为金的碲化物,例如碲金矿和白碲金银矿(AuTe2的两种不同同质异形体)、碲金银矿 Ag3AuTe2 和针碲金银矿 AgAuTe4。特柳赖德镇的命名是希望这里有金的碲化物矿物(尽管在那里发现了金矿石,但这个愿望从未实现)。金本身通常以单质存在,但当作为化合物发现时,它最常与碲结合。
尽管碲与金的结合形式比未结合的单质形式更常见,但它更常以更常见金属的碲化物出现(例如melonite NiTe2)。天然亚碲酸盐和碲酸盐矿物也是存在的,由地球表面附近的碲化物矿物氧化形成。与硒相反,碲通常不会取代矿物中的硫,因为它们的离子半径差异很大。因此,许多常见的硫化物矿物中含有大量的硒,但碲很少。[16]
在1893年的淘金热中,卡尔古利的矿工在寻找纯金时丢弃了一种类似黄铁矿的材料,用于填补坑洼和修建人行道。1896年,这种材料被发现是碲金矿,一种金的碲化物,并引发了第二次淘金热,包括在街道上采矿。[17]

碲(名称来自拉丁文 tellus,意为地球)于18世纪在罗马尼亚,靠近今天的阿尔巴县市的Kleinschlatten(今兹拉特纳)附近的金矿中发现。1782年,当时担任奥地利特兰西瓦尼亚矿山首席检查员的弗朗茨-约瑟夫·米勒·冯·赖兴施泰因得出结论,认为该矿石不含锑,但含有硫化铋。[18]第二年,他报告说这是错误的,矿石中主要含有金和一种与锑非常相似的未知金属。经过三年的彻底调查和五十多次测试,米勒确定了矿物的比重,并指出当加热时,这种新金属会散发出白烟和类似萝卜的气味。它的硫酸溶液是红色的,并且当该溶液用水稀释时,会产生黑色沉淀物。尽管如此,他还是无法识别出这种金属,并给它起了名字aurum paradoxum(矛盾的金)和metallum Problemum(问题金属),因为它没有表现出和锑一样的特性。[19][20][21]
1789年,匈牙利科学家Pál Kitaibel在来自瑙吉伯尔热尼的矿石中独立发现了这种元素。该元素曾被认为是含银的辉钼矿,但后来他将其归功于米勒。1798年,早先将碲从矿物碲金矿中分离出来马丁·克拉普罗特命名了这个元素。[22][20][21][23]
1960年代,碲以碲化铋的形式用于热电应用,也用于易加工钢合金,成为碲的主要用途。[24]
大多数的碲和硒是从斑岩铜矿中获得的。[25]该元素是从阳极污泥中回收的,这些元素来自气泡铜的电解精炼。它也是高炉精炼铅产生的粉尘的成分。1000吨的铜矿中,可以提取到一千克的碲。
阳极污泥中包含抗腐蚀金属的硒化物和碲化物,化学式 M2Se 或M2Te (M = Cu、Ag、Au)。在500°C的温度下,阳极污泥在空气中与碳酸钠一起焙烧。金属离子被还原为金属,而碲化物则转化为亚碲酸钠。[26]
亚碲酸盐可以与水从混合物中浸出,通常以亚碲酸氢盐 HTeO3- 的形式存在于溶液中。亚硒酸盐在此过程中也会形成,但可以通过添加硫酸将它们分开。亚碲酸氢盐会转化成不溶的二氧化碲,而亚硒酸盐则留在溶液中。[26]
通过电解或与二氧化硫在硫酸中反应,可以把氧化物还原成碲单质。[26]
商业级碲通常以200筛目的粉末的形式销售,但板状、锭状、棒状或块状的碲也是可商购的。2000年,碲的价格为每磅14美元。近年来,碲的价格因需求增加和有限的供应而上涨,使得2006年的碲价高达每磅100美元。[27][28] 尽管期望改进的生产方法将使碲产量翻倍,美国能源部仍预计到了2025年,碲的供应将会短缺。[29]
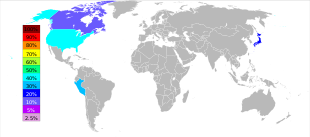
碲主要产于美国、秘鲁、日本和加拿大。[30]英国地质调查局给出了2009年的碲产量数据:美国50吨,秘鲁7吨,日本40吨,加拿大16吨。[31]
在元素周期表中,碲属于氧族元素。碲化合物和对应的硒化合物类似。碲表现出氧化态 −2、+2、+4 和+6,其中+4 态最常见。[5]
碲化物
还原金属碲会产生碲化物和多碲化物 Ten2−。碲的-2价态存在于和许多金属形成的二元化合物中,例如碲化锌 ZnTe,由碲和锌直接加热反应而成。[32]ZnTe 和盐酸反应,生成碲化氢(H2Te),一种和其它氧族元素氢化物如H2O、H2S 和H2Se相比非常不稳定的同类物。
H2Te 不稳定,但它的共轭碱 [TeH]− 形成的盐稳定。
卤化物
碲的+2氧化态存在于二卤化物 TeCl2、TeBr2 和TeI2中。它们都还没得到纯品,[33]:274尽管它们已知在有机溶剂中会分解成四卤化物,而相关的四卤合碲(II)酸盐已获得表征:
(X = Cl、Br、I)
这些离子都是平面正方形分子构型的。[33]:281碲的多核阴离子也是已知的,例如深棕色的 Te2I2−6[33]:283 和黑色的 Te4I2−14。[33]:285
碲的氟化物有混合价态化合物 Te2F4 和TeF6。+6氧化态的–OTeF5 基团存在于许多化合物中,如HOTeF5、B(OTeF5)3、Xe(OTeF5)2、Te(OTeF5)4 和Te(OTeF5)6。[34]四角反棱柱形的阴离子 TeF2−8 也是存在的。[26]其它卤素形成不了+6氧化态,只能形成+4氧化态的四卤化物(TeCl4、TeBr4 和TeI4)和低卤化物(Te3Cl2、Te2Cl2、Te2Br2、Te2I 和两种 TeI)。在 +4 氧化态中,卤碲酸根是已知的,如TeCl2−6 和Te2Cl2−10。含卤碲阳离子也是已知的,包括存在于TeI3AsF6的 TeI+3。[35]
含氧化合物

一氧化碲于1883年首次报道为黑色无定形固体,由 TeSO3 在真空中热分解形成,加热歧化成碲单质和二氧化碲 TeO2。[36][37]然而,从那时起,固相一氧化碲的存在就受到怀疑和争议,尽管它的蒸气分子是已知的。这种黑色固体可能只是元素碲和二氧化碲的等摩尔混合物。[38]
在空气中加热碲会产生蓝色火焰,并形成二氧化碲。[32]三氧化碲的一种结构 β-TeO3是由 Te(OH)6热分解而成的。另外两种结构——α-相和γ- 相并不是真正的氧化碲(VI),而是 Te4+、OH− 和O−2的混合物。[39] 碲也有各种混合氧化物,如Te2O5 和Te4O9。[39]
碲的氧化物和水合氧化物会产生一系列的酸,包括亚碲酸 (H2TeO3)、原碲酸 (Te(OH)6) 和偏碲酸 ((H2TeO4)n)。[38]偏碲酸和原碲酸会分别形成含有 TeO2–4 和TeO6−6 阴离子的碲酸盐,而亚碲酸则形成含 TeO2−3阴离子的亚碲酸盐。
Zintl阳离子
当碲用浓硫酸处理时,会得到碲的Zintl离子 Te2+4的红色溶液。[40]碲被AsF5在液态SO2中氧化,会产生正方形的 Te2+4和黄橙色、三角柱形的 Te4+6:[26]
其它碲的Zintl阳离子包括聚合物 Te2+7,以及由两个五元碲环组成、蓝黑色的 Te2+8。后者可以通过碲和六氯化钨反应而成:[26]
含有其它氧族元素的离子也是已知的,例如 Te2Se2+6(扭曲立方体结构)和 Te2Se2+8。它们都是由 AsF5 或SbF5氧化硒和碲的混合物而成的。[26]
有机碲化合物
碲并不准备形成碲醇——具有-TeH 基团的化合物,为醇和硫醇的类似物。[41]类似H2Te,这些物种对损失氢气不稳定。碲醚 (R–Te–R) 和碲代亚砜都比较稳定。
碲的最大消费者是铁、不锈钢、铜和铅合金的冶金业。碲添加到钢和铜中产生的合金会比其他合金更易加工。为了光谱学研究,碲被加入到铸铁中以促进冷却,因为其中导电的游离石墨存在往往会干扰火花发射测试的结果。碲添加到铅中可以提高强度和耐久性,并降低了硫酸的腐蚀作用。[24][42]
多相催化
碲的氧化物是商业氧化催化剂的成分。含碲催化剂可用于氨氧化制备丙烯腈 (CH2=CH–C≡N)的催化剂:[43]
相关催化剂也用于制备1,4-丁二醇:
小众用途
- 用碲交联的合成橡胶在某些方面显示出优于硫化材料的机械和热性能。[44][43]
- 碲化合物是用于陶瓷器的特殊颜料。[45]
- 硒化物和碲化物大大增加了广泛用于电信玻璃光纤的玻璃的光学折射。[46][47]
- 硒和碲的混合物与过氧化钡一起用作电雷管的延迟粉中的氧化剂。[48]
- 用中子轰击碲是碘-131最常用的制备方式。[49]碘-131可用于治疗某些甲状腺的病症,也是水力压裂中的示踪剂化合物。
半导体和电
由于其低电负性,碲可以形成多种带隙较小的材料,可通过波长相对长的光。这一特性是光电导材料、太阳能电池和红外探测器潜在应用的基础。阻碍这些应用的主要问题是这些材料的稳定性和对环境影响的担忧。

碲化镉 (CdTe) 太阳能光伏展示了太阳能发电机的最高效率。[50]
基于(Cd,Zn)Te的X射线探测器已被证明可行。[51]
碲化汞镉是一种对红外线敏感的半导体材料。[52]
有机碲化合物
有机碲化合物主要在研究中受到关注。人们已经检查了多种用于有机金属化学气相沉积法生长 II-VI 半导体材料的前体。这些前体包括二甲基碲、二乙基碲、二异丙基碲、二烯丙基碲和甲基烯丙基碲。[53]二异丙基碲 (DIPTe) 是通过有机金属化学气相沉积法低温生长 CdHgTe 的首选前体。[54]在这些过程中会使用最高纯度的有机硒化合物和有机碲化合物,这些用于半导体工业的化合物是通过加合物纯化制备的。[55][56]
低氧化碲用于可重写光盘的媒体层,包括可重复刻录光碟(CD-RW)、可重写数字视频光盘(DVD-RW)和可重写蓝光光盘。[57][58]
二氧化碲用于制造共聚焦显微镜的声光调制器(AOTF和AOBS)。
碲也用于英特尔开发[59]的相变化存储器芯片。[60] 碲化铋 (Bi2Te3) 和碲化铅都是热电设备的工作元件材料。碲化铅在远红外线探测器中有前景。
光阴极
碲出现在许多用于光电倍增管的光阴极中[61]和用于驱动现代粒子加速器的高亮度光喷射器。主要是 Cs2Te组成的Cs-Te光电阴极具有 3.5 eV 的光电发射阈值,并表现出高量子效率 (>10%) 和在恶劣真空环境中的高耐久性(可使用数月)。[62]这使其成为用于驱动自由电子激光器的光发射电子枪的首选。[63]在此应用中,它通常用267 nm的波长驱动,这是常用钛蓝宝石激光器的三次谐波。人们已经使用其他碱金属(例如铷、钾和钠)制造了更多含碲的光电阴极,但它们没有像 Cs-Te光电阴极那样受欢迎。[64][65]
碲没有已知的生物作用,尽管真菌可以将它替代硫和硒掺入氨基酸中,例如碲半胱氨酸和碲甲硫氨酸。[4][66]生物体对碲化合物表现出高度可变的耐受性。很多细菌,例如Pseudomonas aeruginosa会吸收亚碲酸盐并将其还原为元素碲,而元素碲会积累并导致细胞显着变暗。[67]在酵母中,这种还原是由硫酸盐途径介导的。[68]碲的积累似乎是其毒性作用的主要部分。许多生物也会部分代谢碲以形成二甲基碲,尽管某些物种形成的是二甲基二碲。在温泉中有浓度非常低的二甲基碲。[69][70]
亚碲酸盐琼脂用于鉴定棒状杆菌属的成员,例如Corynebacterium diphtheriae——导致白喉的病原体。[71]
| 碲 | |
|---|---|

| |
| 危险性 | |
GHS危险性符号  
| |
| GHS提示词 | Danger |
| H-术语 | H317, H332, H360, H412[72] |
| P-术语 | P201, P261, P280, P308+313[73] |
| NFPA 704 |
 0
2
0
|
| 若非注明,所有数据均出自一般条件(25 ℃,100 kPa)下。 | |
碲和碲化合物被认为有轻度毒性,需要小心处理,尽管急性碲中毒很少见。[74]碲中毒非常难以治疗,因为在治疗金属中毒时使用的许多螯合剂都会增加碲的毒性。碲没有致癌的报道。[74]
人类暴露含碲低至 0.01mg/m3 或更少的空气中会散发出类似大蒜的恶臭,称为“碲口气”。[45][75] 这是由于身体将碲从任何氧化态转化为二甲基碲 (CH3)2Te导致的。二甲基碲是一种挥发性的化合物,具有刺鼻的大蒜味。尽管碲的代谢途径未知,但通常认为它类似于研究更广泛的硒,因为这两种元素的最终甲基化代谢产物相似。[76][77][78]
人们可以通过吸入、摄入、皮肤接触和眼睛接触在工作场所接触碲。职业安全与健康管理局 (OSHA) 将工作场所中的碲暴露量限制(允许暴露极限)为八小时工作日里 0.1 mg/m3。美国国家职业安全卫生研究所 (NIOSH) 将八小时工作日的推荐暴露限值 (REL) 设为 0.1 mg/m3。在25 mg/m3的浓度下,碲就会立即危及生命或健康。[79]
- 氧族元素
- ^ Tellurium (页面存档备份,存于互联网档案馆), mindat.org
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 3.0 3.1 Anderson, Don L.; "Chemical Composition of the Mantle" in Theory of the Earth, pp. 147-175 ISBN 0865421234
- ^ 4.0 4.1 Ramadan, Shadia E.; Razak, A. A.; Ragab, A. M.; El-Meleigy, M. Incorporation of tellurium into amino acids and proteins in a tellurium-tolerant fungi. Biological Trace Element Research. 1989, 20 (3): 225–32. PMID 2484755. S2CID 9439946. doi:10.1007/BF02917437.
- ^ 5.0 5.1 Leddicotte, G. W. The radiochemistry of tellurium (PDF). Nuclear science series (3038). Subcommittee on Radiochemistry, National Academy of Sciences-National Research Council: 5. 1961 [2021-11-04]. (原始内容存档 (PDF)于2021-11-06).
- ^ Berger, Lev Isaakovich. Tellurium. Semiconductor materials. CRC Press. 1997: 89–91. ISBN 978-0-8493-8912-2.
- ^ Periodic Table (页面存档备份,存于互联网档案馆). ptable.com
- ^ 《化学元素综论》. 周公度 叶宪曾 吴念祖 编. 科学出版社. P173. 52 碲 Tellurium. ISBN 978-7-03-035615-4
- ^ 9.0 9.1 Audi, G.; Bersillon, O.; Blachot, J.; Wapstra, A. H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729 (1): 3–128 [2021-10-31]. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容存档于2021-11-04).
- ^ WWW Table of Radioactive Isotopes: Tellurium. Nuclear Science Division, Lawrence Berkeley National Laboratory. 2008 [2010-01-16]. (原始内容存档于2010-02-05).
- ^ Alessandrello, A.; Arnaboldi, C.; Brofferio, C.; Capelli, S.; Cremonesi, O.; Fiorini, E.; Nucciotti, A.; Pavan, M.; Pessina, G.; Pirro, S.; Previtali, E.; Sisti, M.; Vanzini, M.; Zanotti, L.; Giuliani, A.; Pedretti, M.; Bucci, C.; Pobes, C. New limits on naturally occurring electron capture of 123Te. Physical Review C. 2003, 67 (1): 014323. Bibcode:2003PhRvC..67a4323A. S2CID 119523039. arXiv:hep-ex/0211015
 . doi:10.1103/PhysRevC.67.014323.
. doi:10.1103/PhysRevC.67.014323.
- ^ Noble Gas Research. Laboratory for Space Sciences, Washington University in St. Louis. 2008 [2013-01-10]. (原始内容存档于September 28, 2011).
- ^ Emsley, John. Tellurium. Nature's building blocks: an A-Z guide to the elements. Oxford University Press. 2003: 426–429. ISBN 978-0-19-850340-8.
- ^ Ayres, Robert U.; Ayres, Leslie. A handbook of industrial ecology. Edward Elgar Publishing. 2002: 396 [2021-10-31]. ISBN 1-84064-506-7. (原始内容存档于2021-12-04).
- ^ Suess, Hans; Urey, Harold. Abundances of the Elements. Reviews of Modern Physics. 1956, 28 (1): 53–74. Bibcode:1956RvMP...28...53S. doi:10.1103/RevModPhys.28.53.
- ^ Nekrasov, I. Y. Phase Relations in the Selenide Telluride Systems. Geochemistry, mineralogy and genesis of gold deposits. Taylor & Francis. 1996: 217–256 [2021-10-31]. ISBN 978-90-5410-723-1. (原始内容存档于2021-11-15).
- ^ Fortey, Richard. The Earth: An Intimate History. Harper Perennial. 2004: 230. ISBN 978-0-00-257011-4.
- ^ Müller, F. J. Über den vermeintlichen natürlichen Spiessglaskönig. Physikalische Arbeiten der Einträchtigen Freunde in Wien. 1783, 1 (1): 57–59 [2021-11-09]. (原始内容存档于2021-11-09).
- ^ von Reichenstein, F. J. M. Versuche mit dem in der Grube Mariahilf in dem Gebirge Fazebay bey Zalathna vorkommenden vermeinten gediegenen Spiesglaskönig [Experiments with supposedly native antimony occurring in the Mariahilf mine in the Fazeby mountains near Zalathna]. Physikalische Arbeiten der Einträchtigen Freunde in Wien. 1783, 1783 (1.Quartal): 63–69 [2021-11-09]. (原始内容存档于2021-11-09).
- ^ 20.0 20.1 Diemann, Ekkehard; Müller, Achim; Barbu, Horia. Die spannende Entdeckungsgeschichte des Tellurs (1782–1798) Bedeutung und Komplexität von Elemententdeckungen. Chemie in unserer Zeit. 2002, 36 (5): 334–337. doi:10.1002/1521-3781(200210)36:5<334::AID-CIUZ334>3.0.CO;2-1.
- ^ 21.0 21.1 Weeks, Mary Elvira. The discovery of the elements. VI. Tellurium and selenium. Journal of Chemical Education. 1932, 9 (3): 474–485. Bibcode:1932JChEd...9..474W. doi:10.1021/ed009p474.
- ^ Klaproth (1798) "Ueber die siebenbürgischen Golderze, und das in selbigen enthaltene neue Metall" (页面存档备份,存于互联网档案馆) (On the Transylvanian gold ore, and the new metal contained in it), Chemische Annalen für die Freunde der Naturlehre, Arzneygelahrtheit, Haushaltungskunst und Manufacturen (Chemical Annals for the Friends of Science, Medicine, Economics, and Manufacturing), 1 : 91–104. From page 100: (页面存档备份,存于互联网档案馆) " … ; und welchem ich hiermit den, von der alten Muttererde entlehnten, Namen Tellurium beylege." ( … ; and to which I hereby bestow the name tellurium, derived from the old Mother of the Earth.)
- ^ Weeks, Mary Elvira. The discovery of tellurium. Journal of Chemical Education. 1935, 12 (9): 403–408. Bibcode:1935JChEd..12..403W. doi:10.1021/ed012p403.
- ^ 24.0 24.1 George, Micheal W. Mineral Yearbook 2007: Selenium and Tellurium (PDF). United States geological Survey. 2007 [2021-11-14]. (原始内容存档于2021-11-14).
- ^ John, D. A.; Taylor, R. D. Chapter 7: By-Products of Porphyry Copper and Molybdenum Deposits. Philip L. Verplanck and Murray W. Hitzman (编). Rare earth and critical elements in ore deposits 18. 2016: 137–164 [2021-11-09]. (原始内容存档于2021-11-09).
- ^ 26.0 26.1 26.2 26.3 26.4 26.5 26.6 Wiberg, Egon; Holleman, Arnold Frederick. Nils Wiberg , 编. Inorganic chemistry. translated by Mary Eagleson. Academic Press. 2001: 588. ISBN 0-12-352651-5.
- ^ An Arizona tellurium rush?. arizonageology.blogspot.com. May 21, 2007 [2009-08-08]. (原始内容存档于2007-11-12).
- ^ Byproducts Part I: Is There a Tellurium Rush in the Making?. resourceinvestor.com. April 19, 2007 [2009-08-08]. (原始内容存档于2017-06-25).
- ^ Crow, James Mitchell. 13 elements you can't live without. New Scientist. 2011, 210 (2817): 39. Bibcode:2011NewSc.210...36C. doi:10.1016/S0262-4079(11)61452-8.
- ^ Addicks, Lawrence. By-Products. Copper Refining. Read books. 2008: 111–114 [2021-11-09]. ISBN 978-1-4437-3230-7. (原始内容存档于2021-12-12).
- ^ Brown, T. J. World mineral statistics British Geological Survey. Keyworth, Nottingham. 2011: 95 [2021-11-09]. ISBN 978-0-85272-677-8. (原始内容存档于2021-02-13).
- ^ 32.0 32.1 Roscoe, Henry Enfield; Schorlemmer, Carl. A treatise on chemistry 1. Appleton. 1878: 367–368.
- ^ 33.0 33.1 33.2 33.3 Emeleus, H. J. A. G. Sykes , 编. Advances in Inorganic Chemistry 35. Academic Press. 1990. ISBN 0-12-023635-4.
- ^ Holloway, John H.; Laycock, David. Preparations and Reactions of Inorganic Main-Group Oxide-Fluorides. Harry Julius Emeléus; A. G. Sharpe (编). Advances in inorganic chemistry and radiochemistry. Serial Publication Series 27. Academic Press. 1983: 174. ISBN 0-12-023627-3.
- ^ Xu, Zhengtao. Recent developments in binary halogen-chalcogen compounds, polyanions and polycations. Francesco A. Devillanova (编). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium
 . Royal Society of Chemistry. 2007: 457–466. ISBN 978-0-85404-366-8.
. Royal Society of Chemistry. 2007: 457–466. ISBN 978-0-85404-366-8.
- ^ Schwartz, Mel M. Tellurium. Encyclopedia of materials, parts, and finishes 2nd. CRC Press. 2002. ISBN 1-56676-661-3.
- ^ Divers, Edward; Shimosé, M. On a new oxide of tellurium. Journal of the Chemical Society. 1883, 43: 319–323 [2021-11-04]. doi:10.1039/CT8834300319. (原始内容存档于2021-11-04).
- ^ 38.0 38.1 Dutton, W. A.; Cooper, W. Charles. The Oxides and Oxyacids of Tellurium. Chemical Reviews. 1966, 66 (6): 657–675. doi:10.1021/cr60244a003.
- ^ 39.0 39.1 Wickleder, Mathias S. Chalcogen-Oxygen Chemistry. Francesco A. Devillanova (编). Handbook of chalcogen chemistry: new perspectives in sulfur, selenium and tellurium
 . Royal Society of Chemistry. 2007: 348–350. ISBN 978-0-85404-366-8.
. Royal Society of Chemistry. 2007: 348–350. ISBN 978-0-85404-366-8.
- ^ Molnar, Arpad; Olah, George Andrew; Surya Prakash, G. K.; Sommer, Jean. Superacid Chemistry
 2nd. Wiley-Interscience. 2009: 444–445. ISBN 978-0-471-59668-4.
2nd. Wiley-Interscience. 2009: 444–445. ISBN 978-0-471-59668-4.
- ^ Sadekov, I. D.; Zakharov, A. V. Stable tellurols and their metal derivatives. Russian Chemical Reviews. 1999, 68 (11): 909–923. Bibcode:1999RuCRv..68..909S. doi:10.1070/RC1999v068n11ABEH000544.
- ^ Guo, W. X.; Shu, D.; Chen, H. Y.; Li, A. J.; Wang, H.; Xiao, G. M.; Dou, C. L.; Peng, S. G.; Wei, W. W.; Zhang, W.; Zhou, H. W.; Chen, S. Study on the structure and property of lead tellurium alloy as the positive grid of lead-acid batteries. Journal of Alloys and Compounds. 2009, 475 (1–2): 102–109. doi:10.1016/j.jallcom.2008.08.011.
- ^ 43.0 43.1 Knockaert, Guy, Tellurium and Tellurium Compounds, Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, doi:10.1002/14356007.a26_177
- ^ Morton, Maurice. Sulfur and Related Elements. Rubber Technology. Springer. 1987: 42 [2021-11-14]. ISBN 978-0-412-53950-3. (原始内容存档于2021-11-14).
- ^ 45.0 45.1 Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Nishii, J.; Morimoto, S.; Inagawa, I.; Iizuka, R.; Yamashita, T.; Yamagishi, T. Recent advances and trends in chalcogenide glass fiber technology: a review. Journal of Non-Crystalline Solids. 1992, 140: 199–208. Bibcode:1992JNCS..140..199N. doi:10.1016/S0022-3093(05)80767-7.
- ^ El-Mallawany, Raouf A. H. Tellurite glasses handbook: physical properties and data. CRC Press. 2002: 1–11 [2021-11-14]. ISBN 978-0-8493-0368-5. (原始内容存档于2021-11-14).
- ^ Johnson, L. B. Correspondence. Representing Delay Powder Data.. Industrial & Engineering Chemistry. 1960, 52 (10): 868. doi:10.1021/ie50610a035.
- ^ [Nordion fact sheet: I-131 http://www.nordion.com/wp-content/uploads/2014/10/MI_Iodine-131_Solution_Canada.pdf (页面存档备份,存于互联网档案馆)]
- ^ Zweibel, K. The Impact of Tellurium Supply on Cadmium Telluride Photovoltaics. Science. 2010, 328 (5979): 699–701. Bibcode:2010Sci...328..699Z. PMID 20448173. S2CID 29231392. doi:10.1126/science.1189690.
- ^ Saha, Gopal B. Cadmium zinc telluride detector. Physics and radiobiology of nuclear medicine. New York: Springer. 2001: 87–88 [2021-11-16]. ISBN 978-0-387-95021-1. (原始内容存档于2021-11-16).
- ^ Willardson, R.K.; Beer, Albert C (编). Mercury cadmium telluride. New York: Academic Press. 1981. ISBN 978-0-12-752118-3.
- ^ Capper, Peter; Elliott, C. T. (编). Metalorganic vapour phase epitaxy. Infrared detectors and emitters : materials and devices. Boston, Mass.: Kluwer Academic. 2001: 265–267 [2021-11-20]. ISBN 978-0-7923-7206-6. (原始内容存档于2021-11-20).
- ^ Shenai-Khatkhate, Deodatta V.; Webb, Paul; Cole-Hamilton, David J.; Blackmore, Graham W.; Brian Mullin, J. Ultra-pure organotellurium precursors for the low-temperature MOVPE growth of II/VI compound semiconductors. Journal of Crystal Growth. 1988, 93 (1–4): 744–749. Bibcode:1988JCrGr..93..744S. doi:10.1016/0022-0248(88)90613-6.
- ^ Shenai-Khatkhate, Deodatta V.; Parker, M. B.; McQueen, A. E. D.; Mullin, J. B.; Cole-Hamilton, D. J.; Day, P. Organometallic Molecules for Semiconductor Fabrication [and Discussion]. Phil. Trans. R. Soc. Lond. A. 1990, 330 (1610): 173–182. Bibcode:1990RSPTA.330..173S. S2CID 100757359. doi:10.1098/rsta.1990.0011.
- ^ Mullin, J.B.; Cole-Hamilton, D.J.; Shenai-Khatkhate, D.V.; Webb P. (May 26, 1992) 美国专利第5,117,021号 "Method for purification of tellurium and selenium alkyls"
- ^ Farivar, Cyrus. Panasonic says that its 100GB Blu-ray discs will last a century. 2006-10-19 [2008-11-13]. (原始内容存档于2020-03-21).
- ^ Nishiuchi, Kenichi; Kitaura, Hideki; Yamada, Noboru; Akahira, Nobuo. Dual-Layer Optical Disk with Te–O–Pd Phase-Change Film. Japanese Journal of Applied Physics. 1998, 37 (4B): 2163–2167. Bibcode:1998JaJAP..37.2163N. doi:10.1143/JJAP.37.2163.
- ^ Geppert, Linda. The New Indelible Memories. IEEE Spectrum. 2003, 40 (3): 48–54. doi:10.1109/MSPEC.2003.1184436.
- ^ Hudgens, S.; Johnson, B. Overview of Phase-Change Chalcogenide Nonvolatile Memory Technology. MRS Bulletin. 2004, 29 (11): 829–832. doi:10.1557/mrs2004.236.
- ^ Taft, E.; Apker, L. Photoemission from Cesium and Rubidium Tellurides. JOSA. 1953-02-01, 43 (2): 81–83 [2021-11-16]. Bibcode:1953JOSA...43...81T. doi:10.1364/JOSA.43.000081. (原始内容存档于2021-11-16) (英语).
- ^ Rao, T., & Dowell, D. H. (2013). An engineering guide to photoinjectors. CreateSpace Independent Publishing.
- ^ LCLS-II Project Team. (2015). LCLS-II Final Design Report (LCLSII-1.1-DR-0251-R0). SLAC. https://portal.slac.stanford.edu/sites/ard_public/people/tora/Temp/150921%20LCLS-II%20FDR.pdf
- ^ [1],“Bi-alkali telluride photocathode”,发行于1978-07-20
- ^ Trautner, H. (2000). Spectral Response of Cesium Telluride and Rubidium Telluride Photocathodes for the Production of Highly Charged Electron Bunches. CERN.
- ^ Atta-ur- Rahman. Studies in Natural Products Chemistry. Elsevier. 2008: 905– [2021-11-06]. ISBN 978-0-444-53181-0. (原始内容存档于2021-11-21).
- ^ Chua SL, Sivakumar K, Rybtke M, Yuan M, Andersen JB, Nielsen TE, Givskov M, Tolker-Nielsen T, Cao B, Kjelleberg S, Yang L. C-di-GMP regulates Pseudomonas aeruginosa stress response to tellurite during both planktonic and biofilm modes of growth. Scientific Reports. 2015, 5: 10052. Bibcode:2015NatSR...510052C. PMC 4438720
 . PMID 25992876. doi:10.1038/srep10052.
. PMID 25992876. doi:10.1038/srep10052.
- ^ Ottosson, L. G.; Logg, K.; Ibstedt, S.; Sunnerhagen, P.; Käll, M.; Blomberg, A.; Warringer, J. Sulfate assimilation mediates tellurite reduction and toxicity in Saccharomyces cerevisiae. Eukaryotic Cell. 2010, 9 (10): 1635–47. PMC 2950436
 . PMID 20675578. doi:10.1128/EC.00078-10.
. PMID 20675578. doi:10.1128/EC.00078-10.
- ^ Chasteen, Thomas G.; Bentley, Ronald. Biomethylation of Selenium and Tellurium: Microorganisms and Plants. Chemical Reviews. 2003, 103 (1): 1–26. PMID 12517179. doi:10.1021/cr010210+.
- ^ Taylor, Andrew. Biochemistry of tellurium. Biological Trace Element Research. 1996, 55 (3): 231–9. PMID 9096851. S2CID 10691234. doi:10.1007/BF02785282.
- ^ Kwantes, W. Diphtheria in Europe. The Journal of Hygiene. 1984, 93 (3): 433–437. JSTOR 3862778. PMC 2129475
 . PMID 6512248. doi:10.1017/S0022172400065025.
. PMID 6512248. doi:10.1017/S0022172400065025.
- ^ Pubchem LCSS https://pubchem.ncbi.nlm.nih.gov/compound/6327182#datasheet=LCSS§ion=GHS-Classification (页面存档备份,存于互联网档案馆)
- ^ Tellurium 452378. Sigma-Aldrich. [2021-11-02]. (原始内容存档于2021-11-05).
- ^ 74.0 74.1 Harrison, W.; Bradberry, S.; Vale, J. Tellurium. International Programme on Chemical Safety. 1998-01-28 [2007-01-12]. (原始内容存档于2008-12-10).
- ^ Kean, Sam. The Scent of a Molecule. Distillations. 2017, 3 (3): 5 [May 16, 2018]. (原始内容存档于2021-11-05).
- ^ Wright, PL; B. Comparative metabolism of selenium and tellurium in sheep and swine. American Journal of Physiology. Legacy Content. 1966, 211 (1): 6–10. PMID 5911055. doi:10.1152/ajplegacy.1966.211.1.6
 .
.
- ^ Müller, R.; Zschiesche, W.; Steffen, H. M.; Schaller, K. H. Tellurium-intoxication. Klinische Wochenschrift. 1989, 67 (22): 1152–5. PMID 2586020. doi:10.1007/BF01726117.
- ^ Taylor, Andrew. Biochemistry of tellurium. Biological Trace Element Research. 1996, 55 (3): 231–239. PMID 9096851. S2CID 10691234. doi:10.1007/BF02785282.
- ^ CDC – NIOSH Pocket Guide to Chemical Hazards – Tellurium. www.cdc.gov. [2015-11-24]. (原始内容存档于2021-11-05).
- 元素碲在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 碲(英文)
- 元素碲在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素碲在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 碲(英文)

