钛(拼音:tài,注音:ㄊㄞˋ,粤拼:taai3;英语:Titanium),是一种化学元素,其化学符号为Ti,原子序数为22,原子量为47.867 u。钛是银白色的过渡金属,其特征为重量轻、强度高、具金属光泽,亦有良好的抗腐蚀能力(包括海水、王水及氯气)。由于其稳定的化学性质,良好的耐高温、耐低温、抗强酸、抗强碱,以及高强度、低密度,常用来制造火箭及太空船,因此获美誉为“太空金属”[3]。钛于1791年由格雷戈尔于英国康沃尔郡发现,并由克拉普罗特用希腊神话的泰坦为其命名。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
带银光泽的银白色金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钛(Titanium)·Ti·22 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 4 ·4·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 47.867(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氩]3d2 4s2 2, 8, 10, 2 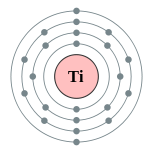 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 威廉·格雷戈尔(1791年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 永斯·贝采利乌斯(1825年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 命名 | 马丁·克拉普罗特(1795年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 4.506 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 4.11 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1941 K,1668 °C,3034 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 3560 K,3287 °C,5949 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 14.15 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 425 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 25.060 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 4, 3, 2, 1, −1, −2[1] (两性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.54(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:658.8 kJ·mol−1 第二:1309.8 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 147 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 160±8 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁化率 | +153.0·10−6 cm3/mol (293 K)[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)0.420 µ Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 21.9 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)8.6 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (室温)5,090 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 116 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 44 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 110 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.32 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 6.0 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 970 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 716 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-32-6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钛的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
钛被认为是一种稀有金属,这是由于在自然界中其存在分散并难于提取。但其相对丰度在所有元素中居第十位。[4]钛的矿石主要有钛铁矿及金红石,广布于地壳及岩石圈之中。钛亦同时存在于几乎所有生物、岩石、水体及土壤中[5]。从主要矿石中萃取出钛需要用到克罗尔法[6]或亨特法。钛最常见的化合物是二氧化钛,可用于制造白色颜料[7]。其他化合物还包括四氯化钛(TiCl4,作催化剂及用于制造烟幕或空中文字)及三氯化钛(TiCl3,用于催化聚丙烯的生产)[5]。
钛能与铁、铝、钒或钼等其他元素熔成合金,造出高强度的轻合金,在各方面有着广泛的应用,包括宇宙航行(喷气发动机、导弹及航天器)、军事、工业程序(化工与石油制品、海水淡化及造纸)、汽车、农产食品、医学(义肢、骨科移植及牙科器械与填充物)、运动用品、珠宝及手机等等。[5]
钛最有用的两个特性是,抗腐蚀性,及金属中最高的强度-重量比[8]。在非合金的状态下,钛的强度跟某些钢相若,但却还要轻45%[9]。有两种同素异形体[10]和五种天然的同位素,由46Ti到50Ti,其中丰度最高的是48Ti(73.8%)[11]。钛的化学性质及物理性质和锆相似,这是因为两者的价电子数目相同,并于元素周期表中同属一族。
物理性质
在金属元素中,钛的比强度很高[10]。它是一种高强度但低质量的金属,而且具有相当好的延展性(尤其是在无氧的环境下)[12]。钛的表面呈银白色金属光泽[13]。它的熔点相当地高(超过1,649摄氏度),所以是良好的耐火金属材料。它具有顺磁性,其电导率及热导率皆甚低[5]。
商业等级的钛(纯度为99.2%)具有约为434百万帕斯卡的极限抗拉强度,与低等级的钢合金相若,但比钢合金要轻45%[9]。钛的密度比铝高60%,但强度是常见的6061-T6铝合金的两倍[9]。钛可被用于各种用途。某些钛合金(例如βC)的抗拉强度达1,400兆帕斯卡[14]。然而,当钛被加热至430摄氏度以上时,强度会减弱[15]。
尽管比不上高等级的热处理钢,钛仍具有相当的硬度。钛不具磁性,同时是不良的导热及导电体。用机械处理时需要注意,因为如不采用锋利的器具及适当的冷却手法,钛会软化,并留有压痕。像钢结构体一样,钛结构体也有疲劳极限,因此在某些应用上可保证持久耐用。[13]钛合金的比劲度一般不如铝合金及碳纤维等其他物料,所以较少应用于需要高刚度的结构上。
钛具有两种同素异形体,在882摄氏度时,就会从六方最密堆积的α型转变成体心立方的β型。[15]在到达临界温度前,α型的比热会随着升温而暴增,但到达后会下降,然后在β型下不论温度地保持基本恒定。[15]跟锆和铪类似,钛还存在一种ω态,在高压时热力学稳定,但也可能在常压下以准稳态存在。此态一般是六边形(理想)或三角形(扭曲),在软性纵波声频光子导致β型(111)原子平面倒塌时能被观测到。[16]
化学性质
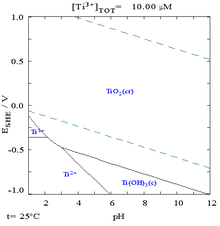
钛的特性中,最为人称道的就是它优良的抗腐蚀能力——它的抗蚀性几乎跟铂一样好,钛不受稀硫酸、稀盐酸、氯气、氯溶液及大部分有机酸的腐蚀[6],但仍可被浓酸溶解[18]。虽然以下的电位-pH图指出钛在热力学上是一种活性很高的金属[17],但是它与水及空气的反应是非常缓慢的[5]。
钛在曝露在高温空气中时,会生成一层钝氧化物保护膜,阻止氧化持续[5]。在最初形成时,保护层只有一至二纳米厚,但会缓慢地持续增厚;四年间可达25纳米厚[19]。但当钛被置于高温空气中时,便很容易与氧产生反应[5]。
这个反应在空气温度达1200摄氏度时便会发生,而在纯氧中最低只需610摄氏度,生成二氧化钛[10]。因此不能在空气中熔掉钛,因为在到达熔点前钛会先燃烧起来,所以只能在惰性气体或真空中熔化钛。在550摄氏度时,钛会与氯气结合[6]。钛亦会与其他卤素结合,并吸收氢气[7]。
钛也是少数会在纯氮气中燃烧的元素,达800摄氏度就会燃烧起来,生成一氮化钛,导致脆化[20]。
实验指出,天然钛在受到氘核轰击后会具有放射性,主要释放出正电子及硬性γ射线[6]。
天然含量
| 国家 | 千吨 | 百分比 |
|---|---|---|
| 1,513 | 13.1 | |
| 1,030 | 8.9 | |
| 3,830 | 33.1 | |
| 510 | 4.4 | |
| 562 | 4.9 | |
| 1,070 | 9.3 | |
| 502 | 4.3 | |
| 743 | 6.4 | |
| 492 | 4.3 | |
| 全球总计 | 11,563 | 100 |
自然中的钛总是与其他元素结合成化合物。它是地壳中含量第九高的元素(质量占地壳0.63%)[22],同时也是第七高的金属。大部分的火成岩及由其演变成的沉积岩都含有钛(生物及天然水体也含有钛)[5][6]。实际上,在美国地质调查局分析过的801种火成岩中,784种含有钛[22]钛大约占土壤的0.5至1.5%。[22]。
它分布很广,主要矿物为锐钛矿、板钛矿、钛铁矿、钙钛矿、金红石、榍石及大部分铁矿石[19]。这些矿物中,只有金红石和钛铁矿具有经济价值,但即使是这两种矿物,它们的高浓度矿源仍是很难找。铁钛矿的重要矿源主要分布于澳洲西部、加拿大、中国、印度、莫桑比克、新西兰、挪威及乌克兰[19]。北美洲及南非亦有大量开采金红石,促使钛金属的年产量至九万吨及二氧化钛至四百三十万吨[19]。据估计,钛的贮藏量超过六亿吨[19]。
钛可以在陨石中找到,并且已在太阳及M型恒星处侦测到钛[6];M型恒星是温度最冷的恒星,表面温度为3,200摄氏度[23]。在阿波罗17号任务从月球带回的岩石中,二氧化钛含量达12.1%[6]。钛还可以在煤灰、植物,甚至人体中找到。[来源请求]
海中的钛浓度大约是4x10−12M。在100°C,pH=7的水中,钛浓度估计小于10−7M。钛只有4+氧化态在空气中是稳定的,但由于含钛物种对水溶解度过低,且缺乏灵敏的光谱分析法,其在水溶液中之特性仍然未知。只有极少生物会累积高浓度的钛,目前没有证据显示钛在生物体的作用为何。[24]
同位素
天然生的钛有五种稳定的同位素:46Ti、47Ti、48Ti、49Ti及50Ti,其中最常见的是48Ti(天然丰度为73.8%)。现时已知钛共有十一种放射性同位素,其中比较稳定的有44Ti(半衰期63年)、45Ti(半衰期184.8分钟)、51Ti(半衰期5.76分钟)及52Ti(半衰期1.7分钟)。而剩下的其他放射性同位素,半衰期最长只有33秒,而大部分的半衰期更在半秒以下[11]。
钛各同位素的原子重量,最轻有39.99u(40Ti),最重有57.966u(58Ti)。最常见的稳定同位素,48Ti,其主要衰变模式为电子捕获,衰变产物为元素21(钪)的同位素;而其次的衰变模式为β衰变,产物为元素23(钒)的同位素[11]。
钛用氘核轰击后会变成放射性物质,主要放射正子和短γ射线。[6]

钛主要以氧化数+4存在,[25]但是氧化数+3的钛化合物也很常见。[26]通常,钛在其错合物中是八面体形分子构型[27][28],但是四氯化钛为四面体结构,属于特例。由于其高氧化态,+4价钛化合物具有高度的共价性。[25]和大部分过渡金属不同,简单的+4价钛水错合物还未被发现。
氧化物,硫化物和醇盐
最重要的钛氧化物是二氧化钛。二氧化钛以三种主要的晶形存在:锐钛矿、板钛矿、金红石。这些都是反磁性固体,但在矿物中的外观可能颜色较暗(请见金红石)。锐钛矿、金红石的晶型结构主要由相互连接的TiO2八面体组成,TiO2八面体是以Ti为中心,周围环绕六个氧原子。[29]
星彩蓝宝石及红宝石的星彩性来自于它们所含的二氧化钛杂质[19]。钛酸盐是以二氧化钛为原料的化合物。钛酸钡具有压电性,因此可以被用于制造声光转换器[10]。酒精与四氯化钛反应会生成钛酯,可被用于制作防水纤维[10]。
目前已知有各种的钛低氧化物,我们主要利用热喷涂来减少所获二氧化钛的数目。五氧化三钛,是一种紫色的半导体,含有+3价及+4价钛,可在高温下用氢气还原二氧化钛制得,[30]并当表面需要用二氧化钛气相涂覆时,在工业上使用:它像纯一氧化钛一样会蒸发,而二氧化钛会像钛氧化物的混合物一般,蒸发并沉淀出具有可变折射率的涂层。[31]另外还有三氧化二钛,为刚玉型结构,以及一氧化钛,为岩盐结构,不过其经常是非整比化合物。[32]
氮化物和碳化物
氮化钛是耐火过渡金属氮化物的一员,且展现与其共价化合物类似的特性,包括:耐温、超高硬度、导电导温、高熔点。[33]
氮化钛(TiN)具有与蓝宝石及金刚砂相当的硬度(摩氏硬度9.0)[34],因此可作为各种切割工具的涂层,例如钻头[35]。它的其他应用还包括装饰用金色涂料及半导体器件制造中铜导线界面的扩散阻障层[36]。
卤化物
四氯化钛(氯化钛(IV),TiCl4[37])是一种无色液体[38],也是二氧化钛颜料制造过程的中间体[39]。作为一种路易斯酸,四氯化钛在有机化学反应中有广泛应用,例如向山羟醛反应[40]。在晶棒法中,四碘化钛(TiI4)用于生产高纯钛金属。[41]
钛另有一种氧化数较低的氯化物,三氯化钛(氯化钛(III),TiCl3),用作合成聚烯烃的催化剂(见齐格勒-纳塔催化剂)和有机化学中的还原剂。[42][43]
有机金属化合物
二氯化二茂钛是一种重要的碳-碳键形成催化剂。异丙醇钛用于夏普莱斯不对称环氧化反应。其他化合物还包括溴化钛(用于冶金术、超合金及高温用电线线路及涂层)和碳化钛(用于高温切割工具及涂层)[7]。
抗癌治疗
在含铂药物化疗成功之后,钛(IV)化合物是首批用于癌症治疗的非铂化合物。钛化合物的优点在于其高效和低毒性。在生物环境中,水解产生安全且不活泼的二氧化钛。尽管有这些优点,但第一批候选化合物未通过临床试验。进一步的发展导致可能具备有效性,选择性和稳定性的含钛药物之产生。[44]其作用方式现在尚不清楚。

1791年,钛以含钛矿物的形式在英格兰的康沃尔郡被发现,发现者是英格兰业余矿物学家格雷戈尔(Reverend William Gregor),当时正业为负责康沃尔郡的克里特(Creed)教区的牧师[45]。他在邻近的马纳坎教区中小溪旁找到了一些黑沙,后来他发现了那些沙会被磁铁吸引[45],他意识到这种矿物(钛铁矿)包含着一种新的元素[7]。经过分析,发现沙里面有两种金属氧化物;氧化铁(沙受磁铁吸引的原因)及一种他无法辨识的白色金属氧化物(45.25%)[22]。意识到这种未被辨识的氧化物含有一种未被发现的金属,格雷戈尔对康沃尔郡皇家地质学会及德国的《化学年刊》发表了这次的发现[45]。
大约就在同时,米勒·冯·赖兴斯泰因(Franz-Joseph Müller von Reichenstein)也制造出类似的物质,但却无法辨识它[7]。直到1795年,普鲁士化学家克拉普罗特(Martin Heinrich Klaproth)独立地从匈牙利的金红石中再度发现到这种氧化物[45]。克拉普罗特发现到它含有一种新的物质,并以希腊神话中的泰坦(Titans)为其命名[23]。当他听闻到格雷戈尔较早前的发现之后,克拉普罗特取得了一些马纳坎矿物的样本,并证实它含钛。[来源请求]
从各种含钛矿物中提炼钛的过程既费工又昂贵;不能像对其他金属地用碳去还原钛,因为钛与碳加热时会生成碳化钛[45]。历史上最早制备出纯钛(99.9%),一直要到1910年,美国伦斯勒理工学院的亨特(Matthew A. Hunter)将四氯化钛和钠一起加热至700-800摄氏度,提炼出高纯度的钛,这种方法被称为亨特法[6]。但是这时钛的应用仍只限于实验室,直到1932年克罗尔(William Justin Kroll)证明出可以利用镁将四氯化钛还原以提炼出钛[46]。八年后他改良了这个过程,当中使用镁甚至是钠来还原钛,后来被称为克罗尔法[46]。尽管研究如何能更有效及便宜地提炼钛的工作仍然持续(例如FFC剑桥法),但是钛金属的商业提炼还在使用克罗尔法[6][7]。

1925年,范·亚克(Anton Eduard van Arkel)及德·波耳(Jan Hendrik de Boer)发现了晶棒法(又称碘化物精炼法),即与碘反应后再用热灯丝从蒸气中分离出纯金属[47],利用这个方法可生产出少量的超纯钛。
在1950年代至60年代年间,苏联率先将钛用于军事及潜艇用途(661型潜艇、705型核潜艇、M级核潜艇)[48],作为对冷战的部分规划[49]。自1950年代初起,钛开始被用于各种军事航空用途,尤其是制造高性能喷射机,最初的机体包括F-100超级军刀及洛克希德A-12。[来源请求]
在美国,国防部意识到钛这种金属的战略重要性[50],并支持了钛早期的商业化行动[51]。在整个冷战时期期间,钛一直被美国政府视为战略材料,国家防御储备中心内有大量海锦钛库存,直至2005年用尽为止[52]。现时世界最大的钛生产商,是俄罗斯的VSMPO-Avisma,据估计这家公司的全球市场占有率达29%[53]。
2006年美国国防部国防高等研究计划署向两家公司联合拨款五百七十万美元,研发制造钛金属粉末的新方法。在热力与压力下,这种粉末可用于制作各种强度高且重量轻的物件,从装甲敷板到宇宙航行、运输、化工用元件[54]。

处理钛金属主要分四个步骤[55]:一、把钛矿石还原成“海绵体”(一种透气的形态);二、制造铸锭,熔化海绵体(或用海绵体加一种母合金)来形成铸锭;三、初步制造,把铸锭制成一般机械制品,如坯、棒、板、片、条及管;四、加工制造,把机械制品进一步加工成型。
由于钛在高温时会与氧气反应的关系,所以不能用还原反应来从氧化物中提炼钛[13]。因此商业上提炼钛金属要用到克罗尔法,一种既繁复又昂贵的分批处理法。(钛的市价相对地高,是因为在提炼的过程中,需要氧化另一种昂贵的金属——镁[56]。)在克罗尔法中,氧化物首先经过碳氯化,转化成氯化物,过程中氯气会在有碳的情况下,通过红热的金红石或钛铁矿,生成四氯化钛(TiCl4)。氯化物经分馏法浓缩及提纯后,在800摄氏度的氩气中被熔镁还原成钛[10]。
一种最近开发的提炼法,FFC剑桥法[57],日后有可能完全取代克罗尔法。此法的原料是粉末状的二氧化钛(一种精炼过的金红石),而最后成品则会是钛粉末或海绵体。假如在原料的粉末中混入粉末状的氧化物,那么成品就会是廉价钛合金,这样做比使用一般的多步熔化法要便宜得多。FFC剑桥法使钛不像从前那样的如此稀少和昂贵,可为航天工业及奢侈品市场提供更多的选择,同时可取代一些制品中的铝或特殊等级的钢。[来源请求]
一般钛合金是由还原反应所造出来的。例如,铜钛合金(把加了铜的金红石还原而成)、碳钛铁合金(把钛铁矿和焦炭用电炉还原而成)和锰钛合金(金红石加锰或氧化锰)都是经还原而成的[20]。
现时钛与钛合金共有大约50种指定品位,尽管市面上能容易买到的就只有六种[58]。美国材料试验协会(ASTM)承认31种钛金属及合金品位,其中1至4号品位在商业上属纯钛(非合金)。这四种品位以它们不同的抗拉强度区分,也就是含氧百分比,其中1号品位韧性最佳(抗拉强度低,含氧量0.18%),4号最差(抗拉强度高,含氧量0.40%)[19]。其余品位皆为合金,每一种配方都有其特定的用途,例如韧性、强度、硬度、电阻、抗蠕变及抗腐蚀(特定某种介质或同时多种)[59]。
美国材料试验协会所指定的品位及其他合金,亦会按照各种规格生产,例如宇宙航行及军事规格(SAE-AMS, MIL-T)、ISO标准、各国的特定标准以及用家所需的规格(宇宙航行、军事、医学及工业用)[60]。
至于加工方面,钛的所有焊接必需在氩或氦其中一种惰性气体中进行,否则钛会被空气中的氧、氮或氢等气体污染[15]。污染会引起各种情况,包括脆化,而脆化会减低焊接后的整体性,并导致连接失败。商业纯钛的扁平产品(片、板)制造起来很容易,但处理时必须注意钛金属有“记忆”特性,有弹回原形的倾向。有几种高强度合金更尤其如此[61][62]。钛金属一般可以用跟不锈钢一样的机器及方法处理[15]。

钛是钢的一种合金用元素(钛铁),钛会缩小钢的晶粒尺寸,同时作为脱氧剂的钛会减低钢的含氧量;在不锈钢中加钛会减低含碳量[5]。钛常与其他金属制成合金,这些金属有铝(改良晶粒大小)、钒、铜(硬化)、镁及钼等[63]。钛的机械制品(片、板、管、线、锻件、铸件)在工业、宇宙航行、休闲及新兴市场上都有应用。钛粉在烟火制造上用于提供明亮的燃烧颗粒。[来源请求]
颜料、添加剂及涂料

从地球表面被开采的钛矿石中,约95%都被送往提炼成二氧化钛(TiO2),俗称钛白(粉),一种超白的持久颜料,性质安定、无毒且覆盖力佳,常被用于制造涂料、纸张、牙膏及塑胶[64],也是立可白的主要成分。二氧化钛也被用于水泥、宝石、造纸用遮光剂[65]及石墨复合鱼杆、高尔夫球杆的强化剂。[来源请求]
粉末状的TiO2化学上具惰性,阳光下不褪色,而且很不透光:就是这些性质,使得它能够为制造家用塑胶的灰色或棕色化学品带来艳丽的纯白色[7]。在自然中,二氧化钛这种化合物可在锐钛矿、板钛矿及金红石这几种矿物中找到[5]。用二氧化钛制成的涂料能够耐高温,轻度阻止尘污积聚,及抵受海洋环境带来的影响[7]。纯二氧化钛的折射率非常高,而且对光学色散能力比钻石还高[6]。除了作为一种很重要的颜料之外,二氧化钛还会吸收紫外线,可用于防晒化妆品中。
奈米级二氧化钛也会吸收紫外线,可制成光触媒产品,有除臭、杀菌及消毒的功能。
最近,它还被用在空气净化器(过滤器涂层),及贴在建筑物窗上的薄膜,这种薄膜在接触到紫外线(太阳或人工)或空气中的水分时,会产生带高度活性的氧化还原物种,如羟基,能净化空气或保持窗面清洁[66]。
宇宙航行及航海
由于它的高抗拉强度-密度比[10]、优良的抗腐蚀性[6]、抗疲乏性、抗裂痕性[67]及能够在没有蠕变的情况下抵受适度高温,钛合金被用于航空器、装甲敷板、海军舰只、航天器与导弹[6][7]。在这些应用中,钛与铝、钒及其他元素所制成的合金,用于制造各种元件,包括关键的架构部件、防火墙、起落架、排气管(直升机)及液压系统。事实上,约三分二的钛金属生产量被用于制造太空船引擎及构架[68]。SR-71“黑鸟”是最早在架构上广泛使用钛的机体,为现代军用及商用机体的钛应用铺好了路。据估计,生产波音777要用59吨钛,波音747要44吨,波音737要18吨,空中客车A340要32吨,空中客车A330要18吨,空中客车A320要12吨。空中客车A380可能要用146吨,其中引擎要26吨[69]。在引擎应用上,钛被用于转子、压缩机叶片、液压系统元件及短舱。在航空应用的钛合金中,钛-6铝-4钒占几乎50%[70]。
由于不易被海水腐蚀,钛被用于制造螺桨轴、索具及用于海水淡化厂的换热器[6];还被用于咸水水族馆的冷热水器、钓鱼线及潜水用刀。钛被用于制造海洋监视部署的住房及其他元件,及用于以及科学用或军用的监察仪。前苏联研发出主要用钛制造潜艇的技术[71]。
工业
化工及石油化工领域需要用到焊钛制的管道及加工设备(换热器、槽、加工用容器、阀),主要原因是钛的抗腐蚀性。井内与镍湿法冶金应用要用到特定的几种合金,如钛βC,因为需要高强度、高抗腐蚀性或两者同时。制纸业某些会面对腐蚀性介质的生产设备会用到钛,这些腐蚀性介质包括次氯酸钠或湿氯气(用于漂白)[72]。其他应用包括:超声波焊接、熔锡波焊[73]及溅镀靶材[74]。
四氯化钛(TiCl4)是一种无色液体,在生产二氧化钛的过程中的是一种重要的中间物,可用于生产齐格勒-纳塔催化剂及制造镀铱玻璃,还由于它在湿气中会产生浓烟,所以可以用四氯化钛来制造烟幕[13]。
消费品及建材
钛金属被用于汽车,尤其是赛车(汽车或摩托),在这领域减低重量,但同时不失强度及刚度是极其重要的[75]。一般来说,钛金属对普通大众的消费市场来说太昂贵了,很难会有销路,所以它的主要市场是高档产品,尤其是竞赛用/高性能市场。最新款的Corvette跑车可选配钛制排气系统[76]。

钛被用于各种体育用品:网球拍、高尔夫球杆杆头、袋棍球棒手柄;板球、曲棍球、袋棍球及美式足球的头盔上的护架;以及自行车的骨架及元件。尽管钛并不是自行车生产的主流材料,但仍有运动选手及自行车冒险爱好者使用钛制的自行车[77]。钛合金亦被用于制造眼镜框架[78],虽然这种镜框会有点昂贵,但是它重量轻又很经久耐用,而且不会造成皮肤敏感。许多野外背包客都有钛制的装备,包括煮食用具、餐具、提灯及帐蓬的标桩[78]。虽然比传统的钢或铝制的同类稍贵,这些钛制品要轻得多但强度不减。蹄铁匠也偏好使用钛,因为钛制的马蹄铁比钢制的更轻且更耐用[78]。

由于它的耐久性,钛制的名牌珠宝(尤其是钛戒指)开始普遍起来[78]。钛的惰性成了要选择它的原因,特别是对有皮肤敏感或会在特定环境中(如游泳池)佩戴首饰的人。钛的耐久性、轻重量、防凹性及耐腐蚀性,使它成为生产手表外壳与表带的理想材料[78]。有些艺术家用钛来制作艺术品,例如雕塑、装饰品及家具[79]。
钛偶尔会被用在有关建筑的应用上:位于莫斯科高40米的加加林纪念柱,为纪念第一名太空人尤里·加加林而建造,就是以钛建成的[80],选用钛的原因是因为它吸引的颜色以及跟火箭技术的关连。西班牙的毕尔包古根汉美术馆及美国喜瑞都的千禧图书馆分别是欧洲和北美最早使用钛壁板护层的建筑[68]。其他使用钛壁板护层的建筑还有位于美国科罗拉多州丹佛艺术博物馆的汉密顿楼[81],及位于莫斯科高107米的征服太空纪念碑[82]。
比起枪支传统上用的金属(钢、不锈钢及铝),钛的强度低质量较为优胜,加上在金属制造上的发展,用钛来制造枪支开始变得普遍。主要用途包括手枪支架及左轮手枪的转轮。基于同样的理由,笔记本电脑的主体也会用到钛(例如苹果的PowerBook系列)[83]。而2017年推出的智能手机Essential Phone将钛合金作为手机边框,是首部由钛合金所组成机身的手机。[84]
有些高价位市场卖的工具,既轻量又耐腐蚀,例如铲子及手电筒,也会用钛合金制造。[来源请求]
珠宝
由于其耐久性,钛已成为更受设计师欢迎的珠宝(尤其是钛戒指)[78]。它的低活性使其成为过敏症患者,或会在游泳池等环境中佩戴首饰的人之理想选择。钛与金合铸可生产出能以24K金标示销售的合金。此合金之硬度大约相当于14K金,且比纯24K金更耐用。[85]
钛的耐久度、较轻的重量、耐凹性以及耐蚀性使其很适合作为表壳的材料。[78]有些艺术家会使用钛制作雕塑、装饰物和家具。[86]
钛可经阳极氧化以改变表面氧化物的厚度,从而产生光学干涉条纹和各种鲜艳的颜色。[87]由于这种着色和低活性,钛常被用作身体部位穿环。[88]
钛在制造非流通硬币和奖牌上用途较少。 于1999年,直布罗陀在千禧年庆典发布了世界上第一个钛币。[89]澳大利亚橄榄球联盟的黄金海岸泰坦队(Gold Coast Titans)为他们的年度最佳球员颁发了纯钛奖牌。[90]
医学
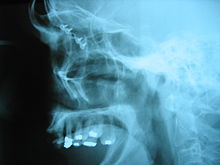
由于它的生物相容性(无毒及不被人体排斥),钛在医学上有广泛应用,当中包括外科用具及植入物,例如替换髋骨框及球关节,最长可用20年[45]。这种用途的钛一般与4%铝[91]或6%铝加4%钒制成合金。
钛有一种固有的骨整合特性,活性生骨细胞会直接在钛金属表面上沉积钙化为新生骨组织,最后会如同树根与土壤一般结合得极为牢固,使得钛制的牙科植入物能在原位上逗留50年之久。这种特性对整形植入物而言亦相当有用[45]。使用钛的好处还有钛较低的彈性模量(楊氏模量),与骨较为接近,植入物是以修补骨骼为目的而造。因此骨骼负重会更平均地分布于骨及植入物之间,这样会减低骨质流失的机会,因为如果负重不均就会有应力遮闭(骨骼应力因植入物而减低所导致的骨质流失),以及外科植入物与骨之间的义肢周骨折。然而,钛合金的刚性仍是骨的两倍,所以植入物周边骨的受力仍是会大幅减少,并可能因此退化[92]。
由于钛不具铁磁性,有钛植入物的病人能安全地接受核磁共振成像的检查(这对有长期植入物的人士来说是很方便的)。准备植入人体的钛要经过等离子弧的高温加热,移除表面原子,新露出的表面随即被氧化[45]。
钛被制成图像导引手术用的外科器具,还有轮椅、丁形拐杖及其他需要高强度低重量的产品。[来源请求]
核废料储存
由于其耐蚀性,钛已被研究用以制成储存核废料之容器。可使用超过10万年的容器被认为可透过最小化材料瑕疵的条件来制造。[93]钛“滴水罩”也可以安装在其他类型的容器上,以延长其使用寿命。[94]
“硬柄小皮伞”、“橙黄褐任伞”这两种真菌可以把钛污染泥土中之钛金属进行生物转换。[95]

钛没有毒性,即使大剂量时也是如此,钛在人体中不会发生任何自然作用[23]。据估计,人每天会摄取约0.8毫克钛,但大部分都在没有被吸收的情况下通过[23]。然而,含有硅土的组织会出现生物累积钛的倾向。在植物中,一种未知的机制可能会用钛来刺激碳水化合物的生产并促进生长。这可能解释到为何大部分植物的含钛量约为百万分之1(ppm),而食用植物的含钛量则约为2ppm,木贼及荨麻更最高可达80ppm[23]。
粉末状的钛及刨削下来的钛薄片很容易引起火灾,而且在空气中会因加热而发生爆炸[96]。水及二氧化碳类的灭火法对燃烧中的钛无效;必须改为使用D类干粉灭火剂[7]。
当生产或处理氯气时,必须小心注意钛只能用在周围没有干氯气的地方,否则会引起钛/氯火灾[97]。即使是湿氯气也是火灾隐患,因为在异常的天气状况下湿氯气可能会意外地变干。
钛未经氧化的新表面与液态氧接触后可能会起火[98]。这种表面可以由经氧化的钛表面跟硬物碰撞后所形成,或在力学应变导致的裂痕内形成。因此在液态氧的系统内使用钛很可能有限制,例如宇宙航行工业就会有这种系统。[来源请求]
- Barksdale, Jelks. Titanium. Clifford A. Hampel (editor) (编). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. 1968: 732–738. LCCN 68-29938.
- Emsley, John. Titanium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001. ISBN 0198503407.
- Flower, Harvey M. Materials Science: A moving oxygen story. Nature. 2000, 407 (6802): 305–306. PMID 11014169. doi:10.1038/35030266.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Winter, Mark. Chemistry: Periodic table: Titanium. WebElements. 2006 [2006-12-10].
- ^ Andersson, N.; et al. Emission spectra of TiH and TiD near 938 nm (PDF). J. Chem. Phys. 2003, 118: 10543. doi:10.1063/1.1539848. (原始内容 (PDF)存档于2012-02-09).
- ^ Weast, Robert. CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. 1984: E110. ISBN 0-8493-0464-4.
- ^ William L. Masterton; Cecile N. Hurley. Chemistry: Principles and Reactions 6th. Cengage Learning. 2008: 18. ISBN 0495126713.
- ^ 《无机化学》第四版。高等教育出版社.P375
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 5.9 Titanium. Encyclopædia Britannica Concise. 2007.
- ^ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 6.13 Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 7.8 7.9 Krebs, Robert E. The History and Use of Our Earth's Chemical Elements: A Reference Guide (2nd edition). Westport, CT: Greenwood Press. 2006. ISBN 0313334382.
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988: p.11. ISBN 0871703092.
- ^ 9.0 9.1 9.2 Barksdale 1968,第738页
- ^ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 Titanium. Columbia Encyclopedia 6th edition. New York: Columbia University Press. 2000–2006. ISBN 978-0-7876-5015-5.
- ^ 11.0 11.1 11.2 Barbalace, Kenneth L. Periodic Table of Elements: Ti - Titanium. 2006 [2006-12-26].
- ^ Titanium. Encyclopædia Britannica. 2006 [2006-12-29].
- ^ 13.0 13.1 13.2 13.3 Stwertka, Albert. Titanium. Guide to the Elements Revised. Oxford University Press. 1998: 81–82. ISBN 0-19-508083-1.
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988. Appendix J, Table J.2. ISBN 0871703092.
- ^ 15.0 15.1 15.2 15.3 15.4 Barksdale 1968,第734页
- ^ Sikka, S. K.; Vohra, Y. K., Chidambaram, R. Omega phase in materials. Progress in Materials Science. 1982, 27: 245 – 310. doi:10.1016/0079-6425 (82)90002-0 请检查
|doi=值 (帮助). - ^ 17.0 17.1 Ignasi Puigdomenech, Hydra/Medusa Chemical Equilibrium Database and Plotting Software(2004)KTH Royal Institute of Technology, freely downloadable software at 存档副本. [2007-09-29]. (原始内容存档于2007-09-29).
- ^ Casillas, N.; Charlebois, S.; Smyrl, W. H.; White, H. S. Pitting Corrosion of Titanium. Journal of the Electrochemical Society. 1994, 141 (3): 636 – 42. doi:10.1149/1.2054783. Abstract
- ^ 19.0 19.1 19.2 19.3 19.4 19.5 19.6 Emsley 2001,第453页
- ^ 20.0 20.1 Titanium. Microsoft Encarta. 2005 [2006-12-29]. (原始内容存档于2006-10-27).
- ^ 引用错误:没有为名为
USGS的参考文献提供内容 - ^ 22.0 22.1 22.2 22.3 Barksdale 1968,第732页
- ^ 23.0 23.1 23.2 23.3 23.4 Emsley 2001,第451页
- ^ Buettner, K. M.; Valentine, A. M. Bioinorganic Chemistry of Titanium. Chemical Reviews. 2012, 112 (3): 1863. PMID 22074443. doi:10.1021/cr1002886.
- ^ 25.0 25.1 Greenwood 1997,第958页
- ^ Greenwood 1997,第970页
- ^ Greenwood & Earnshaw 1997,第960页
- ^ Greenwood & Earnshaw 1997,第967页
- ^ Greenwood & Earnshaw 1997,第961页
- ^ Liu, Gang; Huang, Wan-Xia; Yi, Yong. Preparation and Optical Storage Properties of λTi3O5 Powder. Journal of Inorganic Materials. 2013-06-26, 28 (4): 425–430. doi:10.3724/SP.J.1077.2013.12309 (中文).
- ^ Bonardi, Antonio; Pühlhofer, Gerd; Hermanutz, Stephan; Santangelo, Andrea. A new solution for mirror coating in $γ$-ray Cherenkov Astronomy. Experimental Astronomy. 2014, 38 (1–2): 1–9. Bibcode:2014ExA....38....1B. arXiv:1406.0622
 . doi:10.1007/s10686-014-9398-x.
. doi:10.1007/s10686-014-9398-x.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016: 962. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ Saha, Naresh. Titanium nitride oxidation chemistry: An x-ray photoelectron spectroscopy study. Journal of Applied Physics. 1992, no. 7 (7): 3072–3079. Bibcode:1992JAP....72.3072S. doi:10.1063/1.351465.
- ^ Schubert, E.F. The hardness scale introduced by Friederich Mohs (PDF). (原始内容 (PDF)存档于2010-06-03).],archive-web,archive-is
- ^ Truini, Joseph. Drill Bits. Popular Mechanics (Hearst Magazines). 1988-05, 165 (5): 91. ISSN 0032-4558.
- ^ Baliga, B. Jayant. Silicon carbide power devices. World Scientific. 2005: 91. ISBN 9812566058.
- ^ Seong, S.; et al. Titanium: industrial base, price trends, and technology initiatives. Rand Corporation. 2009: 10. ISBN 978-0-8330-4575-1.
- ^ Johnson, Richard W. The Handbook of Fluid Dynamics. Springer. 1998: 38–21. ISBN 3540646124.
- ^ Seong, S.; et al. Titanium: industrial base, price trends, and technology initiatives. Rand Corporation. 2009: 10. ISBN 083304575X.
- ^ Coates, Robert M.; Paquette, Leo A. Handbook of Reagents for Organic Synthesis. John Wiley and Sons. 2000: 93. ISBN 0470856254.
- ^ Greenwood & Earnshaw 1997,第965页
- ^ Grimmett, M. Ross. Imidazole and benzimidazole synthesis. Academic Press. 1997: 155. ISBN 0123031907.
- ^ Gundersen, Lise-Lotte; Rise, Frode; Undheim, Kjell; Méndez Andino, José. Titanium(III) Chloride. Encyclopedia of Reagents for Organic Synthesis. 2007. ISBN 978-0471936237. doi:10.1002/047084289X.rt120.pub2.
- ^ Tshuva, Edit Y.; Miller, Maya. Chapter 8. Coordination Complexes of Titanium(IV) for Anticancer Therapy. Sigel, Astrid; Sigel, Helmut; Freisinger, Eva; Sigel, Roland K. O. (编). Metallo-Drugs: Development and Action of Anticancer Agents 18. Berlin: de Gruyter GmbH. 2018: 219–250. ISBN 9783110470734. PMID 29394027. doi:10.1515/9783110470734-014.
|journal=被忽略 (帮助) - ^ 45.0 45.1 45.2 45.3 45.4 45.5 45.6 45.7 Emsley 2001,第452页
- ^ 46.0 46.1 Greenwood 1997,第955页
- ^ van Arkel, A. E.; de Boer, J. H. Preparation of pure titanium, zirconium, hafnium, and thorium metal. Zeitschrift für anorganische und allgemeine Chemie. 1925, 148: 345 – 50.
- ^ Yanko, Eugene; Omsk VTTV Arms Exhibition and Military Parade JSC. Submarines: general information. 2006 [2006-12-26].
- ^ Stainless Steel World. VSMPO Stronger Than Ever (PDF). KCI Publishing B.V. July/August 2001: 16–19 [2007-01-02].
- ^ National Materials Advisory Board, Commission on Engineering and Technical Systems (CETS), National Research Council. Titanium: Past, Present, and Future. Washington, DC: national Academy Press. 1983: R9. NMAB-392.
- ^ Titanium Metals Corporation. Answers.com. Encyclopedia of Company Histories,. Answers Corporation. 2006 [2007-01-02].
- ^ Defense National Stockpile Center. Strategic and Critical Materials Report to the Congress. Operations under the Strategic and Critical Materials Stock Piling Act during the Period October 2004 through September 2005 (PDF). United States Department of Defense. 2006: 3304.[永久失效链接]
- ^ Bush, Jason. Boeing's Plan to Land Aeroflot. 商业周刊BusinessWeek]]. 2006-02-15 [2006-12-29].
- ^ DuPont. U.S. Defense Agency Awards $5.7 Million to DuPont and MER Corporation for New Titanium Metal Powder Process. 2006-12-09 [2009-08-01].[永久失效链接],archive-web,archive-is
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988. Chapter 4. ISBN 0871703092.
- ^ Barksdale 1968,第733页
- ^ Chen, George Zheng; Fray, Derek J.; Farthing, Tom W. Direct electrochemical reduction of titanium dioxide to titanium in molten calcium chloride. Nature. 2000, 407: 361 – 64. doi:10.1038/35030069. Abstract
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988: 16, Appendix J. ISBN 0871703092.
- ^ ASTM International. Annual Book of ASTM Standards (Volume 02.04: Non-ferrous Metals). West Conshohocken, PA: ASTM International. 2006. section 2. ISBN 0-8031-4086-X. ASTM International. Annual Book of ASTM Standards (Volume 13.01: Medical Devices; Emergency Medical Services). West Conshohocken, PA: ASTM International. 1998. sections 2 & 13. ISBN 0-8031-2452-X.
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988. 13–16, Appendices H and J. ISBN 0871703092.
- ^ AWS G2.4/G2.4M:2007 Guide for the Fusion Welding of Titanium and Titanium Alloys. Miami: American Welding Society. 2006.,archive-web,archive-is
- ^ Titanium Metals Corporation. Titanium design and fabrication handbook for industrial applications. Dallas: Titanium Metals Corporation. 1997. (原始内容存档于2009-02-09).,archive-web,archive-is
- ^ Hampel, Clifford A. The Encyclopedia of the Chemical Elements. Van Nostrand Reinhold. 1968: 738. ISBN 0442155980.
- ^ United States Geological Survey. USGS Minerals Information: Titanium. 2006-12-21 [2006-12-29].
- ^ Smook, Gary A. Handbook for Pulp & Paper Technologists (3rd edition). Angus Wilde Publications. 2002: 223. ISBN 0-9694628-5-9.
- ^ Stevens, Lisa; Lanning, John A.; Anderson, Larry G.; Jacoby, William A.; Chornet, Nicholas. Photocatalytic Oxidation of Organic Pollutants Associated with Indoor Air Quality. Air & Waste Management Association 91st Annual Meeting & Exhibition, San Diego. June 14–18, 1998.
- ^ Moiseyev, Valentin N. Titanium Alloys: Russian Aircraft and Aerospace Applications. Taylor and Francis, LLC. 2006: 196. ISBN 9780849332739.
- ^ 68.0 68.1 Emsley 2001,第454页
- ^ Sevan, Vardan. Rosoboronexport controls titanium in Russia. Sevanco Strategic Consulting. 2006-09-23 [2006-12-26]. (原始内容存档于2012-11-11).,archive-web,archive-is
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988: 13. ISBN 0871703092.
- ^ GlobalSecurity. GlobalSecurity.org. April 2006 [2008-04-23].
- ^ Matthew J. Donachie, Jr. TITANIUM: A Technical Guide. Metals Park, OH: ASM International. 1988. 11–16. ISBN 0871703092.
- ^ Kleefisch, E.W. (编). Industrial Application of Titanium and Zirconium. West Conshohocken, PA: ASTM International. 1981. ISBN 0803107455.[永久失效链接],archive-web,archive-is
- ^ Rointan F. Bunshah, Editor. Handbook of Hard Coatings. Norwich, NY: William Andrew Inc. 2001: Ch. 8. ISBN 0815514387.
- ^ Bell, Tom; et al.. Heat Treating. Proceedings of the 20th Conference, 9–12 October 2000. ASM International. 2001: 141. ISBN 0871707276.
- ^ National Corvette Museum. Titanium Exhausts. 2006 [2006-12-26]. (原始内容存档于2013-01-03).
- ^ Davis, Joseph R. Metals Handbook. ASM International. 1998: 584. ISBN 0871706547.
- ^ 78.0 78.1 78.2 78.3 78.4 78.5 78.6 Donachie, Matthew J. Titanium: A Technical Guide. ASM International. 2000: 11, 255. ISBN 0871706865.
- ^ Fine Art and Functional Works in Titanium and Other Earth Elements. [2009-08-08]. (原始内容存档于2008-05-13).
- ^ Lütjering, Gerd; Williams, James Case. Appearance Related Applications. Titanium. 2007-06-12. ISBN 9783540713975.
- ^ Denver Art Museum, Frederic C. Hamilton Building. SPG Media. 2006 [2006-12-26].
- ^ Gruntman, Mike. Blazing the Trail: The Early History of Spacecraft and Rocketry. Reston, VA: American Institute of Aeronautics and Astronautics. AIAA: 457. ISBN 156347705X.
- ^ Apple PowerBook G4 400 (Original - Ti) Specs. [2009-08-08].
- ^ 鴻海、亞馬遜、騰訊力挺,Essential 鈦合金手機量產. [2017-08-10].
- ^ Gafner, G. The development of 990 Gold-Titanium: its Production, use and Properties (PDF). Gold Bulletin. 1989, 22 (4): 112–122. doi:10.1007/BF03214709. 原始内容存档于2010-11-29.
- ^ Fine Art and Functional Works in Titanium and Other Earth Elements. [2009-08-08]. (原始内容存档于2008-05-13).
- ^ Alwitt, Robert S. Electrochemistry Encyclopedia. 2002 [2006-12-30]. 原始内容存档于2008-07-02.
- ^ Body Piercing Safety. doctorgoodskin.com. [2009-08-01].
- ^ World Firsts | British Pobjoy Mint. www.pobjoy.com. [2017-11-11] (英语).
- ^ Turgeon, Luke. Titanium Titan: Broughton immortalised. The Gold Coast Bulletin. 2007-09-20. 原始内容存档于2013-09-28.
- ^ Orthopaedic Metal Alloys. Totaljoints.info. Retrieved on 2010-09-27.
- ^ Titanium foams replace injured bones - Research News 09-2010-Topic 1 – Fraunhofer-Gesellschaft. Fraunhofer.de. Retrieved on 2010-09-27.
- ^ Shoesmith, D. W.; Noel, J. J.; Hardie, D.; Ikeda, B. M. Hydrogen Absorption and the Lifetime Performance of Titanium Nuclear Waste Containers. Corrosion Reviews. 2000, 18 (4–5). doi:10.1515/CORRREV.2000.18.4-5.331.
- ^ Carter, L. J.; Pigford, T. J. Proof of Safety at Yucca Mountain. Science. 2005, 310 (5747): 447. PMID 16239463. doi:10.1126/science.1112786.
- ^ Elekes, Carmen Cristina; Busuioc, Gabriela. The Mycoremediation of Metals Polluted Soils Using Wild Growing Species of Mushrooms (PDF). Engineering Education. [2014-01-28]. (原始内容 (PDF)存档于2016-03-03).
- ^ Cotell, Catherine Mary; Sprague, J. A.; Smidt, F. A. ASM Handbook: Surface Engineering 10th. ASM International. 1994: 836. ISBN 087170384X.
- ^ Compressed Gas Association. Handbook of compressed gases 4th. Springer. 1999: 323. ISBN 0412782308.
- ^ Solomon, Robert E. Fire and Life Safety Inspection Manual. National Fire Prevention Association 8th. Jones & Bartlett Publishers. 2002: 45. ISBN 0877654727.
- 元素钛在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钛(英文)
- 元素钛在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钛在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钛(英文)
- “钛:我们的下一种主要金属”,《科技新时代》1950年8月号–最早一篇对公众详细报导钛的文章(英文)
- 更干净更廉价地走向钛的一条路线(英文)
- 国际钛协会(英文)
- 钛与其合金的冶金学——剑桥大学(英文)
- 按国家区分的世界钛精矿生产量(英文)
- 火花中的真相:钛还是朴实的老钢?《科技新时代》杂志(英文)
- archive-web,archive-is
- 神的金属(英文)
- http://baike.asianmetal.cn/metal/ti/application.shtml

