氙(拼音:xiān,注音:ㄒㄧㄢ,粤拼:sin1;英语:Xenon;旧译氠[9]、氥[10]、𣱧[11])是一种化学元素,其化学符号为Xe,原子序数为54,原子量为131.293 u。氙是一种无色、无味的稀有气体。地球大气层中含有痕量的氙。 [12]虽然氙的化学活性很低,但是它仍然能够进行化学反应,例如形成六氟合铂酸氙──首个被合成的稀有气体化合物。[13][14][15]
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
无色气体,在高压放电管中呈现紫蓝色 氙的光谱线 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 氙(Xenon)·Xe·54 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 稀有气体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 18 ·5·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 131.293(6) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d10 5s2 5p6 2, 8, 18, 18, 8 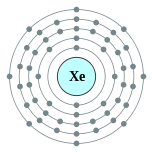 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 威廉·拉姆齐和莫里斯·特拉弗斯(1898年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 威廉·拉姆齐和莫里斯·特拉弗斯(1898年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 气态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 5.894 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点时液体密度 | 3.057[1] g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | (101.325 kPa)161.4 K,-111.7 °C,-169.1 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | (101.325 kPa)165.03 K,-108.12 °C,-162.62 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相点 | 161.405 K(−112 °C),81.6[2] kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 289.77 K,5.841 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (101.325 kPa)2.27 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | (101.325 kPa)12.64 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 5R/2 = 20.786 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 0, +1, +2, +4, +6, +8 (很少大于0) (氧化物具弱酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 2.6(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:1170.4 kJ·mol−1 第二:2046.4 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 140±9 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 216 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 面心立方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 5.65×10-3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速 | (液态)1090 m/s;(气态)169 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-63-3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氙的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
自然产生的氙由7种稳定同位素组成。氙还有40多种不稳定的放射性同位素。氙同位素的相对比例对研究太阳系早期历史有重要的作用。[16]具放射性的氙-135是核反应堆中最重要的中子吸收剂,可通过碘-135发生负β衰变产生。[17]
氙可用在闪光灯[18]和弧灯中,[19]或作全身麻醉药。[20]最早的准分子激光设计以氙的二聚体分子(Xe2)作为激光介质,[21]而早期激光设计亦用氙闪光灯作激光抽运。[22]氙还可以用来寻找大质量弱相互作用粒子[23],或作航天器离子推力器的推进剂。[24]
英国化学家威廉·拉姆齐和莫里斯·特拉弗斯(Morris Travers)在发现了氪和氖后,于1898年7月12日在蒸发液态空气后的残留物中发现了氙。[25][26]拉姆齐建议把这一新元素命名为“xenon”,源自希腊语“ξένον”(xenon),即“ξένος”(xenos)的中性单数形,意为外来者、陌生人或异客。[27][28]1902年,拉姆齐估算氙在地球大气中的含量为2千万分之一。[29]
1930年代,美国工程师哈罗德·尤金·艾杰顿(Harold Eugene Edgerton)开始为高速摄影研究频闪灯,并发明了氙闪光灯。在氙闪光灯中,电流短暂通过含有氙气的玻璃管,使其发光。到了1934年,艾杰顿已经能够产生1微秒长的闪光。[18][30][31]
1939年,美国医生阿尔伯特·本克(Albert R. Behnke Jr.)着手研究深海潜水员有“酒醉感”的原因。他在测试对象所呼吸的气体中调整各种气体的比例,并发现潜水员对深度的感觉有所变化。他以此推论,氙气能够用于麻醉。俄罗斯毒理学家尼克拉·拉萨列夫(Nikolay V. Lazarev)曾在1941年研究过氙麻醉药,但直到1946年美国医学家约翰·劳伦斯(John H. Lawrence)才发表了他对老鼠进行的一项实验研究,首次证实了氙作为麻醉药的效用。1951年,美国麻醉师斯图尔特·科林(Stuart C. Cullen)第一次使用氙麻醉药,并成功为两名病人进行了手术。[32]
氙以及其他稀有气体曾一直被认为是完全惰性的,无法形成化合物。不过,化学家尼尔·巴特莱特(Neil Bartlett)在不列颠哥伦比亚大学任教时,发现六氟化铂(PtF6)气体是一种强氧化剂,能够氧化氧气(O2),形成六氟合铂酸氧(O2+[PtF6]–)。[33]因为O2和氙的第一电离能几乎相同,所以巴特莱特猜想,氙也有可能可以被六氟化铂氧化。1962年3月23日,他将这两种气体混合,产生了第一种稀有气体化合物六氟合铂酸氙。[34][15]他当时认为该气体产物为Xe+[PtF6]–,但之后的分析表明该气体很可能是多种氙盐的混合物。[35][36][37]此后,许多其他的氙化合物也陆续被发现,[38]而同时被发现的还包括氩、氪和氡等稀有气体的化合物,如氟氩化氢(HArF)、[39]二氟化氪(KrF2)[40][41]及二氟化氡。[42]到了1971年,已知的氙化合物已经超过了80种。[43][44]

氙的原子序为54,即每一个氙原子核中共有54颗质子。在标准温度和压力下,纯氙气的密度为5.761 kg/m3,也就是地球地面大气密度(1.217 kg/m3)的4.5倍左右。[45]当处于液态时,氙的密度可高达3.100 g/mL,最高密度在三相点处达到。[46]固态氙的密度为3.640 g/cm3,比花岗岩的2.75 g/cm3更高。[46]当压力超过10亿帕斯卡时,氙会呈金属态。[47]
在大约140 GPa压力下,固体氙的晶体结构会从面心立方转变为六方密排,并开始呈现金属特性。氙在155 GPa压力以上完全进入金属态。这时候的氙会吸收红光,因此会呈天蓝色。这一特性在金属中较为罕见,原因是氙在金属态下的电子能带宽度较小。[48][49]
氙的化合价为0,与其他零价元素同属于稀有气体,亦称稀有气体。氙对大部分化学反应都呈惰性(如燃烧反应),因为它有8个价电子。这使外层电子处于最低能量排布,因此非常稳定。[50]
当电弧通过装有氙气的玻璃管时,氙会被激发而发出蓝至淡紫色光。氙的发射谱线横跨整个可见光谱,[51]其最强的光谱线位于蓝光部分,所以整体发蓝光。[52]
氙是地球大气层中的一种微量气体,含量约为10亿分之87±1(nL/L),亦即1150万分之一。[53]某些天然矿泉也会释放出含有氙的气体。[54][55]
氙是空气氮氧分离过程的副产品。这一过程一般在双柱式分馏塔中进行,所产生的液氧中会含有少量的氪和氙。再进行更多的分馏步骤之后,液氧中的氪和氙含量可以提高至0.1至0.2%。这些氪和氙可以通过硅胶吸附或蒸馏提取出来,混合物再经蒸馏分离成氪和氙。[56][57]从大气层中提取一升氙气需要220瓦小时的能量。[58]1998年,全球氙产量为5千至7千 m3。[59]由于含量稀少,氙的价格比其他更轻的稀有气体高许多:1999年欧洲的氙气价格为每升10欧元,氪气每升1欧元,氖气每升0.20欧元,[59]
在太阳系以内,氙元素的核素比例为1.56 × 10−8,质量丰度为63万分之一。[60]太阳大气层、地球、小行星及彗星中的氙含量很低。木星大气层含有异常高的氙元素,含量约为太阳的2.6倍。[61][注 1]这一现象的原因不详,但有可能是因为在太阳系形成早期太阳星云温度提升之前,微行星迅速堆积所致。[62]地球上的氙存量很低,这可能是由于氙和氧在石英中产生共价键,从而减少氙被释入大气层的量。[63]
与轻稀有气体不同的是,恒星核合成过程无法制造氙元素。所有包括氙在内比铁-56更重的元素经核聚变合成时,会产生净能量损失,因此无法在恒星内部形成。[64]能够形成氙的自然过程包括:超新星爆炸,[65]红巨星用尽氢燃料进入渐近巨星分支后的慢中子捕获过程(s-过程),[66]一般新星爆炸,[67]以及碘、铀和钚等元素的放射性衰变。 [68]
自然形成的氙共由7种稳定同位素组成,在各元素中排第二位。第一位是锡,其稳定同位素共有10个。稳定同位素数量高于7个的元素只有锡。[69]同位素134Xe根据预测能够进行双重β衰变,但这未经实验证明,因此该同位素仍被认为是稳定的。[70]除这些稳定同位素之外,氙还有40多种不稳定同位素。其中寿命最长的为124Xe,它会进行双电子俘获衰变,半衰期为1.8×1022年。[6] 129I在β衰变后,会产生129Xe同位素。该反应的半衰期为1600万年。另外131mXe、133Xe、133mXe和135Xe都是235U和239Pu的核裂变产物,[68]因此被用作探测核爆炸的发生。[71]
氙的其中两种稳定同位素129Xe和131Xe具有非零的固有角动量(自旋,可用于核磁共振)。利用圆极化光和铷气体,氙的核自旋对齐可以超越普通的极化。[72]如此产生的自旋极化能够超过其最高可能值的50%,远远大于玻尔兹曼分布的平衡值(在室温下通常不超过最高值的0.001%)。这种非平衡态的自旋对齐是短暂的,称为超极化现象。对氙进行超极化的过程叫做光抽运(但不同于激光抽运)。[73]
由于129Xe原子核的自旋为1/2,所以其电四极矩为零,故129Xe核在与其他原子撞击时,不会有任何四极相互作用。这使得它的超极化状态能够持续更长的时间,甚至在激光束关闭及碱气体在室温表面冷凝后,仍能保留该状态。129Xe的自旋极化在血液中能持续数秒,[74]在气态下持续数小时,[75]并在深度冷冻的固态下持续数天。[76]相比之下,131Xe的核自旋为3/2,四极矩不为零,其T1弛豫时间位于毫秒至秒区间内。[77]
氙的某些同位素,如133Xe和135Xe,可在核反应堆中对可以裂变物质进行中子照射产生。[13]135Xe在核裂变反应堆中具有重要的作用。135Xe的热中子截面很高(2.6×106靶恩),[17]因此可用作中子吸收剂或中子毒物,从而减慢或停止链反应。美国曼哈顿计划中用来产生钚元素的最早期反应堆就用到了氙的这一作用。[78]135Xe在反应堆中作为中子毒物,对切尔诺贝尔核事故有着重要的影响。[79]反应堆的关闭或功率的降低可以造成135Xe的积聚,使反应堆进入所谓的氙中毒状态(又称氙坑、碘坑)。[80][81]
在不利条件下,高浓度的放射性氙同位素可以从核反应堆中释放出来,来源包括裂变产物从开裂的燃料棒中释出,[82]或冷却水中的铀进行裂变。[83]
陨石中的氙同位素比例可以用来研究太阳系的形成和演化。碘氙放射性定年法可以测定核合成至太阳星云中固体物体缩合之间的时间。1960年,物理学家约翰·雷诺(John H. Reynolds)发现某些陨石中的氙-129含量异常高。他推断这是碘-129的衰变产物。这一同位素可经宇宙射线散裂和核裂变缓慢产生,但只有在超新星爆炸中才能大量产生。由于129I的半衰期(1600万年)相对宇宙时长来说非常短,因此可推论从超新星爆炸到陨石凝固之间经过的时间很短。一颗超新星在太阳系形成前不久爆炸,产生129I同位素之余,可能也导致了前太阳气体云的收缩。[84][85]
利用类似的方法,其他氙同位素比例也可以用来研究行星分化和气体释放过程,包括129Xe/130Xe和136Xe/130Xe。[16]例如,火星大气层的氙含量与地球相似,约为百万分之0.08,[86]但其129Xe比例比地球和太阳高。这一同位素是由放射性衰变产生的,所以火星很可能在形成后约1亿年以内丧失了大部分的原始大气。[87][88]美国新墨西哥州二氧化碳井气中所发现的高比例129Xe是地球形成不久后经地幔核衰变产生的气体之一。[68][89]
尼尔·巴特莱特在1962年发现氙能够形成化合物之后,许多其他的氙化合物也陆续被发现和研究。几乎所有氙化合物都含有电负性高的氟或者氧。[90]
卤化物
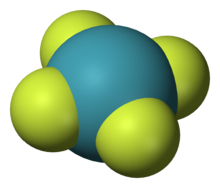

氙共有三种已知氟化物:二氟化氙(XeF2)、四氟化氙(XeF4)及六氟化氙(XeF6)。理论预测XeF是不稳定的。[91]几乎所有氙化合物都含有电负性原子氟或氧。[92]
二氟化氙(XeF2)是一种固体晶体,在氟与氙混合物经紫外光照射后形成,[93](使用一般日光含的紫外光就已足够。)[94]XeF2在高温下用NiF2催化剂长时间加温会产生XeF6。[95]XeF6在NaF中经热裂解后可以形成高纯度XeF4。[96]
氙的氟化物都可以作为氟离子受体和予体,形成如XeF+和Xe2F+3等正离子,以及XeF−5、XeF−7和XeF2−8等负离子。XeF2经氙气还原后,会形成绿色的顺磁性Xe+2离子。[90]
XeF2可以与过渡金属离子形成配合物。已知的配合物已超过30种。[95]
虽然人们对氙的氟化物已有一定的了解,但是对其他的卤化物则几乎一无所知。唯一已知的卤化物为二氯化氙(XeCl2)。二氯化氙是一种吸热的无色晶体,在80°C以上会分解成其组成元素。对氙、氟及四氯化硅或四氯化碳的混合物进行高频率光照射会形成二氯化氙。[97]但是人们未知XeCl2是确实的化合物,还是由氙原子和Cl2分子弱结合形成的范德华分子。[98]理论计算指出,直线型XeCl2分子比范德华分子较不稳定。[99]
氧化物及卤氧化物
氙共有三种已知氧化物:二氧化氙(XeO2)、三氧化氙(XeO3)及四氧化氙(XeO4)。二氧化氙在2011年被发现,配位数为4,[100]XeO2是在四氟化氙与水冰反应后形成的。其晶体结构特殊,有可能能够取代硅酸盐矿物中的硅。[101]科学家利用红外光谱分析在固体氩当中发现了XeOO+正离子。[102]固态三氧化氙和四氧化氙都是爆炸性很强的物质。[103][104]
氙不会和氧直接进行反应。三氧化氙是经XeF6的水解反应形成的:[105]
XeO3具弱酸性,会在碱中溶解成含HXeO−4负离子的不稳定氙酸盐。这些不稳定盐会很快歧化成氙气和含XeO4−6负离子的高氙酸盐。[106]
高氙酸钠或高氙酸钡在浓硫酸中会产生浅黄色固态四氧化氙:[97]
氙有多个已知的氟氧化物,包括二氟一氧化氙(XeOF2)、四氟一氧化氙(XeOF4)、二氟二氧化氙(XeO2F2)及二氟三氧化氙(XeO3F2)。二氟化氧(OF2)与氙气在低温下反应会形成XeOF2;XeF4的部分水解也可产生XeOF2。它在−20℃以上会歧化成XeF2和XeO2F2。[107]XeF6的部分水解会产生XeOF4[108];XeF6与高氙酸钠(Na4XeO6)反应后也可形成XeOF4。第二种反应会同时产生少量的XeO3F2。XeOF4与CsF反应后会形成XeOF−5负离子,[107][109]而XeOF3会和KF、RbF和CsF反应形成XeOF−4负离子。[110]
氙的氟化物都与水发生反应,XeF2在水中的溶解度为0.15 mol/L(273K),能将水氧化。
XeF4与水的反应中,一半用于氧化水,另外一半发生了歧化反应。总反应为:
XeF6有强氧化性,但由于生成的XeO3在水中溶解且稳定,XeF6在水中只发生水解反应。
其他化合物
科学家近期开始研究氙能否与电负性比氟和氧低的元素形成化合物,其中特别包括碳。[111]要使这些化合物稳定,必须使用吸电子基团,如经氟取代形成的基团。[106]已知的含碳化合物包括:[107][112]
- C6F5–Xe+–N≡C–CH3,其中的C6F5是五氟苯基。
- [C6F5]2Xe
- C6F5–Xe–X,X可以是CN、F或Cl。
- R–C≡C–Xe+,R可以是C2F−5或叔丁基。
- C6F5–XeF+2
- (C6F5Xe)2Cl+
其他含有电负性较低的氙化合物包括F–Xe–N(SO2F)2和F–Xe–BF2。F–Xe–BF2可以从四氟硼酸二氧O2BF4在−100℃温度下合成。[107][113]
四氙合金(II)离子(AuXe2+4)非常特殊,它含有氙﹣金键。[114]氙和金都是极不活跃的元素,成键时以氙作为过渡金属配位体。之一离子出现在AuXe4(Sb2F11)2当中。
Xe2Sb2F11含有氙﹣氙键,这是两个元素间已知最长的键(308.71 pm = 3.0871 Å)。[115]
1995年,芬兰赫尔辛基大学的马尔库·拉萨宁(Markku Räsänen)等人宣布成功合成HXeH,并其后宣布合成HXeOH、HXeCCH以及其他氙化合物分子。[116]2008年,利奥尼德·赫里亚切夫(Leonid Khriachtchev)等人宣布,他们在低温氙基体内对水进行光解后合成了HXeOXeH。[117]他们也合成了含氘的分子,如HXeOD和DXeOH。[118]
包合物及准分子
除了可以在化合物中形成化学键之外,氙原子还能嵌在另一种化合物的晶体结构当中,形成包合物。这包括水合氙(Xe·5.75 H2O),其中氙原子位于水分子形成的晶体结构空隙中。[119]这种包合物的熔点为24℃。[120]科学家也改用氘合成了该包合物。[121]这类水合包合物可以在高压条件下自然形成,例如南极洲冰盖下的沃斯托克湖。[122]包合物的形成可以用在分馏过程中,以分离氙、氩和氪。[123]
氙还可以形成内嵌富勒烯化合物,即内嵌氙原子的富勒烯分子。富勒烯里面的氙原子可以通过129Xe核磁共振光谱分析来观测。科学家可利用这种方法分析富勒烯分子的化学反应,因为其中的氙原子对周围环境十分敏感,并进行化学位移。然而,氙原子也会对富勒烯的化学活性产生影响。[124]
当氙原子处于基态的时候,会互相排斥,无法成键。但当它们受到激发后,就能够形成准分子(激发态二聚体),直到电子回到基态。氙原子一般会填满其最外电子层,邻近的氙原子就可以为其提供电子。氙准分子的一般存留时长为1至5纳秒,其衰变会释放波长约为150和173纳米的光子。[125][126]氙还能与其他元素结合成准分子,例如溴、氯及氟。[127]
照明及光学
氙可用于发光,应用包括:用于摄影的氙闪光灯,[18]激发激光媒介以产生相干光,以及[128]杀菌灯等。[129]1960年发明的首个固态激光器[22]及推动惯性约束聚变的激光器都用到了氙闪光灯作激光抽运。[130]



氙弧灯能够连续发光,其色温近似于正午的日光,因此被用于模拟阳光。1940年氙弧灯进入市场后,开始淘汰寿命较短的碳弧灯作为电影放映机的光源。[19]这种光源被用在一般35毫米胶片、IMAX和新型数码投影机的电影投影、高强度气体放电灯车头灯、高端军用电筒以及其他专业用途。这种弧灯能发出短波长紫外线,以及可被用于夜视镜的近红外线。
等离子显示器中的发光体装有氙和氖,并经电极转化成等离子状态。该等离子体与电极之间的作用会产生紫外光,从而激发显示器前部的磷质涂层,发出可见光。[131][132]
氙也被用于启动高压钠灯。氙的热导率和电离能是所有非放射性稀有气体中最低的。其化学惰性能避免对化学反应的干预;低热导率可降低灯在运作时的热能损失;低电离能则使氙在非高温状态下的击穿电压相对较低,令灯更容易启动。[133]
1962年,贝尔实验室研究人员发现了氙的激光作用,[134]又接着发现在激光介质中加入氦能够提升激光增益。[135][136]首个准分子激光使用电子来激发氙的二聚体(Xe2),以产生波长为176纳米的紫外光,该过程称为受激发射。[21]氯化氙和氟化氙准分子也可用于激光器中。[137]例如,皮肤病学就用到氯化氙准分子激光。[138]
医学
氙是一种全身麻醉剂。氙较为昂贵,但由于回收循环技术的提升和成本的降低,使用氙的麻醉机将在不久后进入欧洲市场。[58][139]
氙会和多种不同受体和离子通道相互作用。根据理论,这种多模态吸入性麻醉剂很可能具互补性。氙是一种具高亲和力的甘氨酸结合部位NMDA受体拮抗剂。[140]不过,与其他的NMDA受体拮抗剂不同的是,氙不具神经毒性,且能够抑制氯胺酮和一氧化二氮的神经毒性。[141][142]氙不会像氯胺酮和一氧化二氮一样刺激伏隔核释放多巴胺。[143]
氙是血清素5-HT3的竞争性抑制剂。这并不产生麻醉或镇痛的效果,但可以减少麻醉剂相关的恶心和呕吐感。[144]
氙在40岁人体内的最小肺泡浓度为72%,所以麻醉效果比N2O强44%。[145]因此相对氧气的使用浓度无需太高,有助避免缺氧。另外与一氧化二氮不同的是,氙不是温室气体,所以较为环保。[146]
放射性同位素133Xe的伽马射线可用来对心、肺和脑进行成像,例如单光子发射电脑摄影。133Xe也被用于测量血流。[147][148][149]
氙是一种很好的磁共振成像(MRI)造影剂。氙气可以用来对多孔组织的空间和肺泡进行成像。超极化的129Xe同位素在磁共振成像仪中更易检测,所以被用于研究包括肺在内的各种器官,例如肺内气体的流动。[150][151]氙可溶于水,又可溶于疏水性溶剂,这有助于对软组织进行成像。[152][153][154]
核磁共振波谱法
由于氙拥有较大、较敏感的外电子层,所以其核磁共振光谱会对氙原子周围的化学条件有相应的变化。例如,溶于水、疏水性溶剂和某些蛋白质的氙可通过核磁共振波谱法区分开来。[155][156]
氙也应用在表面科学中。核磁共振一般很难检测样本的表面,因为表面底下的大量原子核会完全盖过有用的信号。超极化的氙气能够将自身的自旋只传递到固体表面,使表面所发出的信号可以与样本内部的信号区分开来。[157][158]
其他
原子核物理学的气泡室可以使用氙。[159]氙也可用于任何需要高分子(原子)质量、低反应性物质的用途。核武器试验所产生的副产品中有具放射性的氙-133和氙-135。通过测量这些同位素,人们可以判断是否有国家进行核试验,[160]其中包括朝鲜。[161]

科学家利用液态氙热量计[162]来测量伽马射线,并用液态氙寻找大质量弱相互作用粒子(WIMP)。理论预测,当WIMP撞击氙原子核,会移除一颗电子,产生闪烁。如果使用氙,这一闪烁可以轻易地从其他由宇宙射线所造成的能量爆发分辨开来。[23]不过,意大利大萨索国家实验室(Laboratori Nazionali del Gran Sasso)的“XENON”实验以及英国伯比地底实验室(Boulby Underground Laboratory)的ZEPLIN-II和ZEPLIN-III实验都还没有找到证实WIMP存在的证据。虽然没有发现WIMP,但这些实验有助于缩小暗物质的可能属性范围,以及改进相关的物理模型。[163][164]
氙的电离能很低,是一种很好的航天器离子推力器推进剂。氙在室温下能够以液态储存,在推力器运作时可轻易转化为气体。由于氙的化学惰性,它不会对环境造成破坏,或像汞或铯等其他燃料一样侵蚀离子推进器。1970年代,某些人造卫星开始使用氙离子推进器。[165]美国的深空一号和曙光号探测器以及欧洲的SMART-1飞行器都用到了氙离子推进器。[24][166]
高氙酸盐可在分析化学中用作氧化剂。二氟化氙是一种硅的腐蚀剂,应用在微机电系统中。[167]二氟化氙与尿嘧啶反应后,会产生抗癌药物5-氟尿嘧啶。[168]氙在X射线晶体学中可用来研究蛋白质的结构和功用。氙气在压力为0.5至5 MPa(5至50 atm)的时候,其原子会结合到蛋白质晶体的疏水性孔穴中。这一产物含有更高质量的原子,但不改变原先的晶体结构,因此可被用于解相位问题。[169][170]
许多含氧的氙化合物都是具有毒性的强氧化剂。同时因为很容易分解成氙元素和氧分子(O2),这些化合物还具有爆炸性。[171]
氙气在标准温度和压力下可以安全地存放在一般的玻璃或金属容器中。由于氙可溶于大部分塑料和橡胶,因此会从这些材料的容器中慢慢逃逸出去。[172]氙本身并不具毒性,但它可溶于血,并且可以穿透血脑屏障。氙与氧气混合后吸入,可以达到手术麻醉剂的效果。[171]
氙气中的音速为每秒169米,比空气中的音速低。[注 2]这是由于氙原子较氧和氮分子重,因此平均速度较低。当声道中充满氙气时,共振频率会降低。因此吸入氙气后说话的音色会比正常低沉,与吸入氦气后音色提高的现象相反。氙的麻醉效果比一氧化二氮强,而过量吸入氙气也会造成窒息。因此,许多大学在进行有关气体改变音色的化学演示时,已不再使用氙气,而改用分子量相近的六氟化硫气体。虽然过量吸入六氟化硫仍会造成窒息,但是它不具麻醉效果。[174]
如果氙气与氧气混合,而氧气含量至少有20%,那人体是可以安全吸入的。80%氙气和20%氧气的混合气体会迅速使人失去意识,因此在医学手术中被用作全身麻醉剂。呼吸作用会有效地混合不同密度的气体,所以较重的氙气并不会积聚在肺的底部,而是会和其他气体一起呼出。[175]然而如果大量氙气在密闭空间中泄漏出来,会在底部积聚。由于氙无色、无味,所以当人员进入该空间时,很可能会不经意地吸入大量的氙气。一般的氙气储存量并不足以导致这种情况的发生,但在任何缺乏通风的空间中存放氙都具有以上的潜在危险。[176]
- ^ 计算所用的太阳系平均原子质量为1.29 amu。
- ^ 在0℃,107 KPa条件下,氙气的音速为169.44 m/s,空气的音速为344 m/s。[173]
- ^ Krypton. Gas Encyclopedia. Air Liquide. 2009 [2013-12-13]. (原始内容存档于2015-06-02).
- ^ Section 4 "Properties of the Elements and Inorganic Compounds; Melting, boiling, triple, and critical temperatures of the elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Magnetic susceptibility of the elements and inorganic compounds (页面存档备份,存于互联网档案馆), in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Simpson, J. A.; Weiner, E. S. C. (编). Xenon. Oxford English Dictionary 20 2nd. Clarendon Press. 1989. ISBN 0-19-861232-X.
- ^ Xenon. Dictionary.com Unabridged. 2010 [2013-12-13]. (原始内容存档于2013-11-22).
- ^ 6.0 6.1 David Nield. A Dark Matter Detector Just Recorded One of The Rarest Events Known to Science. 2019-04-26 [2019-04-29]. (原始内容存档于2019-04-26).
- ^ Ackerman, N.; et.al. Observation of Two-Neutrino Double-Beta Decay in 136Xe with the EXO-200 Detector. Physical Review Letters. 2011, 107 (21): 212501. Bibcode:2011PhRvL.107u2501A. doi:10.1103/PhysRevLett.107.212501.
- ^ Redshaw, Matthew; et al. Mass and Double-Beta-Decay Q Value of 136Xe. Physical Review Letters. 2007年2月, 98 (5) [2013-12-13]. doi:10.1103/PhysRevLett.98.053003.
- ^ 異體字字典. [2015-04-28]. (原始内容存档于2015-07-03).
- ^ 異體字字典. [2015-04-28]. (原始内容存档于2015-07-03).
- ^ 異體字字典. [2015-04-28]. (原始内容存档于2015-07-03).
- ^ Staff. Xenon. Columbia Electronic Encyclopedia 6th. Columbia University Press. 2007 [2013-12-13]. (原始内容存档于2013-10-02).
- ^ 13.0 13.1 Husted, Robert; Boorman, Mollie. Xenon. Los Alamos National Laboratory, Chemical Division. 2003-12-15 [2013-12-13]. (原始内容存档于2013-02-14).
- ^ Rabinovich, Viktor Abramovich; Vasserman, A. A.; Nedostup, V. I.; Veksler, L. S. Thermophysical properties of neon, argon, krypton, and xenon English-language. Washington, DC: Hemisphere Publishing Corp. 1988 [2013-12-13]. ISBN 0-89116-675-0. (原始内容存档于2017-11-18). —National Standard Reference Data Service of the USSR. Volume 10.
- ^ 15.0 15.1 Freemantel, Michael. Chemistry at its Most Beautiful (PDF). Chemical & Engineering News. 2003-08-25 [2013-12-13]. (原始内容存档 (PDF)于2016-01-06).
- ^ 16.0 16.1 Kaneoka, Ichiro. Xenon's Inside Story. Science. 1998, 280 (5365): 851–852. doi:10.1126/science.280.5365.851b.
- ^ 17.0 17.1 Stacey, Weston M. Nuclear Reactor Physics. Wiley-VCH. 2007: 213 [2013-12-13]. ISBN 3-527-40679-4.
- ^ 18.0 18.1 18.2 Burke, James. Twin Tracks: The Unexpected Origins of the Modern World. Oxford University Press. 2003: 33. ISBN 0-7432-2619-4.
- ^ 19.0 19.1 Mellor, David. Sound Person's Guide to Video. Focal Press. 2000: 186 [2013-12-13]. ISBN 0-240-51595-1.
- ^ Sanders, Robert D.; Ma, Daqing; Maze, Mervyn. Xenon: elemental anaesthesia in clinical practice. British Medical Bulletin. 2005, 71 (1): 115–135. PMID 15728132. doi:10.1093/bmb/ldh034.
- ^ 21.0 21.1 Basov, N. G.; Danilychev, V. A.; Popov, Yu. M. Stimulated Emission in the Vacuum Ultraviolet Region. Soviet Journal of Quantum Electronics. 1971, 1 (1): 18–22. Bibcode:1971QuEle...1...18B. doi:10.1070/QE1971v001n01ABEH003011.
- ^ 22.0 22.1 Toyserkani, E.; Khajepour, A.; Corbin, S. Laser Cladding. CRC Press. 2004: 48 [2013-12-13]. ISBN 0-8493-2172-7.
- ^ 23.0 23.1 Ball, Philip. Xenon outs WIMPs. Nature. 2002-05-01 [2007-10-08]. (原始内容存档于2019-05-02).
- ^ 24.0 24.1 Saccoccia, G.; del Amo, J. G.; Estublier, D. Ion engine gets SMART-1 to the Moon. ESA. 2006-08-31 [2007-10-01]. (原始内容存档于2007-10-17).
- ^ Ramsay, W.; Travers, M. W. On the extraction from air of the companions of argon, and neon. Report of the Meeting of the British Association for the Advancement of Science. 1898: 828.
- ^ Gagnon, Steve. It's Elemental – Xenon. Thomas Jefferson National Accelerator Facility. [2013-12-13]. (原始内容存档于2013-02-16).
- ^ Anonymous. Daniel Coit Gilman, Harry Thurston Peck, Frank Moore Colby , 编. The New International Encyclopædia. Dodd, Mead and Company. 1904: 906.
- ^ Staff. The Merriam-Webster New Book of Word Histories. Merriam-Webster, Inc. 1991: 513 [2013-12-13]. ISBN 0-87779-603-3.
- ^ Ramsay, William. An Attempt to Estimate the Relative Amounts of Krypton and of Xenon in Atmospheric Air. Proceedings of the Royal Society of London. 1902, 71 (467–476): 421–426. doi:10.1098/rspl.1902.0121.
- ^ Anonymous. History. Millisecond Cinematography. [2007-11-07]. (原始内容存档于2006-08-22).
- ^ Paschotta, Rüdiger. Lamp-pumped lasers. Encyclopedia of Laser Physics and Technology. RP Photonics. 2007-11-01 [2013-12-13]. (原始内容存档于2013-12-12).
- ^ Marx, Thomas; Schmidt, Michael; Schirmer, Uwe; Reinelt, Helmut. Xenon anesthesia (PDF). Journal of the Royal Society of Medicine. 2000, 93 (10): 513–517 [2007-10-02]. PMC 1298124
 . PMID 11064688. (原始内容 (PDF)存档于2008-03-06).
. PMID 11064688. (原始内容 (PDF)存档于2008-03-06).
- ^ Bartlett, Neil; Lohmann, D. H. Dioxygenyl hexafluoroplatinate (V), O2+[PtF6]–. Proceedings of the Chemical Society (London: Chemical Society). 1962, (3): 115. doi:10.1039/PS9620000097.
- ^ Bartlett, N. Xenon hexafluoroplatinate (V) Xe+[PtF6]–. Proceedings of the Chemical Society (London: Chemical Society). 1962, (6): 218. doi:10.1039/PS9620000197.
- ^ Graham, L.; Graudejus, O.; Jha N.K.; Bartlett, N. Concerning the nature of XePtF6. Coordination Chemistry Reviews. 2000, 197 (1): 321–334. doi:10.1016/S0010-8545(99)00190-3.
- ^ Holleman, A. F.; Wiberg, Egon. Bernhard J. Aylett , 编. Inorganic Chemistry. translated by Mary Eagleson and William Brewer. San Diego: Academic Press. 2001. ISBN 0-12-352651-5. ; translation of Lehrbuch der Anorganischen Chemie, originally founded by A. F. Holleman, continued by Egon Wiberg (页面存档备份,存于互联网档案馆), edited by Nils Wiberg, Berlin: de Gruyter, 1995, 34th edition, ISBN 978-3-11-012641-9.
- ^ Steel, Joanna. Biography of Neil Bartlett. College of Chemistry, University of California, Berkeley. 2007 [2007-10-25]. (原始内容存档于2009-09-23).
- ^ Bartlett, Neil. The Noble Gases. Chemical & Engineering News (American Chemical Society). 2003-09-09, 81 (36) [2013-12-13]. (原始内容存档于2018-04-29).
- ^ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku. A stable argon compound. Nature. 2000-08-24, 406 (6798): 874–876 [2008-06-04]. PMID 10972285. doi:10.1038/35022551. (原始内容存档于2016-04-13).
- ^ Lynch, C. T.; Summitt, R.; Sliker, A. CRC Handbook of Materials Science. CRC Press. 1980. ISBN 0-87819-231-X.
- ^ MacKenzie, D. R. Krypton Difluoride: Preparation and Handling. Science. 1963, 141 (3586): 1171. Bibcode:1963Sci...141.1171M. PMID 17751791. doi:10.1126/science.141.3586.1171.
- ^ Paul R. Fields, Lawrence Stein, and Moshe H. Zirin. Radon Fluoride. Journal of the American Chemical Society. 1962, 84 (21): 4164–4165. doi:10.1021/ja00880a048.
- ^ Xenon. Periodic Table Online. CRC Press. [2009-02-08]. (原始内容存档于2009-02-08).
- ^ Moody, G. J. A Decade of Xenon Chemistry. Journal of Chemical Education. 1974, 51 (10): 628–630 [2007-10-16]. Bibcode:1974JChEd..51..628M. doi:10.1021/ed051p628.
- ^ Williams, David R. Earth Fact Sheet. NASA. April 19, 2007 [2007-10-04]. (原始内容存档于2010-10-30).
- ^ 46.0 46.1 Aprile, Elena; Bolotnikov, Aleksey E.; Doke, Tadayoshi. Noble Gas Detectors. Wiley-VCH. 2006: 8–9 [2013-12-13]. ISBN 3-527-60963-6.
- ^ Caldwell, W. A.; Nguyen, J.; Pfrommer, B.; Louie, S.; Jeanloz, R. Structure, bonding and geochemistry of xenon at high pressures. Science. 1997, 277 (5328): 930–933. doi:10.1126/science.277.5328.930.
- ^ Fontes, E. Golden Anniversary for Founder of High-pressure Program at CHESS. Cornell University. [2009-05-30]. (原始内容存档于2008-07-05).
- ^ Eremets, Mikhail I.; Gregoryanz, Eugene A.; Struzhkin, Victor V.; Mao, Ho-Kwang; Hemley, Russell J.; Mulders, Norbert; Zimmerman, Neil M. Electrical Conductivity of Xenon at Megabar Pressures. Physical Review Letters. 2000, 85 (13): 2797–800. Bibcode:2000PhRvL..85.2797E. PMID 10991236. doi:10.1103/PhysRevLett.85.2797.
- ^ Bader, Richard F. W. An Introduction to the Electronic Structure of Atoms and Molecules. McMaster University. [2007-09-27]. (原始内容存档于2016-03-03).
- ^ Talbot, John. Spectra of Gas Discharges. Rheinisch-Westfälische Technische Hochschule Aachen. [2006-08-10]. (原始内容存档于2007-07-18).
- ^ Watts, William Marshall. An Introduction to the Study of Spectrum Analysis. London: Longmans, Green, and co. 1904.
- ^ Hwang, Shuen-Cheng; Robert D. Lein, Daniel A. Morgan. Noble Gases. Kirk-Othmer Encyclopedia of Chemical Technology 5th. Wiley. 2005. ISBN 0-471-48511-X. doi:10.1002/0471238961.0701190508230114.a01.
- ^ Patricia A. McCrory, James E. Constantz, and Andrew G. Hunt. Noble Gas Isotopes in Mineral Springs within the Cascadia Forearc, Washington and Oregon (PDF). USGS. 2014 [2016-12-16]. (原始内容存档 (PDF)于2017-03-05).
- ^ Caracausi, Antonio; Avice, Guillaume; Burnard, Peter G.; Füri, Evelyn; Marty, Bernard. Chondritic xenon in the Earth's mantle. Nature. 2016, (533): 82–85. doi:10.1038/nature17434.
- ^ Kerry, Frank G. Industrial Gas Handbook: Gas Separation and Purification. CRC Press. 2007: 101–103 [2013-12-13]. ISBN 0-8493-9005-2.
- ^ Xenon – Xe. CFC StarTec LLC. August 10, 1998 [2007-09-07]. (原始内容存档于2014-01-27).
- ^ 58.0 58.1 Singh, Sanjay. Xenon: A modern anaesthetic. Indian Express Newspapers Limited. May 15, 2005 [2007-10-10]. (原始内容存档于2007-08-13).
- ^ 59.0 59.1 Häussinger, Peter; Glatthaar, Reinhard; Rhode, Wilhelm; Kick, Helmut; Benkmann, Christian; Weber, Josef; Wunschel, Hans-Jörg; Stenke, Viktor; Leicht, Edith; Stenger, Hermann. Noble Gases. Ullmann's Encyclopedia of Industrial Chemistry 6th. Wiley. 2001. ISBN 3-527-20165-3. doi:10.1002/14356007.a17_485.
- ^ Arnett, David. Supernovae and Nucleosynthesis. Princeton, New Jersey: Princeton University Press. 1996 [2013-12-13]. ISBN 0-691-01147-8.
- ^ Mahaffy, P. R.; Niemann, H. B.; Alpert, A.; Atreya, S. K.; Demick, J.; Donahue, T. M.; Harpold, D. N.; Owen, T. C. Noble gas abundance and isotope ratios in the atmosphere of Jupiter from the Galileo Probe Mass Spectrometer. Journal of Geophysical Research. 2000, 105 (E6): 15061–15072. Bibcode:2000JGR...10515061M. doi:10.1029/1999JE001224.
- ^ Owen, Tobias; Mahaffy, Paul; Niemann, H. B.; Atreya, Sushil; Donahue, Thomas; Bar-Nun, Akiva; de Pater, Imke. A low-temperature origin for the planetesimals that formed Jupiter. Nature. 1999, 402 (6759): 269–70. Bibcode:1999Natur.402..269O. PMID 10580497. doi:10.1038/46232.
- ^ Sanloup, Chrystèle; et al. Retention of Xenon in Quartz and Earth's Missing Xenon. Science. 2005, 310 (5751): 1174–7. Bibcode:2005Sci...310.1174S. PMID 16293758. doi:10.1126/science.1119070.
- ^ Clayton, Donald D. Principles of Stellar Evolution and Nucleosynthesis. University of Chicago Press. 1983 [2013-12-13]. ISBN 0-226-10953-4.
- ^ Heymann, D.; Dziczkaniec, M. Xenon from intermediate zones of supernovae. Proceedings 10th Lunar and Planetary Science Conference. Houston, Texas: Pergamon Press, Inc.: 1943–1959. March 19–23, 1979. Bibcode:1979LPSC...10.1943H.
- ^ Beer, H.; Kaeppeler, F.; Reffo, G.; Venturini, G. Neutron capture cross-sections of stable xenon isotopes and their application in stellar nucleosynthesis. Astrophysics and Space Science. November 1983, 97 (1): 95–119. Bibcode:1983Ap&SS..97...95B. doi:10.1007/BF00684613.
- ^ Pignatari, M.; Gallino; Straniero; Davis; Gallino, R.; Straniero, O.; Davis, A. The origin of xenon trapped in presolar mainstream SiC grains. Memorie della Societa Astronomica Italiana. 2004, 75: 729–734. Bibcode:2004MmSAI..75..729P.
- ^ 68.0 68.1 68.2 Caldwell, Eric. Periodic Table – Xenon. Resources on Isotopes. USGS. January 2004 [2007-10-08]. (原始内容存档于2013-12-13).
- ^ Rajam, J. B. Atomic Physics 7th. Delhi: S. Chand and Co. 1960. ISBN 81-219-1809-X.
- ^ Barabash, A. S. Average (Recommended) Half-Life Values for Two-Neutrino Double-Beta Decay. Czechoslovak Journal of Physics. 2002, 52 (4): 567–573. Bibcode:2002CzJPh..52..567B. arXiv:nucl-ex/0203001
 . doi:10.1023/A:1015369612904.
. doi:10.1023/A:1015369612904.
- ^ Butler, Declan; Gibney, Elizabeth. What kind of bomb did North Korea detonate?. Nature. 2016-01-08 [2016-12-18]. doi:10.1038/nature.2016.19132. (原始内容存档于2017-02-07).
- ^ Otten, Ernst W. Take a breath of polarized noble gas. Europhysics News. 2004, 35 (1): 16. Bibcode:2004ENews..35...16O. doi:10.1051/epn:2004109.
- ^ Ruset, I. C.; Ketel, S.; Hersman, F. W. Optical Pumping System Design for Large Production of Hyperpolarized 129Xe. Physical Review Letters. 2006, 96 (5): 053002. Bibcode:2006PhRvL..96e3002R. doi:10.1103/PhysRevLett.96.053002.
- ^ Wolber, J.; Cherubini, A.; Leach, M. O.; Bifone, A. On the oxygenation-dependent 129Xe T1 in blood. NMR in Biomedicine. 2000, 13 (4): 234–7. PMID 10867702. doi:10.1002/1099-1492(200006)13:4<234::AID-NBM632>3.0.CO;2-K.
- ^ Chann, B.; Nelson, I. A.; Anderson, L. W.; Driehuys, B.; Walker, T. G. 129Xe-Xe molecular spin relaxation. Physical Review Letters. 2002, 88 (11): 113–201. Bibcode:2002PhRvL..88k3201C. doi:10.1103/PhysRevLett.88.113201.
- ^ von Schulthess, Gustav Konrad; Smith, Hans-Jørgen; Pettersson, Holger; Allison, David John. The Encyclopaedia of Medical Imaging. Taylor & Francis: 194. 1998 [2013-12-13]. ISBN 1-901865-13-4. (原始内容存档于2014-01-05).
- ^ Warren, W. W.; Norberg, R. E. Nuclear Quadrupole Relaxation and Chemical Shift of Xe131 in Liquid and Solid Xenon. Physical Review. 1966, 148 (1): 402–412. Bibcode:1966PhRv..148..402W. doi:10.1103/PhysRev.148.402.
- ^ Staff. Hanford Becomes Operational. The Manhattan Project: An Interactive History. U.S. Department of Energy. [2007-10-10]. (原始内容存档于2009-12-10).
- ^ Pfeffer, Jeremy I.; Nir, Shlomo. Modern Physics: An Introductory Text. Imperial College Press. 2000: 421 ff. [2013-12-13]. ISBN 1-86094-250-4.
- ^ DOE Fundamentals Handbook: Nuclear Physics and Reactor Theory Volume 2 (PDF). U.S. Department of Energy. 1993: 35–42 [2016-12-18]. (原始内容 (PDF)存档于2016-12-20).
- ^ Kruglov, Arkadii. The History of the Soviet Atomic Industry. : 57, 60. ISBN 0-41526-970-9.
- ^ Laws, Edwards A. Aquatic Pollution: An Introductory Text. John Wiley and Sons. 2000: 505 [2013-12-13]. ISBN 0-471-34875-9.
- ^ Staff. A Nuclear Nightmare. Time. April 9, 1979 [2007-10-09]. (原始内容存档于2007-10-12).
- ^ Clayton, Donald D. Principles of Stellar Evolution and Nucleosynthesis 2nd. University of Chicago Press. 1983: 75 [2013-12-13]. ISBN 0-226-10953-4.
- ^ Bolt, B. A.; Packard, R. E.; Price, P. B. John H. Reynolds, Physics: Berkeley. The University of California, Berkeley. 2007 [2007-10-01]. (原始内容存档于2012-05-24).
- ^ Williams, David R. Mars Fact Sheet. NASA. September 1, 2004 [2007-10-10]. (原始内容存档于2010-06-12).
- ^ Schilling, James. Why is the Martian atmosphere so thin and mainly carbon dioxide?. Mars Global Circulation Model Group. [2007-10-10]. (原始内容存档于2010-08-31).
- ^ Zahnle, Kevin J. Xenological constraints on the impact erosion of the early Martian atmosphere. Journal of Geophysical Research. 1993, 98 (E6): 10,899–10,913. Bibcode:1993JGR....9810899Z. doi:10.1029/92JE02941.
- ^ Boulos, M. S.; Manuel, O.K. The xenon record of extinct radioactivities in the Earth. Science. 1971, 174 (4016): 1334–6. Bibcode:1971Sci...174.1334B. PMID 17801897. doi:10.1126/science.174.4016.1334.
- ^ 90.0 90.1 Harding, Charlie; Johnson, David Arthur; Janes, Rob. Elements of the p block. Great Britain: Royal Society of Chemistry. 2002: 93–94 [2013-12-13]. ISBN 0-85404-690-9.
- ^ Dean H Liskow, Henry F I I I Schaefer, Paul S Bagus, Bowen Liu. Probable nonexistence of xenon monofluoride as a chemically bound species in the gas phase. J Amer Chem Soc. 1973, 95 (12): 4056–4057. doi:10.1021/ja00793a042.
- ^ Harding, Charlie; Johnson, David Arthur; Janes, Rob. Elements of the p block. Great Britain: Royal Society of Chemistry. 2002: 93–94. ISBN 0-85404-690-9.
- ^ Weeks, James L.; Chernick, Cedric; Matheson, Max S. Photochemical Preparation of Xenon Difluoride. Journal of the American Chemical Society. 1962, 84 (23): 4612. doi:10.1021/ja00882a063.
- ^ Streng, L. V.; Streng, A. G. Formation of Xenon Difluoride from Xenon and Oxygen Difluoride or Fluorine in Pyrex Glass at Room Temperature. Inorganic Chemistry. 1965, 4 (9): 1370–1371. doi:10.1021/ic50031a035.
- ^ 95.0 95.1 Tramšek, Melita; Žemva, Boris. Synthesis, Properties and Chemistry of Xenon(II) Fluoride (PDF). Acta Chimica Slovenica. December 5, 2006, 53 (2): 105–116 [2009-07-18]. doi:10.1002/chin.200721209. (原始内容存档 (PDF)于2013-05-12).
- ^ Ogrin, Tomaz; Bohinc, Matej; Silvnik, Joze. Melting-point determinations of xenon difluoride-xenon tetrafluoride mixtures. Journal of Chemical and Engineering Data. 1973, 18 (4): 402. doi:10.1021/je60059a014.
- ^ 97.0 97.1 Scott, Thomas; Eagleson, Mary. Xenon Compounds. Concise encyclopedia chemistry. Walter de Gruyter: 1183. 1994 [2013-12-13]. ISBN 3-11-011451-8. (原始内容存档于2014-01-05).
- ^ Proserpio, Davide M.; Hoffmann, Roald; Janda, Kenneth C. The xenon-chlorine conundrum: van der Waals complex or linear molecule?. Journal of the American Chemical Society. 1991, 113 (19): 7184. doi:10.1021/ja00019a014.
- ^ Richardson, Nancy A.; Hall, Michael B. The potential energy surface of xenon dichloride. The Journal of Physical Chemistry. 1993, 97 (42): 10952. doi:10.1021/j100144a009.
- ^ Brock, D.S..; Schrobilgen, G.J. Synthesis of the missing oxide of xenon, XeO2, and its implications for earth's missing xenon. Journal of the American Chemical Society. 2011, 133 (16): 6265–9. PMID 21341650. doi:10.1021/ja110618g.
- ^ Where did the xenon go?. Nature (Springer Nature). 2011, 471 (7337): 138–138. ISSN 0028-0836. doi:10.1038/471138d.
- ^ Zhou, M.; Zhao, Y.; Gong, Y.; Li, J. Formation and Characterization of the XeOO+ Cation in Solid Argon. Journal of the American Chemical Society. 2006, 128 (8): 2504–5. PMID 16492012. doi:10.1021/ja055650n.
- ^ John H. Holloway. Explosion hazards with xenon trioxide solutions ("xenic acid"). Talanta. 1967, 14 (7): 871-873. doi:10.1016/0039-9140(67)80112-7.
- ^ Selig, Henry; Claassen, Howard H.; Chernick, Cedric L.; Malm, John G.; Huston, John L. Xenon Tetroxide: Preparation and Some Properties. Science. 1964, 143: 1322-1323 [2016-12-19]. (原始内容存档于2016-12-21).
- ^ Holloway, John H.; Hope, Eric G. A. G. Sykes , 编. Advances in Inorganic Chemistry Press. Academic. 1998: 65 [2013-12-13]. ISBN 0-12-023646-X.
- ^ 106.0 106.1 Henderson, W. Main group chemistry. Great Britain: Royal Society of Chemistry. 2000: 152–153 [2013-12-13]. ISBN 0-85404-617-8.
- ^ 107.0 107.1 107.2 107.3 Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to modern inorganic chemistry 6th. CRC Press. 2002: 497–501 [2013-12-13]. ISBN 0-7487-6420-8.
- ^ Smith, D. F. Xenon Oxyfluoride. Science. 1963, 140 (3569): 899–900. Bibcode:1963Sci...140..899S. PMID 17810680. doi:10.1126/science.140.3569.899.
- ^ K. O. Christe, D. A. Dixon, J. C. P. Sanders, G. J. Schrobilgen, S. S. Tsai, W. W. Wilson. On the Structure of the [XeOF5]− Anion and of Heptacoordinated Complex Fluorides Containing One or Two Highly Repulsive Ligands or Sterically Active Free Valence Electron Pairs. Inorg. Chem. 1995, 34 (7): 1868–1874. doi:10.1021/ic00111a039.
- ^ K. O. Christe, C. J. Schack, D. Pilipovich. Chlorine trifluoride oxide. V. Complex formation with Lewis acids and bases. Inorg. Chem. 1972, 11 (9): 2205–2208. doi:10.1021/ic50115a044.
- ^ Holloway, John H.; Hope, Eric G. Advances in Inorganic Chemistry. Contributor A. G. Sykes. Academic Press. 1998: 61–90 [2013-12-13]. ISBN 0-12-023646-X.
- ^ Frohn, H; Theißen, Michael. C6F5XeF, a versatile starting material in xenon–carbon chemistry. Journal of Fluorine Chemistry. 2004, 125 (6): 981. doi:10.1016/j.jfluchem.2004.01.019.
- ^ Goetschel, Charles T.; Loos, Karl R. Reaction of xenon with dioxygenyl tetrafluoroborate. Preparation of FXe-BF2. Journal of the American Chemical Society. 1972, 94 (9): 3018. doi:10.1021/ja00764a022.
- ^ Li, Wai-Kee; Zhou, Gong-Du; Mak, Thomas C. W. Gong-Du Zhou; Thomas C. W. Mak , 编. Advanced Structural Inorganic Chemistry. Oxford University Press. 2008: 678 [2013-12-13]. ISBN 0-19-921694-0.
- ^ Li, Wai-Kee; Zhou,, Gong-Du; Mak, Thomas C. W. Advanced Structural Inorganic Chemistry. Oxford University Press. 2008: 674. ISBN 0-19-921694-0.
- ^ Gerber, R. B. Formation of novel rare-gas molecules in low-temperature matrices. Annual Review of Physical Chemistry. 2004, 55 (1): 55–78. Bibcode:2004ARPC...55...55G. PMID 15117247. doi:10.1146/annurev.physchem.55.091602.094420.
- ^ Khriachtchev, Leonid; Isokoski, Karoliina; Cohen, Arik; Räsänen, Markku; Gerber, R. Benny. A Small Neutral Molecule with Two Noble-Gas Atoms: HXeOXeH. Journal of the American Chemical Society. 2008, 130 (19): 6114–8. PMID 18407641. doi:10.1021/ja077835v.
- ^ Pettersson, Mika; Khriachtchev, Leonid; Lundell, Jan; Räsänen, Markku. A Chemical Compound Formed from Water and Xenon: HXeOH. Journal of the American Chemical Society. 1999, 121 (50): 11904–11905. doi:10.1021/ja9932784.
- ^ Pauling, L. A molecular theory of general anesthesia. Science. 1961, 134 (3471): 15–21. Bibcode:1961Sci...134...15P. PMID 13733483. doi:10.1126/science.134.3471.15. Reprinted as Pauling, Linus; Kamb, Barclay (编). Linus Pauling: Selected Scientific Papers 2. River Edge, New Jersey: World Scientific. 2001: 1328–1334. ISBN 981-02-2940-2.
- ^ Henderson, W. Main group chemistry. Great Britain: Royal Society of Chemistry. 2000: 148 [2013-12-13]. ISBN 0-85404-617-8.
- ^ Ikeda, Tomoko; Mae, Shinji; Yamamuro, Osamu; Matsuo, Takasuke; Ikeda, Susumu; Ibberson, Richard M. Distortion of Host Lattice in Clathrate Hydrate as a Function of Guest Molecule and Temperature. Journal of Physical Chemistry A. 2000-11-23, 104 (46): 10623–10630. doi:10.1021/jp001313j.
- ^ McKay, C. P.; Hand, K. P.; Doran, P. T.; Andersen, D. T.; Priscu, J. C. Clathrate formation and the fate of noble and biologically useful gases in Lake Vostok, Antarctica. Geophysical Letters. 2003, 30 (13): 35. Bibcode:2003GeoRL..30m..35M. doi:10.1029/2003GL017490.
- ^ Barrer, R. M.; Stuart, W. I. Non-Stoichiometric Clathrate of Water. Proceedings of the Royal Society of London. 1957, 243 (1233): 172–189. Bibcode:1957RSPSA.243..172B. doi:10.1098/rspa.1957.0213.
- ^ Frunzi, Michael; Cross, R. James; Saunders, Martin. Effect of Xenon on Fullerene Reactions. Journal of the American Chemical Society. 2007, 129 (43): 13343–6. PMID 17924634. doi:10.1021/ja075568n.
- ^ Silfvast, William Thomas. Laser Fundamentals. Cambridge University Press. 2004 [2013-12-13]. ISBN 0-521-83345-0.
- ^ Webster, John G. The Measurement, Instrumentation, and Sensors Handbook. Springer. 1998 [2013-12-13]. ISBN 3-540-64830-5.
- ^ McGhee, Charles; Taylor, Hugh R.; Gartry, David S.; Trokel, Stephen L. Excimer Lasers in Ophthalmology. Informa Health Care. 1997 [2013-12-13]. ISBN 1-85317-253-7.
- ^ Staff. Xenon Applications. Praxair Technology. 2007 [2007-10-04]. (原始内容存档于2013-03-22).
- ^ Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. A xenon-iodine electric discharge bactericidal lamp. Technical Physics Letters. 2003, 29 (10): 871–872. Bibcode:2003TePhL..29..871S. doi:10.1134/1.1623874.
- ^ Skeldon, M.D.; Saager, R.; Okishev, A.; Seka, W. Thermal distortions in laser-diode- and flash-lamp-pumped Nd:YLF laser rods (PDF). LLE Review. 1997, 71: 137–144 [2007-02-04]. (原始内容存档 (PDF)于2003-10-16).
- ^ Anonymous. The plasma behind the plasma TV screen. Plasma TV Science. [2007-10-14]. (原始内容存档于2007-10-15).
- ^ Marin, Rick. Plasma TV: That New Object Of Desire. The New York Times. 2001-03-21 [2009-04-03]. (原始内容存档于2009-04-23).
- ^ Waymouth, John. Electric Discharge Lamps. Cambridge, MA: The M.I.T. Press. 1971. ISBN 0-262-23048-8.
- ^ Patel, C. K. N.; Bennett Jr., W. R.; Faust, W. L.; McFarlane, R. A. Infrared spectroscopy using stimulated emission techniques. Physical Review Letters. 1962-08-01, 9 (3): 102–104. Bibcode:1962PhRvL...9..102P. doi:10.1103/PhysRevLett.9.102.
- ^ Patel, C. K. N.; Faust, W. L.; McFarlane, R. A. High gain gaseous (Xe-He) optical masers. Applied Physics Letters. 1962-12-01, 1 (4): 84–85. Bibcode:1962ApPhL...1...84P. doi:10.1063/1.1753707.
- ^ Bennett, Jr., W. R. Gaseous optical masers. Applied Optics Supplement. 1962, 1: 24–61. Bibcode:1962ApOpt...1S..24B. doi:10.1364/AO.1.000024.
- ^ Laser Output. University of Waterloo. [2007-10-07]. (原始内容存档于2011-07-06).
- ^ Baltás, E.; Csoma, Z.; Bodai, L.; Ignácz, F.; Dobozy, A.; Kemény, L. Treatment of atopic dermatitis with the xenon chloride excimer laser. Journal of the European Academy of Dermatology and Venereology. 2006, 20 (6): 657–60. PMID 16836491. doi:10.1111/j.1468-3083.2006.01495.x.
- ^ Tonner, P. H. Xenon: one small step for anaesthesia ... ? (editorial review). Current Opinion in Anaesthesiology. 2006, 19 (4): 382–4. PMID 16829718. doi:10.1097/01.aco.0000236136.85356.13.
- ^ Banks, P; Franks, NP; Dickinson, R. Competitive inhibition at the glycine site of the N-methyl-D-aspartate receptor mediates xenon neuroprotection against hypoxia-ischemia. Anesthesiology. 2010, 112 (3): 614–22. PMID 20124979. doi:10.1097/ALN.0b013e3181cea398.
- ^ Ma, D; Wilhelm, S; Maze, M; Franks, NP. Neuroprotective and neurotoxic properties of the 'inert' gas, xenon. Br J Anaesth. 2002, 89 (5): 739–46. PMID 12393773. doi:10.1093/bja/89.5.739.
- ^ Nagata, A; Nakao Si, S; Nishizawa, N; Masuzawa, M; Inada, T; Murao, K; Miyamoto, E; Shingu, K. Xenon inhibits but N(2)O enhances ketamine-induced c-Fos expression in the rat posterior cingulate and retrosplenial cortices. Anesth Analg. 2001, 92 (2): 362–8. PMID 11159233. doi:10.1213/00000539-200102000-00016.
- ^ Sakamoto, S; Nakao, S; Masuzawa, M; Inada, T; Maze, M; Franks, NP; Shingu, K. The differential effects of nitrous oxide and xenon on extracellular dopamine levels in the rat nucleus accumbens: a microdialysis study. Anesth Analg. 2006, 103 (6): 1459–63. PMID 17122223. doi:10.1213/01.ane.0000247792.03959.f1.
- ^ Suzuki, T; Koyama, H; Sugimoto, M; Uchida, I; Mashimo, T. The diverse actions of volatile and gaseous anesthetics on human-cloned 5-hydroxytryptamine3 receptors expressed in Xenopus oocytes. Anesthesiology. 2002, 96 (3): 699–704. PMID 11873047. doi:10.1097/00000542-200203000-00028.
- ^ Nickalls, R. W. D; Mapleson, W.W. Age‐related iso‐MAC charts for isoflurane, sevoflurane and desflurane in man. British Journal of Anesthesiology. [2013-12-10]. (原始内容存档于2015-01-12).
- ^ Goto, T; Nakata Y, Morita S. Will xenon be a stranger or a friend?: the cost, benefit, and future of xenon anesthesia. Anesthesiology. 2003, 98 (1): 1–2 [2010-09-15]. PMID 12502969. doi:10.1097/00000542-200301000-00002. (原始内容存档于2011-08-11).
- ^ Van Der Wall, Ernst. What's New in Cardiac Imaging?: SPECT, PET, and MRI. Springer. 1992 [2013-12-13]. ISBN 0-7923-1615-0.
- ^ Frank, John. Introduction to imaging: The chest. Student BMJ. 1999, 12: 1–44 [2008-06-04]. (原始内容存档于2008-05-24).
- ^ Chandak, Puneet K. Brain SPECT: Xenon-133. Brigham RAD. July 20, 1995 [2008-06-04]. (原始内容存档于2012-01-04).
- ^ Albert, M. S.; Balamore, D. Development of hyperpolarized noble gas MRI. Nuclear Instruments and Methods in Physics Research A. 1998, 402 (2–3): 441–53. Bibcode:1998NIMPA.402..441A. PMID 11543065. doi:10.1016/S0168-9002(97)00888-7.
- ^ Irion, Robert. Head Full of Xenon?. Science News. March 23, 1999 [2007-10-08]. (原始内容存档于2004-01-17).
- ^ Wolber, J.; Rowland, I. J.; Leach, M. O.; Bifone, A. Intravascular delivery of hyperpolarized 129Xenon for in vivo MRI. Applied Magnetic Resonance. 1998, 15 (3–4): 343–352. doi:10.1007/BF03162020.
- ^ Driehuys, B.; Möller, H.E.; Cleveland, Z.I.; Pollaro, J.; Hedlund, L.W.;. Pulmonary perfusion and xenon gas exchange in rats: MR imaging with intravenous injection of hyperpolarized 129Xe. Radiology. 2009, 252 (2): 386–93. PMC 2753782
 . PMID 19703880. SSRN 2
. PMID 19703880. SSRN 2  请检查
请检查|ssrn=的值 (帮助). doi:10.1148/radiol.2522081550. - ^ Cleveland, Z.I.; Möller, H.E.; Hedlund, L.W.; Driehuys, B. Continuously infusing hyperpolarized 129Xe into flowing aqueous solutions using hydrophobic gas exchange membranes. The journal of physical chemistry. 2009, 113 (37): 12489–99. PMC 2747043
 . PMID 19702286. doi:10.1021/jp9049582.
. PMID 19702286. doi:10.1021/jp9049582.
- ^ Luhmer, M.; Dejaegere, A.; Reisse, J. Interpretation of the solvent effect on the screening constant of Xe-129. Magnetic Resonance in Chemistry. 1989, 27 (10): 950. doi:10.1002/mrc.1260271009.
- ^ Rubin, Seth M.; Spence, Megan M.; Goodson, Boyd M.; Wemmer, David E.; Pines, Alexander. Evidence of nonspecific surface interactions between laser-polarized xenon and myoglobin in solution. Proceedings of the National Academy of Science USA. August 15, 2000, 97 (17): 9472–5. Bibcode:2000PNAS...97.9472R. PMC 16888
 . PMID 10931956. doi:10.1073/pnas.170278897.
. PMID 10931956. doi:10.1073/pnas.170278897.
- ^ Raftery, Daniel; MacNamara, Ernesto; Fisher, Gregory; Rice, Charles V.; Smith, Jay. Optical Pumping and Magic Angle Spinning: Sensitivity and Resolution Enhancement for Surface NMR Obtained with Laser-Polarized Xenon. Journal of the American Chemical Society. 1997, 119 (37): 8746. doi:10.1021/ja972035d.
- ^ Gaede, H. C.; Song, Y. -Q.; Taylor, R. E.; Munson, E. J.; Reimer, J. A.; Pines, A. High-field cross polarization NMR from laser-polarized xenon to surface nuclei. Applied Magnetic Resonance. 1995, 8 (3–4): 373. doi:10.1007/BF03162652.
- ^ Galison, Peter Louis. Image and Logic: A Material Culture of Microphysics. University of Chicago Press. 1997: 339 [2013-12-13]. ISBN 0-226-27917-0.
- ^ Fontaine, J.-P.; Pointurier, F.; Blanchard, X.; Taffary, T. Atmospheric xenon radioactive isotope monitoring. Journal of Environmental Radioactivity. 2004, 72 (1–2): 129–35. PMID 15162864. doi:10.1016/S0265-931X(03)00194-2.
- ^ Garwin, Richard L.; von Hippel Frank N. A Technical Analysis: Deconstructing North Korea's October 9 Nuclear Test. Arms Control Today (Arms Control Association). 2006年11月, 38 (9) [2009-03-26]. (原始内容存档于2009-05-01).
- ^ Gallucci, G. The MEG liquid xenon calorimeter. Journal of Physics: Conference Series. 2009, 160 (1): 012011. Bibcode:2009JPhCS.160a2011G. doi:10.1088/1742-6596/160/1/012011.
- ^ Schumann, Marc. XENON announced new best limits on Dark Matter. Rice University. 2007-10-10 [2007-10-08]. (原始内容存档于2007-10-12).
- ^ Lebedenko, V. N.; et al. Results from the first science run of the ZEPLIN-III dark matter search experiment. Physical Review D. 2009, 80 (5): 052010. Bibcode:2009PhRvD..80e2010L. arXiv:0812.1150
 . doi:10.1103/PhysRevD.80.052010.
. doi:10.1103/PhysRevD.80.052010.
- ^ Zona, Kathleen. Innovative Engines: Glenn Ion Propulsion Research Tames the Challenges of 21st century Space Travel. NASA. 2006-03-17 [2013-12-13]. (原始内容存档于2013-11-23).
- ^ Dawn Launch: Mission to Vesta and Ceres (PDF). NASA. [2007-10-01]. (原始内容存档 (PDF)于2013-05-13).
- ^ Brazzle, J. D.; Dokmeci, M. R.; Mastrangelo, C. H. Modeling and Characterization of Sacrificial Polysilicon Etching Using Vapor-Phase Xenon Difluoride. Proceedings 17th IEEE International Conference on Micro Electro Mechanical Systems (MEMS). Maastricht, Netherlands: IEEE: 737–740. 1975-07-28 to 1975-08-01. ISBN 978-0-7803-8265-7.
- ^ Staff. Neil Bartlett and the Reactive Noble Gases. American Chemical Society. 2007 [2013-12-13]. (原始内容存档于2013-12-13).
- ^ Staff. Protein Crystallography: Xenon and Krypton Derivatives for Phasing. Daresbury Laboratory, PX. 2004-12-21 [2007-10-01]. (原始内容存档于2005-03-16).
- ^ Drenth, Jan; Mesters, Jeroen. The Solution of the Phase Problem by the Isomorphous Replacement Method. Principles of Protein X-Ray Crystallography 3rd. New York: Springer. 2007: 123–171. ISBN 978-0-387-33334-2. doi:10.1007/0-387-33746-6_7.
- ^ 171.0 171.1 Finkel, A. J.; Katz, J. J.; Miller, C. E. Metabolic and toxicological effects of water-soluble xenon compounds are studied. NASA. 1968-04-01 [2007-10-04]. (原始内容存档于2013-12-13).
- ^ LeBlanc, Adrian D.; Johnson, Philip C. The handling of xenon-133 in clinical studies. Physics in Medicine and Biology. 1971, 16 (1): 105–9. Bibcode:1971PMB....16..105L. PMID 5579743. doi:10.1088/0031-9155/16/1/310.
- ^ Vacek, V.; Hallewell, G.; Lindsay, S. Velocity of sound measurements in gaseous per-fluorocarbons and their mixtures. Fluid Phase Equilibria. 2001, 185 (1–2): 305–314. doi:10.1016/S0378-3812(01)00479-4.
- ^ Spangler, Steve. Anti-Helium – Sulfur Hexafluoride. Steve Spangler Science. 2007 [2010-11-14]. (原始内容存档于2010-11-14).
- ^ Yamaguchi, K.; Soejima, K.; Koda, E.; Sugiyama, N. Inhaling Gas With Different CT Densities Allows Detection of Abnormalities in the Lung Periphery of Patients With Smoking-Induced COPD. Chest Journal. 2001, 51 (6): 1907–16. PMID 11742921. doi:10.1378/chest.120.6.1907.
- ^ Staff. Cryogenic and Oxygen Deficiency Hazard Safety. Stanford Linear Accelerator Center. 2007-08-01 [2007-10-10]. (原始内容存档于2007-06-09).
- 元素氙在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 氙(英文)
- 元素氙在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素氙在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 氙(英文)
- USGS Periodic Table – Xenon (页面存档备份,存于互联网档案馆)
- Xenon as an anesthetic (页面存档备份,存于互联网档案馆)
- Sir William Ramsay's Nobel-Prize lecture (1904) (页面存档备份,存于互联网档案馆)

