钇(拼音:yǐ,注音:丨ˇ,粤拼:jyut3;英语:Yttrium),是一种化学元素,其化学符号为Y,原子序数为39,原子量为88.90584 u。钇是银白色的过渡金属,化学性质与镧系元素相近,且常归为稀土金属。[2]钇在自然中并不单独出现,而是和镧系元素结合出现在稀土矿中。89Y是钇的唯一一种稳定同位素和自然同位素。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
银白色 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 钇(Yttrium)·Y·39 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 过渡金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 3 ·5·d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 88.90584(2) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氪] 4d1 5s2 2, 8, 18, 9, 2 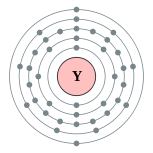 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 约翰·加多林(1794年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 卡尔·古斯塔夫·莫桑德(1840年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 4.472 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 4.24 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1799 K,1526 °C,2779 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 3203 K,2730 °C,5306 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 11.42 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 363 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 26.53 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 3, 2, 1(碱性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.22(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:600 kJ·mol−1 第二:1180 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 180 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 190±7 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 顺磁性[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (室温)(α、多晶)596 n Ω·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 17.2 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热膨胀系数 | (室温)(α、多晶) 10.6 µm/(m·K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (20 °C)3300 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 63.5 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 25.6 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 41.2 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.243 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 589 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-65-5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:钇的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1787年,卡尔·阿克塞尔·阿列纽斯在瑞典伊特比附近发现了一种新的矿石,即硅铍钇矿,并根据发现地村落的名称将它命名为“Ytterbite”。约翰·加多林在1789年于阿列纽斯的矿物样本中,发现了氧化钇。[3]安德斯·古斯塔夫·埃克贝格把这一氧化物命名为“Yttria”。弗里德里希·维勒在1828年首次分离出钇的单质。[4]
钇的最大用途在于磷光体的生产,特别是红色LED和电视机阴极射线管(CRT)显示屏的红色磷光体。[5]钇元素也被用于电极、电解质、电子滤波器、激光器和超导体中,也有多项医学和材料科学上的应用。钇没有已知的生物用途,人类接触钇元素可导致肺病。[6]
钇是一种质软、带光泽的银白色金属晶体,在元素周期表中属于3族。根据周期表的趋势,它的电负性比前面的元素、钪和4族中的下一个元素锆都要低。由于镧系收缩现象,钇的电负性和镥相近。[7][8]钇也是第五周期中的首个d区块元素。
成块的纯钇在空气中会在表面形成保护性氧化层(Y2O3),这种“钝化”过程使它相对稳定。在水汽中加热至750 °C时,保护层的厚度可达10微米。[9]不过钇粉末在空气中很不稳定,其金属屑在400 °C以上的空气中即可燃烧。[4]钇金属在氮气中加热至1000 °C后会形成氮化钇(YN)。[9]
与镧系元素的相似性
钇元素的性质和镧系元素十分相似,所以在历史上曾一同被归为稀土元素。[2]自然中的钇一定与镧系元素共同出现在稀土矿中。[10]
在化学属性上,镧系元素比钇旁边的钪更接近钇。[11]如果以物理属性对原子序作图,根据趋势,钇的原子序像是在64.5和67.5之间,即位于镧系元素钆和铒之间。[12]
钇的反应级数也一般在这个区间之内,[9]化学反应活性也与铽和镝相近。[5]它的大小与属于“钇族”的重镧系元素几乎相同,所以它们的离子在溶液中的属性十分接近。[9][13]虽然所有镧系元素在元素周期表中都位于钇以下的一行,但钇在多方面都却与其极为相似,这是由于镧系收缩现象。[14]
钇和镧系元素间最大的差异在于,钇几乎只会形成三价化合物或离子,但大约半数镧系元素都可以形成三价以外的价态。[9]
化合物及反应
钇可以形成各种无机化合物,氧化态一般为+3,其中钇原子失去其3颗价电子。[15]例如白色、固态的氧化钇(III)(Y2O3)就是一种六配位的三价钇化合物。[16]
钇可以形成不溶于水的氟化物、氢氧化物和草酸盐,以及可溶于水的溴化物、氯化物、碘化物、硝酸盐和硫酸盐。[9]Y3+离子在溶液中无色,因为它的d和f电子壳层中缺乏电子。[9]
钇及其化合物会和水产生反应,形成Y2O3。[10]浓硝酸和氢氟酸不会对钇产生快速侵蚀,但其他的强酸则可以快速侵蚀钇,产生钇盐。[9]
在200 °C以上温度,钇可以和各种卤素形成三卤化物,如三氟化钇(YF3)、三氯化钇(YCl3)和三溴化钇(YBr3)。[6]碳、磷、硒、硅和硫在高温下也都可以和钇形成二元化合物。[9]
钇的有机化合物中都含有碳﹣钇键,其中一些化合物中的钇呈0氧化态。[17][18](科学家在氯化钇熔体中曾观测到+2态,[19]以及在钇氧原子簇中观测到+1态。[20])有机钇化合物可以催化某些三聚反应。[18]这些化合物的合成过程都从YCl3开始,而YCl3则是经Y2O3与浓盐酸和氯化铵进行反应所得。[21][22]
哈普托数指中心原子对于周边配位体原子的配位数,符号为η。科学家首次在钇配合物中发现碳硼烷配位体能以η7哈普托数与d0金属中心原子进行配位。[18]石墨层间化合物石墨-Y和石墨-Y2O3在气化后会产生内嵌富勒烯,例如Y@C82。[5]电子自旋共振研究显示,这种富勒烯是由Y3+和(C82)3−离子对所组成的。[5]Y3C、Y2C和YC2等碳化物在水解后会形成烃。[9]
核合成及同位素
太阳系中的钇元素是在恒星核合成过程中产生的,大部分经S-过程(约72%),其余的经R-过程(约28%)。[23]在R-过程中,轻元素在超新星爆炸中进行快中子捕获;而在S-过程中,轻元素在红巨星脉动时,在星体内部进行慢中子捕获。[24]

在核爆炸和核反应堆中,钇同位素是铀裂变过程中的一大产物。在核废料的处理上,最重要的钇同位素为91Y和90Y,半衰期分别为58.51天和64小时。[25]虽然90Y的半衰期短,但它与其母同位素锶-90(90Sr)处于长期平衡状态(即产生率接近衰变率),实际半衰期为29年。[4]
所有3族元素的原子序都是奇数,所以稳定同位素很少。[7]钇只有一种稳定同位素89Y,这也是它唯一一种自然同位素。在S-过程当中,经其他途径产生的同位素有足够时间进行β衰变(中子转换为质子,并释放电子和反微中子)。[24]中子数为50、82和126的原子核(原子量分别为90、138和208)特别稳定[注 1],所以这种慢速过程使这些同位素能够保持其较高的丰度。[4]89Y的质量数和中子数分别靠近90和50,所以其丰度也较高。
钇的人工合成同位素已知至少有32种,原子质量数在76和108之间。[25]其中最不稳定的同位素为106Y,半衰期只有>150纳秒(76Y的半衰期为>200纳秒);最稳定的则为88Y,半衰期为106.626天。[25]91Y、87Y和90Y的半衰期分别为58.51天、79.8小时和64小时,而其余所有人造同位素的半衰期都在一天以下,大部分甚至不到一小时。[25]
质量数在88或以下的钇同位素的主要衰变途径是正电子发射(质子→中子),形成锶(原子序为38)的同位素;[25]质量数在90或以上的则进行电子发射(中子→质子),形成锆(原子序为40)的同位素。[25]另外质量数在97或以上的同位素亦会进行少量β−缓发中子发射。[26]
钇的同核异构体至少有20种,质量数在78和102之间。[25][注 2]80Y和97Y的同核异构体超过一个。[25]钇的大部分同核异构体的稳定性都比基态更低,但78mY、84mY、85mY、96mY、98m1Y、100mY和102mY的半衰期都比它们的基态更高。这是因为这些同核异构体都进行β衰变,而不进行同核异构体转换。[26]
1787年,同时为陆军中尉和兼职化学家的卡尔·阿克塞尔·阿列纽斯(Carl Axel Arrhenius)在瑞典伊特比村(现属于斯德哥尔摩群岛)附近的一处旧采石场发现了一块黑色大石。[3]他认为这是一种未知矿石,含有当时新发现的钨元素,[27]并将其命名为“Ytterbite”。[注 3]样本被送往多个化学家作进一步分析。[3]

奥布皇家学院的约翰·加多林于1789年在阿列纽斯的样本中发现了一种新的氧化物,并于1794发布完整的分析结果。[28][注 4]安德斯·古斯塔夫·埃克贝格(Anders Gustaf Ekeberg)在1797年证实了这项发现,并把氧化物命名为“Yttria”。[29]在安东万·拉瓦锡提出首个近代化学元素定义之后,人们认为氧化物都能够还原成元素,所以发现新氧化物就等同于发现新元素。对应于Yttria的元素因此被命名为“Yttrium”。[注 5]
1843年,卡尔·古斯塔夫·莫桑德(Carl Gustaf Mosander)发现,该样本中其实含有三种氧化物:白色的氧化钇(Yttria)、黄色的氧化铽(Erbia)以及玫红色的氧化铒(Terbia)。[30][注 6]1878年,让-夏尔·加利萨·德马里尼亚(Jean Charles Galissard de Marigna)分离出第四种氧化物氧化镱。[31]这四种氧化物所含的新元素都以伊特比命名,除钇以外还有镱(Ytterbium)、铽(Terbium)和铒(Erbium)。[32]在接下来的数十年间,科学家又在加多林的矿石样本中发现了7种新元素。[3]马丁·海因里希·克拉普罗特(Martin Heinrich Klaproth)后将这种矿物命名为加多林矿(Gadolinite,即硅铍钇矿),以纪念加多林为发现这些新元素所做出的贡献。[3]
1828年,弗里德里希·维勒把无水三氯化钇和钾一同加热,首次产生了钇金属:[33][34]
钇的化学符号最初是Yt,直到1920年代初才开始转为Y。[35]
1987年,科学家发现钇钡铜氧具有高温超导性质。[36]它是第二种被发现拥有这种性质的物质,[36]而且是第一种能在氮的沸点以上达到超导现象的物质。[注 7]

丰度
钇元素出现在大部分稀土矿[8]和某些铀矿中,但从不以单质出现。[37]钇在地球地壳中的丰度约为百万分之31,[5]在所有元素中排第28位,是银丰度的400倍。[38]泥土中的钇含量介乎百万分之10至150间(去水后平均重量占百万分之23),在海水中含量为一兆(万亿)分之9。[38]美国阿波罗计划期间从月球采得的岩石样本中含有较高的钇含量。[32]
钇元素没有已知的生物用途,但几乎所有生物体内都存在少量的钇。进入人体后,钇主要积累在肝、肾、脾、肺和骨骼当中。[39]一个人体内一共只有约0.5毫克的钇,而人乳则含有百万分之4的钇。[40]在食用植物中,钇的含量在百万分之20至100之间(鲜重),其中以卷心菜为最高;[40]木本植物种子中的含量为百万分之700,是植物中已知最高的。[40]
生产
钇的化学性质与镧系元素非常相似,所以经过各种自然过程,这些元素都一同出现在稀土矿中。[41][42]

稀土元素共有四种来源:[43]
- 含碳酸盐和氟化物的矿石,如氟碳铈矿([(Ce, La, …)(CO3)F]),平均钇含量为0.1%。[4][41]1960年代至1990年代间,氟碳铈矿的主要来源是美国加州山口(Mountain Pass)稀土矿场,因此美国是这段时期稀土元素的最大产国。[41][43]
- 独居石(即磷铈镧矿,[(Ce, La, …)PO4])是一种漂沙沉积物,为花岗岩移动及重力分离之后的产物。独居石含2%[41](或3%)[44]的钇。20世纪初的最大矿藏位于印度和巴西,两国当时是最大产国。[41][43]
- 磷钇矿是一种含有稀土元素的磷酸盐矿物,其中包括磷酸钇(YPO4),矿物的钇含量约为60%。[41]最大矿藏是位于中国内蒙古的白云鄂博铁矿。在1990年代山口稀土矿场关闭之后,中国继而成为目前稀土元素的最大产国。[41][43]
- 离子吸附型粘土是花岗岩的风化产物,含1%的稀土元素。[41]处理后的精矿的钇含量可以达到8%。离子吸附型粘土主要在中国南部开采生产。[41][43][45]钇也出现在铌钇矿和褐铌钇矿中。[38]
从混合氧化物矿中提取纯钇的其中一种方法是把样本溶于硫酸,再以离子交换层析法进行分离。加入草酸后,草酸钇会沉淀出来。草酸钇在氧气中加热,会转化为氧化钇,再与氟化氢反应后变为氟化钇。[46]使用季铵盐作为萃取剂,钇会维持水溶状态。以硝酸盐作抗衡离子,可以去除轻镧系元素;以硫氰酸盐作抗衡离子,可以去除重镧系元素。这种过程可以产生纯度为99.999%的钇。一般钇占重镧系元素混合物的三分之二,所以为了方便分离其他的元素,须先移除钇元素。
全球氧化钇年产量在2001年达到600吨,储备量估计有9百万吨。[38]钙镁合金可以把三氟化钇还原成海绵状钇金属,如此生产出的钇金属每年不到10吨。电弧炉所达到的1,600 °C温度足以熔化钇金属。[38][46]
日用品

氧化钇(Y2O3)可以做掺Eu3+过程中所用的主体晶格,以及正钒酸钇YVO4:Eu3+或氧硫化钇Y2O2S:Eu3+磷光体的反应剂。这些磷光体在彩色电视机的显像管中能产生红光。[4][5]实际上红光是铕所产生的,钇只是把电子枪的能量传递到磷光体上。[47]钇化合物还可以为不同镧系元素阳离子做掺杂过程的主体晶格,除了Eu3+外,还有能发出绿光的掺Tb3+磷光体。氧化钇可以在多孔氮化硅的生产过程中作烧结添加剂。[48]它还是材料科学中的常用原料,许多钇化合物的合成也需要从氧化钇开始。
钇同位素可以催化乙烯的聚合反应。[4]一些高性能火花塞的电极以钇金属作为材料。[49]在丙烷灯网罩的生产过程中,钇可以代替具有放射性的钍元素。[50]
钇稳定氧化锆是一种正在研发当中的材料,可以做固态电解质,以及在汽车排气系统中用于探测氧含量。[5]
石榴石

钇可以用来生产各种合成石榴石。[51]钇铁石榴石(Y3Fe5O12,简称YIG)是十分有效的微波电子滤波器,生产就需用到氧化钇。[4]钇、铁、铝和钆石榴石(如Y3(Fe,Al)5O12和Y3(Fe,Ga)5O12)具有重要的磁性质。[4]钇铁石榴石是一种高效声能发射器和传感器。[52]钇铝石榴石(Y3Al5O12,简称YAG)的莫氏硬度为8.5,能当宝石作首饰之用(人造钻石)。[4]掺铈的钇铝石榴石(YAG:Ce)晶体可用在白色发光二极管的磷光体中。[53][54][55]
钇铝石榴石、氧化钇、氟化钇锂(LiYF4)和正钒酸钇(YVO4)可以用在近红外线激光器中,可用的掺杂剂包括钕、铒和镱。[56][57]钇铝石榴石激光器能够在大功率下运作,可应用在金属钻孔和切割上。[44]单个钇铝石榴石晶体一般是经由柴可拉斯基法生产出来的。[58]
材料增强
添加少量的钇(0.1%至0.2%)可以降低铬、钼、钛和锆的晶粒度。[59]它也可以增强铝合金和镁合金的材料强度。[4]在合金中加入钇,可以降低加工程序的难度,使材料能抵抗高温再结晶,并且大大提高对高温氧化的抵御能力。[47]
钇还能对钒以及其他非铁金属进行去氧。[4]氧化钇可以稳定立方氧化锆的结构,使它适合作为首饰。[60]
科学家正在研究钇的球化性质,这可能有助生产球墨铸铁。如此生产出来的铸铁具有较高的延展性(石墨形成小球,而非薄片)。[4]氧化钇熔点高,可抵抗冲击,且热膨胀系数也较低,因此能用来制造陶瓷和玻璃,[4]例如某些照相机镜头。[38]
医学
钇-90是一种放射性同位素,被用在依多曲肽及替伊莫单抗等抗癌药物中,可治疗淋巴癌、白血病、卵巢癌、大肠癌、胰腺癌和骨癌等等。[40]该药物会附在单克隆抗体上,与癌症细胞结合后以钇-90的强烈β辐射把癌细胞中的DNA产生变异,经过半衰期间内的放射曝露,之后经由生物克隆的特性,致使癌细胞DNA无法继续往下转录繁衍,一般被仍定为成功的治疗,约需经过3-6个月的观察周期而论。不过钇90仍旧属于局部放射疗法之一,仍旧可能带给治疗患者不可预期的伤害,例如:急性肝衰竭。[61]
用钇-90做的针头可以比解剖刀更加精确,可用于割断脊髓里的疼痛神经。[27]在治疗类风湿性关节炎时,钇-90还能用在发炎关节的滑膜切除术中,特别针对膝盖部位。[62]
曾有实验在犬类身上用掺钕的钇铝石榴石激光来进行前列腺切除术,手术由机器人协助,能够降低对周边神经等组织的损伤。[63]掺铒的钇铝石榴石则开始被用在磨皮整容手术上。[5]
超导体

1987年,阿拉巴马大学和休斯顿大学研发了钇钡铜氧(YBa2Cu3O7,又称YBCO或1-2-3)超导体。[36]它可以在93 K温度下运作,比液氮的沸点(77.1 K)要高。[36]其他超导体都必须使用价格更高的液氦降温,所以这项发现能降低成本。
实际超导材料的化学式为YBa2Cu3O7–d,其中d必须低于0.7才会使材料成为超导体。具体原因未知,但目前科学家知道在晶体内只有某些位置会出现空缺,即位于氧化铜平面和链上。这造成铜原子拥有奇特的氧化态,这再因某种原因引致了超导性质。
BCS理论在1957年被发布之后,人们对低温超导的认知已经非常详尽了。这种现象与两颗电子在一个晶格当中的特殊交互作用相关。然而高温超导却在这一理论的解释范围外,其确切原理仍是未知的。实验所得出的结果指出,材料中氧化铜分量必须十分准确才能带出超导性质。[64]
这一物质呈黑绿色,为一多晶、多相态矿物。科学家正在研究一类成分比例不同的物质,称为钙钛矿,并希望能最终研发出一种更为实用的高温超导体。[44]
水溶钇化合物具微毒性,但非水溶化合物则不具毒性[40]。动物实验显示,钇及其化合物会造成肝和肺的破坏,但不同化合物的毒性程度各异。老鼠在吸入柠檬酸钇后,产生肺水肿和呼吸困难,吸入氯化钇后则有肝性水肿、胸腔积液及肺充血等症状。[6]
钇化合物对人类可引致肺病。[6]钒酸钇铕飘尘会对人的眼部、皮肤和上呼吸道有轻微的刺激,但这可能是飘尘的钒成分所导致的,而不是钇。[6]短期暴露在大量钇化合物中,会引致呼吸急促、咳嗽、胸部疼痛以及发绀。[6]美国国家职业安全卫生研究所(NIOSH)所建议的允许暴露限值为1 mg/m3,超过500 mg/m3时属于“即时对生命或健康造成危险”。[65]虽然成块的钇金属在空气中相对稳定,但钇金属粉末却属于易燃物。[6]
- ^ 参见:幻数。这些原子核的中子捕获截面很低,所以稳定性异常高。(Greenwood 1997,pp.12–13)这些同位素不易发生β衰变,所以拥有较高的丰度。
- ^ 同核异构体亦称亚稳态,其能量比处于基态的原子核更高。亚稳态在释放伽马射线或转换电子之后,才会回到基态。亚稳态以同位素质量数旁的“m”表示。
- ^ “Ytterbite”取自发现地村名“Ytterby”,而“-bite”则是矿物的通用后缀。
- ^ Stwertka 1998, p. 115称加多林在1789年发现该氧化物,但未指何时发布。Van der Krogt 2005引用原文献,并注明1794年加多林著。
- ^ 氧化物名称均以“-a”结尾,而新元素名则一般以“-ium”结尾。
- ^ 铽和铒的名称分别是Terbium和Erbium,但两者的氧化物却分别称为“Erbium”和“Terbium”,拼法相反。
- ^ 钇钡铜氧的超导临界温度(Tc)为93 K,而氮的沸点为77 K。
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存档,存档日期2011-03-03., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 2.0 2.1 IUPAC contributors. Edited by N G Connelly and T Damhus (with R M Hartshorn and A T Hutton) , 编. Nomenclature of Inorganic Chemistry: IUPAC Recommendations 2005 (PDF). RSC Publishing. 2005: 51 [2007-12-17]. ISBN 0-85404-438-8.
- ^ 3.0 3.1 3.2 3.3 3.4 Van der Krogt 2005
- ^ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 CRC contributors. Yttrium. Lide, David R. (编). CRC Handbook of Chemistry and Physics 4. New York: CRC Press. 2007–2008: 41. ISBN 978-0-8493-0488-0.
- ^ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 5.7 Cotton, Simon A. Scandium, Yttrium & the Lanthanides: Inorganic & Coordination Chemistry. Encyclopedia of Inorganic Chemistry. 2006-03-15. ISBN 0-470-86078-2. doi:10.1002/0470862106.ia211.
- ^ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 OSHA contributors. Occupational Safety and Health Guideline for Yttrium and Compounds. United States Occupational Safety and Health Administration. 2007-01-11 [2008-08-03]. (原始内容存档于2013-03-02).(公有领域)
- ^ 7.0 7.1 Greenwood 1997,第946页
- ^ 8.0 8.1 Hammond, C. R. Yttrium. The Elements (PDF). Fermi National Accelerator Laboratory. : 4–33 [2008-08-26]. ISBN 0-04-910081-5. (原始内容 (pdf)存档于2008-06-26).
- ^ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 9.7 9.8 9.9 Daane 1968, p. 817
- ^ 10.0 10.1 Emsley 2001, p. 498
- ^ Daane 1968, p. 810
- ^ Daane 1968, p. 815
- ^ Greenwood 1997,第945页
- ^ Greenwood 1997,第1234页
- ^ Greenwood 1997,第948页
- ^ Greenwood 1997,第947页
- ^ Cloke, F. Geoffrey N. Zero Oxidation State Compounds of Scandium, Yttrium, and the Lanthanides. Chem. Soc. Rev. 1993, 22: 17–24. doi:10.1039/CS9932200017.
- ^ 18.0 18.1 18.2 Schumann, Herbert; Fedushkin, Igor L. Scandium, Yttrium & The Lanthanides: Organometallic Chemistry. Encyclopedia of Inorganic Chemistry. 2006. ISBN 0-470-86078-2. doi:10.1002/0470862106.ia212.
- ^ Nikolai B., Mikheev; Auerman, L N; Rumer, Igor A; Kamenskaya, Alla N; Kazakevich, M Z. The anomalous stabilisation of the oxidation state 2+ of lanthanides and actinides. Russian Chemical Reviews. 1992, 61 (10): 990–998. Bibcode:1992RuCRv..61..990M. doi:10.1070/RC1992v061n10ABEH001011.
- ^ Kang, Weekyung; E. R. Bernstein. Formation of Yttrium Oxide Clusters Using Pulsed Laser Vaporization. Bull. Korean Chem. Soc. 2005, 26 (2): 345–348. doi:10.5012/bkcs.2005.26.2.345. (原始内容存档于2011-07-22).
- ^ Turner, Jr., Francis M.; Berolzheimer, Daniel D.; Cutter, William P.; Helfrich, John. The Condensed Chemical Dictionary. New York: Chemical Catalog Company. 1920: 492 [2008-08-12].
- ^ Spencer, James F. The Metals of the Rare Earths. New York: Longmans, Green, and Co. 1919: 135 [2008-08-12].
- ^ Pack, Andreas; Sara S. Russell, J. Michael G. Shelley and Mark van Zuilen. Geo- and cosmochemistry of the twin elements yttrium and holmium. Geochimica et Cosmochimica Acta. 2007, 71 (18): 4592–4608. Bibcode:2007GeCoA..71.4592P. doi:10.1016/j.gca.2007.07.010.
- ^ 24.0 24.1 Greenwood 1997,第12–13页
- ^ 25.0 25.1 25.2 25.3 25.4 25.5 25.6 25.7 NNDC contributors. Alejandro A. Sonzogni (Database Manager) , 编. Chart of Nuclides. Upton, New York: National Nuclear Data Center, Brookhaven National Laboratory. 2008 [2008-09-13].
- ^ 26.0 26.1 Audi, Georges; Bersillon, O.; Blachot, J.; Wapstra, A.H. The NUBASE Evaluation of Nuclear and Decay Properties. Nuclear Physics A (Atomic Mass Data Center). 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001.
- ^ 27.0 27.1 Emsley 2001, p. 496
- ^ Gadolin 1794
- ^ Greenwood 1997,第944页
- ^ Mosander, Carl Gustaf. Ueber die das Cerium begleitenden neuen Metalle Lathanium und Didymium, so wie über die mit der Yttererde vorkommen-den neuen Metalle Erbium und Terbium. Annalen der Physik und Chemie. 1843, 60 (2): 297–315. Bibcode:1843AnP...136..297M. doi:10.1002/andp.18431361008.
- ^ Britannica contributors. Ytterbium. Encyclopædia Britannica, Inc. 2005.
|encyclopedia=被忽略 (帮助) - ^ 32.0 32.1 Stwertka 1998, p. 115
- ^ Heiserman, David L. Element 39: Yttrium. Exploring Chemical Elements and their Compounds. New York: TAB Books. 1992: 150–152. ISBN 0-8306-3018-X.
- ^ Wöhler, Friedrich. Ueber das Beryllium und Yttrium. Annalen der Physik. 1828, 89 (8): 577–582. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805.
- ^ Coplen, Tyler B.; Peiser, H. S. History of the Recommended Atomic-Weight Values from 1882 to 1997: A Comparison of Differences from Current Values to the Estimated Uncertainties of Earlier Values (Technical Report). Pure Appl. Chem. (IUPAC's Inorganic Chemistry Division Commission on Atomic Weights and Isotopic Abundances). 1998, 70 (1): 237–257. doi:10.1351/pac199870010237.
- ^ 36.0 36.1 36.2 36.3 Wu, M. K.; Ashburn, J. R.; et al. Superconductivity at 93 K in a New Mixed-Phase Y-Ba-Cu-O Compound System at Ambient Pressure. Physical Review Letters. 1987, 58 (9): 908–910. Bibcode:1987PhRvL..58..908W. PMID 10035069. doi:10.1103/PhysRevLett.58.908.
- ^ Lenntech contributors. yttrium. Lenntech. [2008-08-26].
- ^ 38.0 38.1 38.2 38.3 38.4 38.5 Emsley 2001, p. 497
- ^ MacDonald, N. S.; Nusbaum, R. E. and Alexander, G. V. The Skeletal Deposition of Yttrium (PDF). Journal of Biological Chemistry. 1952, 195 (2): 837–841. PMID 14946195.
- ^ 40.0 40.1 40.2 40.3 40.4 Emsley 2001, p. 495
- ^ 41.0 41.1 41.2 41.3 41.4 41.5 41.6 41.7 41.8 Morteani, Giulio. The rare earths; their minerals, production and technical use. European Journal of Mineralogy. 1991, 3 (4): 641–650.
- ^ Kanazawa, Yasuo; Kamitani, Masaharu. Rare earth minerals and resources in the world. Journal of Alloys and Compounds. 2006,. 408–412: 1339–1343. doi:10.1016/j.jallcom.2005.04.033.
- ^ 43.0 43.1 43.2 43.3 43.4 Naumov, A. V. Review of the World Market of Rare-Earth Metals. Russian Journal of Non-Ferrous Metals. 2008, 49 (1): 14–22 [2014-03-09]. doi:10.1007/s11981-008-1004-6. (原始内容存档于2019-07-01).
- ^ 44.0 44.1 44.2 Stwertka 1998, p. 116
- ^ Zheng, Zuoping; Lin Chuanxian. The behaviour of rare-earth elements (REE) during weathering of granites in southern Guangxi, China. Chinese Journal of Geochemistry. 1996, 15 (4): 344–352. doi:10.1007/BF02867008.
- ^ 46.0 46.1 Holleman, Arnold F.; Wiberg, Egon and Wiberg, Nils. Lehrbuch der Anorganischen Chemie 91–100. Walter de Gruyter. 1985: 1056–1057. ISBN 3-11-007511-3.
- ^ 47.0 47.1 Daane 1968, p. 818
- ^ US patent 5935888,“Porous silicon nitride with rodlike grains oriented”,发行于1999-08-10,指定于Agency Ind Science Techn (JP)和Fine Ceramics Research Ass (JP)
- ^ Carley, Larry. Spark Plugs: What's Next After Platinum?. Counterman (Babcox). December 2000 [2008-09-07]. (原始内容存档于2008-05-01).
- ^ US patent 4533317,Addison, Gilbert J.,“Yttrium oxide mantles for fuel-burning lanterns”,发行于1985-08-06,指定于The Coleman Company, Inc.
- ^ Jaffe, H.W. The role of yttrium and other minor elements in the garnet group (pdf). American Mineralogist. 1951: 133–155 [2008-08-26].
- ^ Vajargah, S. Hosseini; Madaahhosseini, H; Nemati, Z. Preparation and characterization of yttrium iron garnet (YIG) nanocrystalline powders by auto-combustion of nitrate-citrate gel. Journal of Alloys and Compounds. 2007, 430 (1–2): 339–343. doi:10.1016/j.jallcom.2006.05.023.
- ^ US patent 6409938,Comanzo Holly Ann,“Aluminum fluoride flux synthesis method for producing cerium doped YAG”,发行于2002-06-25,指定于General Electrics
- ^ GIA contributors. GIA Gem Reference Guide. Gemological Institute of America. 1995. ISBN 0-87311-019-6.
- ^ Kiss, Z. J.; Pressley, R. J. Crystalline solid lasers. Proceedings of the IEEE 54 (10). IEEE: 1236–1248. October 1966 [2008-08-16]. issn: 0018-9219.
- ^ Kong, J.; Tang, D. Y.; Zhao, B.; Lu, J.; Ueda, K.; Yagi, H. and Yanagitani, T. 9.2-W diode-pumped Yb:Y2O3 ceramic laser. Applied Physics Letters. 2005, 86 (16): 116. Bibcode:2005ApPhL..86p1116K. doi:10.1063/1.1914958.
- ^ Tokurakawa, M.; Takaichi, K.; Shirakawa, A.; Ueda, K.; Yagi, H.; Yanagitani, T. and Kaminskii, A. A. Diode-pumped 188 fs mode-locked Yb3+:Y2O3 ceramic laser. Applied Physics Letters. 2007, 90 (7): 071101. Bibcode:2007ApPhL..90g1101T. doi:10.1063/1.2476385.
- ^ Golubović, Aleksandar V.; Nikolić, Slobodanka N.; Gajić, Radoš; Đurić, Stevan; Valčić, Andreja. The growth of Nd: YAG single crystals. Journal of the Serbian Chemical Society. 2002, 67 (4): 91–300. doi:10.2298/JSC0204291G.
- ^ PIDC contributors. Rare Earth metals & compounds. Pacific Industrial Development Corporation. [2008-08-26]. (原始内容存档于2008-08-19).
- ^ Berg, Jessica. Cubic Zirconia. Emporia State University. [2008-08-26]. (原始内容存档于2008-09-24).
- ^ Adams, Gregory P.; Shaller, C. C.; et al. A Single Treatment of Yttrium-90-labeled CHX-A–C6.5 Diabody Inhibits the Growth of Established Human Tumor Xenografts in Immunodeficient Mice. Cancer Research. 2004, 64 (17): 6200–6206. PMID 15342405. doi:10.1158/0008-5472.CAN-03-2382.
- ^ Fischer, M.; Modder, G. Radionuclide therapy of inflammatory joint diseases. Nuclear Medicine Communications. 2002, 23 (9): 829–831. PMID 12195084. doi:10.1097/00006231-200209000-00003.
- ^ Gianduzzo, Troy; Colombo Jr, Jose R.; Haber, Georges-Pascal; Hafron, Jason; Magi-Galluzzi, Cristina; Aron, Monish; Gill, Inderbir S.; Kaouk, Jihad H. Laser robotically assisted nerve-sparing radical prostatectomy: a pilot study of technical feasibility in the canine model. BJU International (Cleveland: Glickman Urological Institute). 2008, 102 (5): 598–602. PMID 18694410. doi:10.1111/j.1464-410X.2008.07708.x.
- ^ Yttrium Barium Copper Oxide – YBCO. Imperial College. [2009-12-20].
- ^ NIOSH contributors. Yttrium. NIOSH Pocket Guide to Chemical Hazards. National Institute for Occupational Safety and Health. September 2005 [2008-08-03].
- Daane, A. H. Yttrium. Hampel, Clifford A. (编). The Encyclopedia of the Chemical Elements. New York: Reinhold Book Corporation. 1968: 810–821. LCCN 68-29938.
- Emsley, John. Yttrium. Nature's Building Blocks: An A-Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001: 495–498. ISBN 0-19-850340-7.
- Gadolin, Johan. Undersökning af en svart tung Stenart ifrån Ytterby Stenbrott i Roslagen. Kongl. Vetenskaps Academiens Nya Handlingar. 1794, 15: 137–155.
- Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford: Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- Stwertka, Albert. Yttrium. Guide to the Elements Revised. Oxford University Press. 1998: 115–116. ISBN 0-19-508083-1.
- van der Krogt, Peter. 39 Yttrium. Elementymology & Elements Multidict. 2005-05-05 [2008-08-06].
- 元素钇在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 钇(英文)
- 元素钇在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素钇在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 钇(英文)

