铍(拼音:pí,注音:ㄆ丨ˊ,粤拼:pei4;英语:Beryllium;旧译鋍、鑉、鋊),是一种化学元素,其化学符号为Be,原子序数为4,原子量为9.0121831 u,属于碱土金属。铍通常在宇宙射线散裂过程中产生,是宇宙中较为稀有的元素之一。所有自然界中的铍都与其他元素结合,形成矿物,如绿柱石(海蓝宝石、祖母绿)和金绿宝石等。单质铍呈钢灰色,轻、硬而易碎。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
灰白色金属 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 铍(Beryllium)·Be·4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 碱土金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 2 ·2·s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 9.0121831(5) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [He] 2s2 2, 2 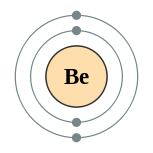 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 路易-尼古拉·沃克兰(1797年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 分离 | 弗里德里希·维勒和安托万·比西(1828年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 固体 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (接近室温) 1.85 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点时液体密度 | 1.690 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 1560 K,1287 °C,2349 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 2742 K,2469 °C,4476 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | 12.2 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | 292 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | 16.443 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | +2, +1[1] (两性氧化物) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 1.57(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:899.5 kJ·mol−1 第二:1757.1 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子半径 | 112 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 96±3 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 153 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方密堆积 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电阻率 | (20 °C)36 nΩ·m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 200 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 膨胀系数 | (25 °C)11.3 µm·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速(细棒) | (室温)12,890 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杨氏模量 | 287 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 剪切模量 | 132 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 体积模量 | 130 GPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 泊松比 | 0.032 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 莫氏硬度 | 5.5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 维氏硬度 | 1670 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 布氏硬度 | 590–1320 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7440-41-7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:铍的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
在铝、铜、铁和镍中加入铍作为合金材料,可以加强其物理性质。[5]用铍铜合金制成的工具十分坚硬,在敲击钢铁表面时也不会产生火花。由于铍的抗弯刚度、热稳定性、热导率都很高,密度却很低(只有水的1.85倍),所以适合做航空航天材料,用于导弹、航天器和人造卫星之中。[5]X射线等电离辐射能够穿透低密度和低原子量的铍,所以在X光仪器和粒子物理学实验中都常用铍作为窗口材料。[5]铍和氧化铍可以很好地传导热量,因此被用于控制器械的温度。
在处理铍的时候,必须使用适当的措施控制粉尘,因为吸入含铍粉尘会引致可致命的慢性过敏性铍中毒。[6]
铍是一种呈钢灰色的坚硬金属,在室温下易碎,晶体呈六方密排结构。[5]其刚性极高(杨氏模量为287GPa),熔点也很高。铍的弹性模量大约比钢铁高50%,又因密度较低,所以它的音速特别高,在标准温度和压力下约为12.9 km/s。由于热容量(1925 J·kg−1·K−1)和热导率(216 W·m−1·K−1)都很高,因此铍是每单位重量散热性最佳的金属材料。其线性热膨胀率(11.4×10−6 K−1)较低,在热负荷条件下有着特殊的稳定性。[7]
核物理性质
除微量由宇宙射线所致的放射性同位素以外,天然铍几乎完全由核自旋为的铍-9同位素组成。铍的高能中子截面较大,对能量高于10keV的中子截面约为6靶恩。因此,它是一种中子反射体和中子减速剂,能使中子热能降至0.03eV以下。铍对这些低能中子的截面比高能中子低至少一个数量级,其确切截面值取决于材料雏晶的纯度和大小[8]。
9Be同位素还会进行中子能量高于1.9MeV的(n,2n)中子反应,产生,后者立刻又分裂成两个α粒子。所以对于高能中子来说,铍是一种中子倍增剂,即它释放的中子多于吸收的中子。核反应式如下:[9]
铍原子核受高能粒子撞击时会释放中子,[7]反应式如下:
铍在氘核和质子的撞击下也会释放中子,所以在实验室中可用镭、钋和钚对铍进行辐射作为中子源。[9]
原子核在吸收低能中子后,会释放少量的氚。反应共有三步骤:
其中的半衰期只有0.8秒,是电子,的高能中子截面较高。氚是核反应废料中受关注的放射性同位素之一。[10]
大部分波长的X射线和γ射线都可以穿透铍金属,所以铍可以做X射线管等器材的窗口材料[7]。
同位素与核合成
恒星内部会产生铍的稳定和不稳定同位素,其中不稳定同位素会迅速衰变。宇宙射线会引致星际物质中更重的元素裂变,产生铍。科学家相信,宇宙中大部分的稳定铍同位素都是这样产生的。[11]原始铍只由这一种稳定同位素组成,所以铍属于单一同位素元素[12]。
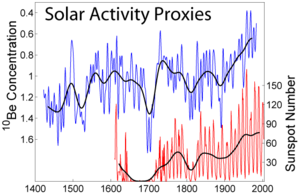
地球大气层中的氧受宇宙射线散裂,会产生放射性。[13]在土壤表面积累,并存留一段较长的时间(半衰期为136万年),再衰变成硼-10。因此及其衰变产物可用于检测自然水土流失、成土作用和红土的形成,以及间接测量太阳周期和冰芯的年龄。[14]的生成率与太阳活动成反比,因为太阳活动越高,太阳风就越强,能够抵达地球的宇宙射线通量也就越低。[13]核爆时,快中子和空气中二氧化碳的反应,也会形成。利用这一现象,可以推测一个地点是否进行过核试验。[15]半衰期为53天的同位素也是由宇宙射线产生的,其在大气中的含量同一样和太阳黑子数目有关联[16]。
的半衰期只有约s。这在宇宙学上有重要的意义,因为任何比铍更重的元素都不可能在大爆炸核聚变中形成:[16]核合成阶段没有足够的时间把4He原子核聚变在一起,的浓度又太低,所以无法形成碳。英国天文学家弗雷德·霍伊尔首次表明,在以氦为燃料的恒星内部,时间充裕,和也有足够的能量触发3氦过程来产生碳。恒星所制造的碳和众多元素一样,经渐近巨星分支恒星和超新星喷射出来,最终成为地球以及碳生命的组成元素。[17]
铍原子的内层电子可以参与化学成键。当经电子捕获衰变时,其原子核会拿去内层电子。因此铍的电子排布能够影响其衰变率,程度可观,这在各种核素的核衰变中属于较为罕见的现象。[18]
会经中子发射衰变,其半衰期为s,是所有已知铍同位素中最短的。半衰期亦很短,只有s。[19]特殊同位素和原子核带有核晕,[20]即分别有1个和4个中子在古典费米水滴核模型的外围较远处运转。
铍较低的原子半径和离子半径决定了它的化学性质。其电离能非常高,与其他原子键合时有很强的极化性,所以所有铍化合物都属于共价化合物。[5]根据对角线规则,与元素周期表中邻近的元素相比,铍的化学性质更接近铝,因为两者的电荷半径之比都很高。[5]铍的表面会形成氧化层,有效避免进一步被空气氧化;要加热至1000 °C以上,铍才会继续和空气发生反应。[5][21]燃烧中的铍会产生明亮的光芒,并形成氧化铍和氮化铍。[21]铍易溶于如氢氯酸和稀释硫酸等非氧化酸,但不溶于的硝酸和水。[5]和铝一样,铍在水中会形成氢氧化物保护层,避免进一步反应。[22]铍也可以溶于碱溶液中。[5]
铍原子的电子排布为[He] 2s2。由于有两个价电子,所以铍几乎永远以+2氧化态形成两个共价键。+1态较罕见,如须在高温下制备、在低温下会歧化的的一氯化铍。[22]根据八隅体规则,原子会尽量达到8价状态,使电子排布接近稀有气体元素。铍在形成两个共价键后会有4个价电子,即八隅体的一半,所以铍的配位数为4。[5]这一配位数使氟化铍和氯化铍等铍化合物能够形成聚合物。
硫酸铍和硝酸铍等铍盐溶液呈酸性,因为[Be(H2O)4]2+离子会进行水解反应:
水解的产物还包括三聚体离子。氢氧化铍()属于两性化合物,可溶于强碱溶液中,但不可溶于中性和酸性溶液中。
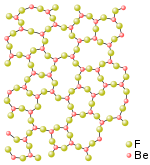
铍可以和许多非金属形成二元化合物,包括与氟、氯、溴和碘所形成的无水卤化物。氟化铍(BeF2)的结构类似于二氧化硅,形成角与角相接的四面体形。氯化铍()和溴化铍()具有链条状结构,形成边与边相接的四面体形。气态下的卤化铍形成线形单体分子结构。[21]
氟化铍()是比较特殊的二氟化物:其共价性质比其他碱土金属的氟化物强得多,但仍比其他卤化铍更接近离子化合物。它和二氧化硅()有许多相似之处。两者都形成四面体配位结构,并会玻璃化。氟化铍的室温晶体结构和某些高温结构都和石英相同。与其他碱土金属氟化物不同的是,氟化铍易溶于水。[23]由于氟化铍具有部分共价键性质,所以它在水溶和熔融状态下的电导率比假设它为完全离子化合物所得数值低得多。[24][25][26][27]
氧化铍()是一种白色耐火材料,晶体结构和硫化锌相同,热导率和某些金属一样高,属于两性化合物。Be(OH)2经酸处理后,可制备各种铍盐。[21]已知铍盐包括硫化铍、硒化物和碲化物,它们都具有立方晶系结构。[22]
氮化铍()是一种可以轻易水解的高熔点化合物。铍也可以形成叠氮化铍()。的结构与相似。碱式硝酸铍和碱式醋酸铍都具有四面体型结构,每个中心氧离子与四个铍原子配位。[22]铍有几种已知的硼化物,如、、、、和。碳化铍()是一种砖红色耐火材料,和水反应后会产生甲烷。[22]铍没有已知的硅化物。[21]


铍在太阳中的浓度约为十亿分之0.1,[28]在地球地壳中的浓度约为百万分之2至6,[29]其中土壤的铍浓度最高,约为百万分之6。铍在海水中的浓度为万亿分之0.2至0.6,在湖泊中为万亿分之1.1,在泉水等流动水源中则可高达十亿分之0.1。地球大气中也有痕量的铍。[30]
含有铍的矿物有上百种,[31]但都并不常见。这些矿物有:羟硅铍石()、绿柱石()、金绿宝石()、硅铍石()等等。较珍贵的绿柱石种类包括海蓝宝石、红绿柱石和祖母绿。[7][32][33]绿柱石宝石呈绿色,是因为其中含有少量的铬。不同品种绿柱石的铬含量各异,在祖母绿中大约为2%。绿柱石和羟硅铍石是铍的主要矿石,分布于阿根廷、巴西、印度、马达加斯加及美国。全球铍矿藏在40万吨以上。[34]
绿柱石是一种含铍的矿物,至少从埃及托勒密王朝就开始被人使用。公元1世纪,罗马博物学家老普林尼在其所著的百科全书《博物志》中提到绿柱石和祖母绿有相似之处。3至4世纪写成的《斯德哥尔摩纸莎草书》记载了这两种矿物的人工制造配方。[35]

马丁·克拉普罗特、托尔贝恩·贝里曼、弗朗兹·卡尔·阿哈尔德和约翰·雅各布·宾特海姆宾德海姆(Johann Jakob Bindheim)最早研究绿柱石和祖母绿时,总是取得相似的元素,所以误认为矿石都是硅酸铝组成的。[36]矿物学家勒内·茹斯特·阿羽依发现这两种晶石有相同的几何形状,并请化学家路易-尼古拉·沃克兰做一次化学分析。[35]
1798年,沃克兰在一份向法兰西学会发表的论文中称,他把绿柱石和祖母绿中的氢氧化铝溶解于碱中后,发现了一种新的“土”。[37]由于这种新物质所形成的盐有甜味,因此《化学与物理年刊》的编辑为它起名为“Glucine”,源于希腊文γλυχυς(甜)、γλυχύ(甜酒)和γλυχαιτω(加入甜味)。[38]之后大约160年,铍元素都被称为“Glucinium”或“Glucinum”,符号为Gl[39]或G[40],中文译作鋊[41]或鑉。然而,当时已经有一种名为Glycine的植物,而且氧化钇也同样会形成有甜味的盐,所以克拉普罗特认为更应该以绿柱石(Beryl)为这种物质命名为“Beryllina”。[42][43]弗里德里希·维勒在1828年首次使用元素名称“Beryllium”。[44]

1828年,弗里德里希·维勒[45]和安托万·比西[46]使钾金属和氯化铍发生反应,各自独立分离出铍元素。
维勒把氯化铍和钾交替叠起,并在铂制坩埚中利用酒精灯进行加热。以上反应立刻开始进行,坩埚达到白热温度。他观察到,在冷却和清洗之后所剩余的灰黑色粉末是由具有金属光泽的细小粒子组成的。[47]这种利用钾的制备方法产量较低,无法制成铍金属铸块。
1898年,保罗·勒博对氟化铍和氟化钠的混合熔融物直接进行电解,首次分离出高纯度铍样本(99.5至99.8%纯度)。铍熔点很高,所以同样的过程在分离铍的时候比分离碱金属所需能耗更高。20世纪初,一些科学家受锆分离过程的启发,试图对碘化铍进行热分解来分离出铍金属,但最后发现该方法在大规模生产上的经济效益太低。[48]阿尔弗雷德·施托克和汉斯·戈尔德施密特于1932年研发出铍金属的首个商业化生产过程。[47]他们在氟化铍中加入钡,使熔融铍可以积累在水冷铁制阴极上。
詹姆斯·查德威克在1932年用α粒子对铍样本进行撞击,从而发现了中子。[34]以此方法为原理的一种放射性同位素中子源,可以每十万个粒子产生3个中子。[29]
第二次世界大战期间,铍的生产随着铍铜合金和萤光灯磷光体的需求而大增。大部分早期萤光灯用含不同比例铍的原硅酸锌来发出绿光,但在人们发现铍具有毒性之后,含铍磷光体就被卤磷酸盐磷光体淘汰了。[49]
1957年,纯铍金属开始有商业规模的生产,但市场需求却远比人们想像的低。[34]真空铸造的铍金属块在2001年于美国的售价为每磅338美元(即每公斤745美元)。[50]1998到2008年间,铍的全球年产量从343吨降至约200吨,其中176吨(88%)产于美国。[51][52]
铍在高温下对氧有很强的亲和力,在去除表面氧化层后则会对水进行还原反应,因此从化合物中萃取出铍并不容易。只有美国、中国和哈萨克斯坦有大规模的铍萃取工业。[53]
铍一般从绿柱石提取,有用萃取剂烧结或熔化成可溶混合物两种方法。用烧结法,首先绿柱石在770°C与氟硅酸钠和碱混合,形成氟铍酸钠和二氧化硅。[5]把氟铍酸钠加入氢氧化钠溶液,使氢氧化铍沉淀出来。用熔融法,绿柱石须磨碎成粉,并加热至1650°C。[5]熔融物用水迅速降温,再在硫酸中重新加热至250到300°C,主要产生硫酸铍和硫酸铝。[5]最后用氨水去除铝和硫,留下氢氧化铍。
从氢氧化铍到铍金属也有两种途径。用第一种方法,对氢氧化铍加入水溶氟化氢铵,使四氟铍酸铵沉淀出来,沉淀物加热至1000°C后即会形成氟化铍。[5]氟化铍在900°C与镁发生反应,形成铍细粉,继续加热至1300°C之后可得出铍金属块。[5]用另一种方法,对氢氧化铍加热产生氧化铍,再与碳和氯发生反应形成氯化铍。氯化铍经电解后即可得出铍金属。[5]
辐射窗口材料


铍的原子序和X射线吸收率都很低,所以最早被应用于X射线管的辐射窗口,至今这仍是铍的一大用途。[34]为避免在X射线影像上产生额外的痕迹,铍金属必须纯度高且彻底干净。铍对X射线的吸收率极低,不会在同步加速器能量等级的X射线下过分加热。真空室窗口和同步加速器射束管都完全以铍作为材料。X射线光谱实验的样本固定器一般都以铍制成,因为铍所发出的X射线能量(约为100eV)比大部分样本材料低得多。[7]
高能粒子也能够轻易穿透铍金属,所以铍适合做粒子物理学实验中撞击区周围的材料,这些实验包括:大型强子对撞机四个主要实验(分别为大型离子对撞机实验、超环面仪器、紧凑缈子线圈、LHCb)、[54]兆电子伏特加速器以及SLAC。铍的优点有四:密度低,能够减少撞击产物在抵达四周的探测器之前的交互作用;刚性高,射束管内可以维持高真空,从而降低各种气体对实验的干扰;热稳定性高,能够承受绝对零度以上几度的低温;具抗磁性,不会干扰用于聚焦和引导粒子束的多极磁系统。[55]
机械
铍金属刚性高、密度低,在很大的温度范围内都可稳定保持形状,所以在国防及航空航天工业中可做轻质结构部件材料,用于高速飞机、导弹、航天器和卫星等。一些液体火箭发动机喷嘴以纯铍制成。[56][57]科学家曾经考虑用铍金属粉末作为火箭燃料,但这一计划从未付诸实行。[34]一些自行车用铍造车架,价格极其昂贵。[58]1998年至2000年,迈凯轮一级方程式车队所用的梅赛德斯-奔驰引擎活塞由铍铝合金制造,[59]但在法拉利车队抗议之后,国际汽车联合会决定禁止使用铍引擎部件。[60]
在铜里面加入约2.0%的铍,可形成比铜金属强六倍的铍铜合金。[61]铍合金弹性高、电导率高、热导率高、强度高、硬度高、无磁性、抗腐蚀性强、抗疲劳性强,因此用途很广,[34][5]例如在可燃气体附近使用的无火花工具(铍镍)、弹簧及外科器材和高温仪器中的薄膜(铍镍和铍铁)等。[34][5]在液态镁当中只须加入十万分之5的铍,就会显著加强抗氧化性及降低易燃性。[5]

铍的弹性刚度高,在精密仪器方面有广泛的应用,例如惯性导航系统和光学系统中的支撑部分。[7]铍铜合金被用于剥除船体油漆的工具中。[62]
由于硬度高、熔点高、散热性强,所以铍曾被用在军用飞机的制动器中。因环保原因,铍已被其他材料替代。[7]
镜面
铍密度低,并可长期不变形,可以用作气象卫星的大面积蜂巢状镜子材料。小型铍镜子则可用于光学导向系统和火控系统,例如德国的豹1型坦克和 豹2型坦克。这些系统须要快速运动,所以镜面必须轻,但刚度必须高。铍镜面通常涂上无电解镍镀层,在抛光后的光学精度能比直接用铍更高。不过,在须低温作业的应用上,铍镜面会直接抛光,因为镀镍后所造成的冷热收缩率不均会使镜面弯曲。[7]
詹姆斯·韦伯太空望远镜[63]将由18块六边形铍镜子组成。由于望远镜的作业温度为33 K,镜子须由比玻璃更能承受极低温度的镀金铍金属制成。[64]同理,史匹哲太空望远镜也带有铍金属镜子。[65]
磁应用
铍基材料不受磁铁吸引,所以适合用来处理一般使用磁力引线的水雷。[66][可疑]核磁共振成像仪会产生巨大的磁场,其结构材料也常会使用铍。[67]在无线电和雷达方面,铍制工具可用于调节磁力极强的速调管、磁控管、行波管等产生强微波的发送器组件。[68]
核应用

一些核武器设计方案用铍制薄板或薄片来做氢弹第一级钚核的最外层材料,用于包裹裂变物质,有助钚-239内爆和中子反射。[69]
当在实验室中需要少量中子时,可把铍用作中子源,无须用到核反应堆或粒子加速器。要产生中子,须对铍目标体进行高能α粒子的撞击,α粒子源可以是钋-210、镭-226、钚-239、镅-241等放射性同位素。α粒子与铍原子核反应之后,铍会嬗变成碳-12,并发射一颗中子。中子的方向接近于原先α粒子的前进方向。这种以α衰变驱动的铍中子源称为海胆型中子引发剂,曾用于早期核武器中。[69]铍在γ衰变同位素的γ射线照射下也可以作为实验室中子源。[70]
在加拿大重水铀反应堆(CANDU)中,铍被用于制造燃料。每根燃料棒束都有经感应焊焊法焊焊到燃料包层上的小附体,所用的焊料就是铍。轴瓦可避免燃料棒束和压力管之间接触,而内部元件间隔垫则避免元件之间接触。
欧洲联合环形加速器和国际热核聚变实验反应堆都有使用铍。[71]有科学家提出利用铍的力学、化学和核性质制造核燃料棒的包壳。[7]氟化铍是共晶盐混合物氟锂铍()的成分之一。不少假想的熔盐堆设计都利用氟锂铍作为溶剂、中子减速剂和冷却剂。[72]
声学
铍质量低、刚度高,因此适合做高频扬声器驱动器材料。但由于铍价格昂贵(比钛高几倍),塑性时易碎,且具有毒性,所以一般只有高端家居、专业音响和公共广播才会使用含铍的高音扬声器。[73][74][75][76][77]一些厂商甚至会将不含铍的扬声器称为“铍扬声器”。[78]
电子应用
铍属于3-5族化合物半导体的P型掺杂物,常用于以分子束磊晶法长成的材料之中,如砷化镓、砷化铝镓和砷化铟钾等。[79]在表面安装技术上,横轧铍金属片可以为印刷电路板提供极佳的结构支撑。除此之外,铍还可以用来制造散热片。其热膨胀率须要与矾土和聚酰亚胺玻璃基底相匹配。铍-氧化铍金属基复合材料(E-材料)可用于这些电子应用上,且可以针对各种基底材料来调节其热膨胀率。[7]
氧化铍是一种热导率、强度、硬度和熔点都很高的电绝缘体,常被用于无线电发送器的大功率晶体管之中。科学家正在尝试用氧化铍来提高氧化铀核燃料球的热导率。[80]荧光灯管曾含有铍化合物,但这一应用在灯厂工人开始患上铍中毒之后陆续被终止。[81]
人体内有大约35毫克的铍,不足以造成伤害。铍的化学性质和镁相似,所以会在酶中取代镁,破坏酶的功能。若在短时间内吸入大量或长期吸入少量的铍粉尘,都会引致肺部和循环系统肉芽肿病,是为铍中毒。铍中毒的症状可能在五年以后才开始出现,对三分之一病人致死,对其余则致残。[82]国际癌症研究机构(IARC)将铍和铍化合物列为1类致癌物。[83]美国职业安全与健康管理局(OSHA)为铍设下了暴露限值为:时间加权平均值每30分钟0.002mg/m3,峰值0.025mg/m3。美国国家职业安全卫生研究所(NIOSH)所建议的暴露限值为0.0005mg/m3。铍的立即威胁生命健康值(IDLH)为4mg/m3。[84]
欧洲和美国分别在1933年和1943年开始有铍中毒所造成的化学性肺炎记录。调查指出,在1949年美国有5%的荧光灯厂工人患有铍相关的肺病。[85]慢性铍中毒在很多方面都和结节病相似,鉴别诊断较为困难。一些参与核武器研发的早期工人也因此病逝,如曼哈顿计划成员赫伯特·安德森。[86]
煤渣可以做研磨剂,用于磨去坚硬表面上的油漆和铁锈。但煤渣含有铍,所以铍会在研磨过程中弥漫在空气之中,有吸入摄取的危险。[87]
科学家在早期须辨尝各种化合物,用味觉判断铍的存在,但这种危险性极高的做法已被现代仪器完全淘汰。[5]吸入过多的含铍飞尘会提高罹患肺癌的可能性,所以铍和铍化合物都须要小心处理,特别须避免产生飞尘。虽然铍化合物自1949年已不再用于荧光灯管中,但在今天仍有一些可能摄取铍的行业,包括:核工业、航空航天工业、铍金属的提炼与铍合金产业、电子产品产业等等。[88]
国际上已对在空气中和各种表面上的铍含量测量法标准达成共识(标准ASTM D7202)。方法先用稀释氟化氢铵进行溶解,再与硫化羟基苯奎宁结合,最后用荧光检测法检测铍的含量(含量越高则荧光亮度越高)。此方法的灵敏度为工作场所铍含量建议值的100倍,可在各种表面上探测微量的耐火氧化铍和硅质铍(标准ASTM D7458)。[89][90]
- ^ Beryllium: Beryllium(I) Hydride compound data (PDF). bernath.uwaterloo.ca. [2007-12-10]. (原始内容 (PDF)存档于2007-12-02).
- ^ Standard Atomic Weights 2013 (页面存档备份,存于互联网档案馆). Commission on Isotopic Abundances and Atomic Weights
- ^ 存档副本. [2016-02-26]. (原始内容存档于2016-02-19).
- ^ Haynes, William M. CRC handbook of chemistry and physics: a ready-reference book of chemical and physical data 92nd. Boca Raton, FL.: CRC Press. 2011: 14.48. ISBN 978-1-4398-5511-9. OCLC 730008390 (英语).
- ^ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 5.19 Jakubke, Hans-Dieter; Jeschkeit, Hans (编). Concise Encyclopedia Chemistry. trans. rev. Eagleson, Mary. Berlin: Walter de Gruyter. 1994.
- ^ Puchta, Ralph. A brighter beryllium. Nature Chemistry. 2011, 3 (5): 416. Bibcode:2011NatCh...3..416P. PMID 21505503. doi:10.1038/nchem.1033.
- ^ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 7.8 7.9 Behrens, V. 11 Beryllium. Beiss, P. (编). Landolt-Börnstein – Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials 2A1. Berlin: Springer. 2003: 1–11. ISBN 978-3-540-42942-5. doi:10.1007/10689123_36.
- ^ 井上和彦、坂本幸夫. ベリリウムフィルターの散乱冷中性子による透過スペクトル歪 (PDF). 北海道大学工学部研究报告 (北海道大学): 57–61页。. [2017-10-14]. (原始内容存档 (PDF)于2016-03-05).
- ^ 9.0 9.1 Hausner, Henry H. Nuclear Properties. Beryllium its Metallurgy and Properties. University of California Press. 1965: 239.
- ^ Tomberlin, T. A. Beryllium – A Unique Material In Nuclear Applications (PDF). Idaho National Laboratory. Idaho National Engineering and Environmental Laboratory. [2004-11-15]. (原始内容 (PDF)存档于2015-12-22).
- ^ Ekspong, G. Physics: 1981–1990. World Scientific. 1992: 172 ff. ISBN 978-981-02-0729-8.
- ^ Brian, Monica (2010) p. 58
- ^ 13.0 13.1 Emsley 2001,第56页.
- ^ Beryllium: Isotopes and Hydrology. University of Arizona, Tucson. [2011-04-10]. (原始内容存档于2013-05-26).
- ^ Whitehead, N; Endo, S; Tanaka, K; Takatsuji, T; Hoshi, M; Fukutani, S; Ditchburn, Rg; Zondervan, A. A preliminary study on the use of (10)Be in forensic radioecology of nuclear explosion sites. Journal of environmental radioactivity. Feb 2008, 99 (2): 260–70. PMID 17904707. doi:10.1016/j.jenvrad.2007.07.016.
- ^ 16.0 16.1 Boyd, R. N.; Kajino, T. Can Be-9 provide a test of cosmological theories?. The Astrophysical Journal. 1989, 336: L55. Bibcode:1989ApJ...336L..55B. doi:10.1086/185360.
- ^ Arnett, David. Supernovae and nucleosynthesis. Princeton University Press. 1996: 223. ISBN 0-691-01147-8.
- ^ Johnson, Bill. How to Change Nuclear Decay Rates. University of California, Riverside. 1993 [2008-03-30]. (原始内容存档于2013-06-23).
- ^ Hammond, C. R. "Elements" in Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ Hansen, P. G.; Jensen, A. S.; Jonson, B. Nuclear Halos. Annual Review of Nuclear and Particle Science. 1995, 45: 591. Bibcode:1995ARNPS..45..591H. doi:10.1146/annurev.ns.45.120195.003111.
- ^ 21.0 21.1 21.2 21.3 21.4 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements 2nd. Oxford:Butterworth-Heinemann. 1997. ISBN 0-7506-3365-4.
- ^ 22.0 22.1 22.2 22.3 22.4 Wiberg, Egon; Holleman, Arnold Frederick. Inorganic Chemistry. Elsevier. 2001. ISBN 0-12-352651-5.
- ^ Storer, Frank Humphreys. First Outlines of a Dictionary of Solubilities of Chemical Substances. Cambridge. 1864: 278–80. ISBN 978-1-176-62256-2.
- ^ Bell, N. A. Beryllium halide and pseudohalides. Emeléus, Harry Julius; Sharpe, A. G. (编). Advances in inorganic chemistry and radiochemistry 14. New York: Academic Press. 1972: 256–277. ISBN 978-0-12-023614-5.
- ^ Walsh, Kenneth A. Beryllium chemistry and processing. ASM International. 2009-08-01: 99–102, 118–119. ISBN 978-0-87170-721-5.
- ^ Mackay, Mackay & Henderson 2002,第243–244页.
- ^ Hertz, Raymond K. General analytical chemistry of beryllium. Coyle, Francis T. (编). Chemical analysis of metals: a symposium. ASTM. 1987: 74–75. ISBN 978-0-8031-0942-1.
- ^ Abundance in the sun. Mark Winter, The University of Sheffield and WebElements Ltd, UK. WebElements. [2011-08-06]. (原始内容存档于2011-08-27).
- ^ 29.0 29.1 Merck contributors. O'Neil, Marydale J.; Heckelman, Patricia E.; Roman, Cherie B. , 编. The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals 14th. Whitehouse Station, NJ, USA: Merck Research Laboratories, Merck & Co., Inc. 2006. ISBN 0-911910-00-X.
- ^ Toxicological Profile for Beryllium (PDF) (Report). U.S. Department of Health and Human Services. 2002 [2016-02-26]. (原始内容存档 (PDF)于2016-05-10).
- ^ Mindat search on Be. [2016-02-26]. (原始内容存档于2016-03-04).
- ^ Walsh, Kenneth A. Sources of Beryllium. Beryllium chemistry and processing. 2009: 20–26 [2016-02-26]. ISBN 978-0-87170-721-5. (原始内容存档于2016-05-13).
- ^ Mining, Society for Metallurgy, Exploration (U.S). Distribution of major deposits. Industrial minerals & rocks: commodities, markets, and uses. 2006-03-05: 265–269 [2016-02-26]. ISBN 978-0-87335-233-8. (原始内容存档于2016-05-04).
- ^ 34.0 34.1 34.2 34.3 34.4 34.5 34.6 Emsley 2001,第58页.
- ^ 35.0 35.1 Weeks 1968,第535页.
- ^ Weeks 1968,第537页.
- ^ Vauquelin, Louis-Nicolas. De l'Aiguemarine, ou Béril; et découverie d'une terre nouvelle dans cette pierre [Aquamarine or beryl; and discovery of a new earth in this stone]. Annales de Chimie. 1798, 26: 155–169 [2016-02-26]. (原始内容存档于2016-04-27).
- ^ 请见第169页 (页面存档备份,存于互联网档案馆)的法文脚注。
- ^ Black, The Macmillan Company, New York, 1937
- ^ John Newlands' table of octaves
- ^ 鋊. 台湾教育部. [2016-01-20]. (原始内容存档于2016-03-07).
- ^ Klaproth, Martin Heinrich, Beitrage zur Chemischen Kenntniss der Mineralkörper, vol. 3, (Berlin: Heinrich August Rottmann, 1802), pages 78-79 (页面存档备份,存于互联网档案馆)
- ^ Weeks 1968,第538页.
- ^ Wöhler, F. Ueber das Beryllium und Yttrium [On beryllium and yttrium]. Annalen der Physik und Chemie. 1828, 13 (89): 577–582 [2016-02-26]. (原始内容存档于2016-04-26).
- ^ Wöhler, Friedrich. Ueber das Beryllium und Yttrium. Annalen der Physik und Chemie. 1828, 89 (8): 577–582 [2016-02-26]. Bibcode:1828AnP....89..577W. doi:10.1002/andp.18280890805. (原始内容存档于2016-05-27).
- ^ Bussy, Antoine. D'une travail qu'il a entrepris sur le glucinium. Journal de Chimie Medicale. 1828, (4): 456–457 [2016-02-26]. (原始内容存档于2016-05-22).
- ^ 47.0 47.1 Weeks 1968,第539页.
- ^ Babu, R. S.; Gupta, C. K. Beryllium Extraction – A Review. Mineral Processing and Extractive Metallurgy Review. 1988, 4: 39. doi:10.1080/08827508808952633.
- ^ Kane, Raymond; Sell, Heinz. A Review of Early Inorganic Phosphors. Revolution in lamps: a chronicle of 50 years of progress. 2001: 98 [2016-02-26]. ISBN 978-0-88173-378-5. (原始内容存档于2016-05-07).
- ^ Beryllium Statistics and Information. United States Geological Survey. [2008-09-18]. (原始内容存档于2008-09-16).
- ^ Commodity Summary 2000: Beryllium (PDF). United States Geological Survey. [2010-05-16]. (原始内容存档 (PDF)于2010-06-01).
- ^ Commodity Summary 2000: Beryllium (PDF). United States Geological Survey. [2010-05-16]. (原始内容存档 (PDF)于2010-07-16).
- ^ Sources of Beryllium. Materion Brush Inc. [2011-08-06]. (原始内容存档于2014-10-25).
- ^ Veness, R.; Ramos, D.; Lepeule, P.; Rossi, A.; Schneider, G.; Blanchard, S. Installation and commissioning of vacuum systems for the LHC particle detectors (PDF). CERN. [2016-02-26]. (原始内容 (PDF)存档于2011-11-14).
- ^ Wieman, H; Bieser, F.; Kleinfelder, S.; Matis, H.S.; Nevski, P.; Rai, G.; Smirnov, N. A new inner vertex detector for STAR. Nuclear Instruments and Methods in Physics Research Section a Accelerators Spectrometers Detectors and Associated Equipment. 2001, 473: 205. Bibcode:2001NIMPA.473..205W. doi:10.1016/S0168-9002(01)01149-4.
- ^ Davis, Joseph R. Beryllium. Metals handbook. ASM International. 1998: 690–691. ISBN 978-0-87170-654-6.
- ^ Schwartz, Mel M. Encyclopedia of materials, parts, and finishes. CRC Press. 2002: 62. ISBN 1-56676-661-3.
- ^ Museum of Mountain Bike Art & Technology: American Bicycle Manufacturing. (原始内容存档于2011-07-20).
- ^ Ward, Wayne. Aluminium-Beryllium. Ret-Monitor. [2012-07-18]. (原始内容存档于2010-08-01).
- ^ Collantine, Keith. Banned! – Beryllium. [2012-07-18]. (原始内容存档于2012-07-21).
- ^ McGraw-Hill contributors. Geller, Elizabeth , 编. Concise Encyclopedia of Chemistry. New York City: McGraw-Hill. 2004. ISBN 0-07-143953-6.
- ^ Defence forces face rare toxic metal exposure risk. The Sydney Morning Herald. 2005-02-01 [2009-08-08]. (原始内容存档于2007-12-30).
- ^ Beryllium related details from NASA. NASA. [2008-09-18]. (原始内容存档于2008-05-29).
- ^ Gardner, Jonathan P. The James Webb Space Telescope (PDF). Proceedings of Science. 2007: 5 [2016-02-26]. Bibcode:2007mru..confE...5G. (原始内容 (PDF)存档于2016-03-03).
- ^ Werner, M. W.; Roellig, T. L.; Low, F. J.; Rieke, G. H.; Rieke, M.; Hoffmann, W. F.; Young, E.; Houck, J. R.; et al. The Spitzer Space Telescope Mission. Astrophysical Journal Supplement. 2004, 154: 1. Bibcode:2004ApJS..154....1W. arXiv:astro-ph/0406223
 . doi:10.1086/422992.
. doi:10.1086/422992.
- ^ Kojola, Kenneth; Lurie, William. The selection of low-magnetic alloys for EOD tools. Naval Weapons Plant Washington DC. 1961-08-09 [2016-02-26]. (原始内容存档于2011-08-23).
- ^ Dorsch, Jerry A. & Dorsch, Susan E. Understanding anesthesia equipment. Lippincott Williams & Wilkins. 2007: 891. ISBN 0-7817-7603-1.
- ^ Ropp, Richard C. Encyclopedia of the Alkaline Earth Compounds. 2012-12-31: 7 [2016-02-26]. ISBN 9780444595539. (原始内容存档于2016-05-11).
- ^ 69.0 69.1 Barnaby, Frank. How nuclear weapons spread. Routledge. 1993: 35. ISBN 0-415-07674-9.
- ^ Byrne, J. Neutrons, Nuclei, and Matter, Dover Publications, Mineola, NY, 2011, ISBN 0486482383, pp. 32–33.
- ^ Clark, R. E. H.; Reiter, D. Nuclear fusion research. Springer. 2005: 15. ISBN 3-540-23038-6.
- ^ Petti, D; Smolik, G; Simpson, M; Sharpe, J; Anderl, R; Fukada, S; Hatano, Y; Hara, M; et al. JUPITER-II molten salt Flibe research: An update on tritium, mobilization and redox chemistry experiments. Fusion Engineering and Design. 2006, 81 (8–14): 1439. doi:10.1016/j.fusengdes.2005.08.101.
- ^ Scan Speak offers Be tweeters to OEMs and Do-It-Yourselfers (PDF). Scan Speak. [2010-05-01]. (原始内容 (PDF)存档于2014-05-25).
- ^ Johnson, Jr., John E. Usher Be-718 Bookshelf Speakers with Beryllium Tweeters. 2007-11-12 [2008-09-18]. (原始内容存档于2011-06-13).
- ^ Exposé E8B studio monitor. KRK Systems. [2009-02-12]. (原始内容存档于2011-04-10).
- ^ Beryllium use in pro audio Focal speakers. [2010-07-10]. (原始内容存档于2012-12-31).
- ^ VUE Audio announces use of Be in Pro Audio loudspeakers. [2012-05-21]. (原始内容存档于2012-05-10).
- ^ Svilar, Mark. Analysis of "Beryllium" Speaker Dome and Cone Obtained from China. 2004-01-08 [2009-02-13]. (原始内容存档于2013-05-17).
- ^ Diehl, Roland. High-power diode lasers. Springer. 2000: 104. ISBN 3-540-66693-1.
- ^ Purdue engineers create safer, more efficient nuclear fuel, model its performance. Purdue University. 2005-09-27 [2008-09-18]. (原始内容存档于2012-05-27).
- ^ Breslin AJ. Chap. 3. Exposures and Patterns of Disease in the Beryllium Industry. Stokinger, HE (编). in Beryllium: Its Industrial Hygiene Aspects. Academic Press, New York. 1966: 30–33.
- ^ Emsley 2001,第57页.
- ^ IARC Monograph. International Agency for Research on Cancer. 1993 [2008-09-18]. (原始内容存档于2012-07-31).
|volume=被忽略 (帮助) - ^ NIOSH Pocket Guide to Chemical Hazards 0054
- ^ Emsley 2001,第5页.
- ^ Photograph of Chicago Pile One Scientists 1946. Office of Public Affairs, Argonne National Laboratory. 2006-06-19 [2008-09-18]. (原始内容存档于2008-12-11).
- ^ Newport News Shipbuilding Workers Face a Hidden Toxin (页面存档备份,存于互联网档案馆), Daily Press (Virginia), Michael Welles Shapiro, 31 August 2013
- ^ International Programme On Chemical Safety. Beryllium: ENVIRONMENTAL HEALTH CRITERIA 106. World Health Organization. 1990 [2011-04-10]. (原始内容存档于2011-06-09).
- ^ ASTM D7458 –08. American Society for Testing and Materials. [2009-08-08]. (原始内容存档于2010-07-12).
- ^ Minogue, EM; Ehler, DS; Burrell, AK; McCleskey, TM; Taylor, TP. Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces. Journal of ASTM International. 2005, 2 (9): 13168. doi:10.1520/JAI13168.
- Emsley, John. Nature's Building Blocks: An A–Z Guide to the Elements. Oxford, England, UK: Oxford University Press. 2001. ISBN 0-19-850340-7.
- Mackay, Kenneth Malcolm; Mackay, Rosemary Ann; Henderson, W. Introduction to modern inorganic chemistry 6th. CRC Press. 2002. ISBN 0-7487-6420-8.
- Weeks, Mary Elvira; Leichester, Henry M. Discovery of the Elements. Easton, PA: Journal of Chemical Education. 1968. LCCCN 68-15217.
- Newman LS. Beryllium. Chemical & Engineering News. 2003, 36 (36): 38. doi:10.1021/cen-v081n036.p038.
- Mroz MM, Balkissoon R, Newman LS. "Beryllium". In: Bingham E, Cohrssen B, Powell C (eds.) Patty's Toxicology, Fifth Edition. New York: John Wiley & Sons 2001, 177–220.
- Walsh, KA, Beryllium Chemistry and Processing (页面存档备份,存于互联网档案馆). Vidal, EE. et al. Eds. 2009, Materials Park, OH:ASM International.
- Beryllium Lymphocyte Proliferation Testing (BeLPT). DOE Specification 1142–2001. Washington, DC: U.S. Department of Energy, 2001.
- 元素铍在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 铍(英文)
- 元素铍在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素铍在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 铍(英文)
从维基百科的姊妹计划
了解更多有关 “铍”的内容 | |
| 维基词典上的字词解释 | |
| 维基共享资源上的多媒体资源 | |
| 维基文库上的原始文献 | |
| 维基教科书上的教科书和手册 | |
| 维基学院上的学习资源 | |
- (英文)ATSDR环境医学案例分析:铍的毒性 (页面存档备份,存于互联网档案馆)(美国卫生及公共服务部)
- (英文)Beryllium (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos(诺丁汉大学)
- (英文)美国国家职业安全卫生研究所:铍 (页面存档备份,存于互联网档案馆)
- (英文)美国铍价格趋势图 (页面存档备份,存于互联网档案馆)


 的铍-9
的铍-9 ,后者立刻又分裂成两个
,后者立刻又分裂成两个 粒子撞击时会释放中子,
粒子撞击时会释放中子, 原子核在吸收低能中子后,会释放少量的
原子核在吸收低能中子后,会释放少量的 的
的 是
是 的高能中子截面较高。氚是核反应废料中受关注的放射性同位素之一。
的高能中子截面较高。氚是核反应废料中受关注的放射性同位素之一。 这一种稳定同位素组成,所以铍属于
这一种稳定同位素组成,所以铍属于 。
。 反应,也会形成
反应,也会形成 同位素也是由宇宙射线产生的,其在大气中的含量同
同位素也是由宇宙射线产生的,其在大气中的含量同 s。这在宇宙学上有重要的意义,因为任何比铍更重的元素都不可能在
s。这在宇宙学上有重要的意义,因为任何比铍更重的元素都不可能在 也有足够的能量触发
也有足够的能量触发 会经
会经 s,是所有已知铍同位素中最短的。
s,是所有已知铍同位素中最短的。 半衰期亦很短,只有
半衰期亦很短,只有 s。
s。 和
和 原子核带有
原子核带有![{\displaystyle {\ce {[Be3(OH)3(H2O)6]^3+}}}](/img/wiki/Be/0019d6427cddd5d6e4da6bfe403163ced86dc2ec.svg)
 )属于
)属于
 )和
)和 )具有链条状结构,形成边与边相接的四面体形。气态下的卤化铍形成线形
)具有链条状结构,形成边与边相接的四面体形。气态下的卤化铍形成线形 )是比较特殊的二氟化物:其共价性质比其他
)是比较特殊的二氟化物:其共价性质比其他 )有许多相似之处。两者都形成四面体配位结构,并会玻璃化。氟化铍的室温晶体结构和某些高温结构都和
)有许多相似之处。两者都形成四面体配位结构,并会玻璃化。氟化铍的室温晶体结构和某些高温结构都和 )是一种白色
)是一种白色 )是一种可以轻易水解的高熔点化合物。铍也可以形成叠氮化铍(
)是一种可以轻易水解的高熔点化合物。铍也可以形成叠氮化铍( )。
)。 的结构与
的结构与 、
、 、
、 、
、 、
、 和
和 。
。 )是一种砖红色耐火材料,和水反应后会产生
)是一种砖红色耐火材料,和水反应后会产生 )、
)、 )、
)、 )、
)、 )等等。较珍贵的绿柱石种类包括
)等等。较珍贵的绿柱石种类包括 )的成分之一。不少假想的
)的成分之一。不少假想的











 空白
空白 相对原子质量
相对原子质量