

本条目存在以下问题,请协助改善本条目或在讨论页针对议题发表看法。
|
氮(拼音:dàn,注音:ㄉㄢˋ,粤拼:daam6;英语:Nitrogen),是一种化学元素,其化学符号为N,原子序数为7,原子量为14.007 u。1772年,在丹尼尔·卢瑟福分离空气后第一次被发现。虽然卡尔·威廉·舍勒及亨利·卡文迪什也在同一时间独立完成了相关研究,但因为卢瑟福更早公开发表而广受赞誉。1790年,法国化学家让-安托万·沙普塔(英语:Jean-Antoine Chaptal)提出了氮的法文命名nitrogène,因为在当时,氮多出现于硝酸和硝酸盐中。由于氮无法用于呼吸,安托万-洛朗·德·拉瓦锡提出了另一个英文命名azote,取自希腊语ἄζωτος,意思是“没有生命的”。这个名称被多数其他语言使用,例如法语、俄语等。同时,azote也出现在含氮相关化合物的英文名中。
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 外观 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
气体,液体及固体均为无色 液态氮 氮的原子光谱 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 概况 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称·符号·序数 | 氮(nitrogen)·N·7 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 元素类别 | 非金属 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 族·周期·区 | 15 ·2·p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 标准原子质量 | 14.007(1) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电子排布 | [氦]2s2 2p3 2, 5 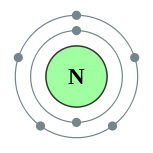 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 历史 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 发现 | 丹尼尔·卢瑟福(1772年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 命名 | 让-安托万·沙普塔(英语:Jean-Antoine Chaptal)(1790年) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物理性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 颜色 | 透明 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 物态 | 气态 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 密度 | (0 °C, 101.325 kPa) 1.251 g/L | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点时液体密度 | 0.808 g·cm−3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔点 | 63.15 K,−210.00 °C,−346.00 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 沸点 | 77.36 K,−195.79 °C,−320.33 °F | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 三相点 | 63.1526 K(−210 °C),12.53 kPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 临界点 | 126.19 K,3.3978 MPa | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 熔化热 | (N2) 0.72 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 汽化热 | (N2) 5.56 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 比热容 | (N2) 29.124 J·mol−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
蒸气压
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 原子性质 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 氧化态 | 5, 4, 3, 2, 1, −1, −2, −3 (强酸性) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电负性 | 3.04(鲍林标度) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 电离能 | 第一:1402.3 kJ·mol−1 第二:2856 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 共价半径 | 71±1 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 范德华半径 | 155 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 杂项 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 晶体结构 | 六方 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 磁序 | 抗磁性 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 热导率 | 25.83 × 10−3 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 声速 | (gas, 27 °C) 353 m·s−1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CAS号 | 7727-37-9 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 最稳定同位素 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
主条目:氮的同位素
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
氮是元素周期表第十五族氮族元素中最轻的一个。这个名字引用希腊文πνίγειν,意思是“有窒息性的”。氮是宇宙中常见的元素,他在银河系和太阳系中含量大约占第七。在标准温度和压强下,两个氮原子可以结合形成氮气(
很多工业上重要的化合物都含有氮原子,例如氨、硝酸、可用作推进剂或炸药的有机硝酸盐、氰化物等。氮原子之间可以形成非常牢固的氮氮三键(

含氮化合物除了作为肥料和能量储存的功用之外还有其他多种用途。氮是克维拉纤维和氰基丙烯酸酯强力胶水等多种材料的组成部分。在各种药学药品的大类中(包括抗生素)都含有氮元素。许多药物都是天然含氮信号分子的类似物或前体药物。比如,有机硝酸盐、硝酸甘油和硝普钠在体内代谢产生一氧化氮以控制血压。植物中的生物碱(经常是防卫性化合物)根据定义是含有氮的,许多知名的含氮药物(比如咖啡因和吗啡)是生物碱或是合成的天然产物类似物,像许多植物生物碱一样用作于动物体内的神经传导物质的接收器上(例如合成苯丙胺)。

氮及其化合物历史悠久。氮一般被认为是被苏格兰物理学家丹尼尔·卢瑟福在1772年发现的。他发现将生物放入这种气体中时都会窒息而死,因而将氮气叫做有害气体(noxious air)或固定气体(fixed air)。[2][3]卢瑟福清楚空气中有一种成分不支持燃烧。当时,卡尔·威廉·舍勒,亨利·卡文迪什和约瑟夫·普利斯特里也都在研究氮气。他们将它称为燃烧气(burnt air)或燃素。氮气很不活跃,因此被拉瓦锡称为有毒气体(法语:air méphitique)或azote。azote源于希腊词 ἄζωτος (azotos),意思是 "无生命的"。[4]在氮气里,动物死亡,火焰熄灭。拉瓦锡所给的氮气的名字被用于很多种语言(法语,意大利语,波兰语,俄语,阿尔巴尼亚语,等等),并且还处在于英语的一些化合物的常用名字里,比如肼和叠氮化合物。
英语单词nitrogen(1794)来自于法语单词nitrogène,是由法国化学家让-安托万·沙普塔(英语:Jean-Antoine Chaptal)将希腊语 νίτρον (nitron)(硝酸钠)与法语gène(生成)相结合后制造出来的新词。氮气常在硝酸气体中被发现。沙普塔的意思是,氮气是硝酸的一个组成部分,是由硝石(nitre)(硝酸钾)产生的。[5]
德文中便直接以sticken(导致窒息)和Stoff(物质)组合,命名为Stickstoff(导致窒息的物质),日文及韩文便自此将之意译为“窒素”。
19世纪70年代化学家徐寿将




氮化合物早在中世纪就广为人知了。炼金师知道硝酸是aqua fortis(强水)。硝酸和盐酸的混合物被称做aqua regia(王水), 因为它可以溶解黄金(金属之王)。最早的在军事,工业和农业上得氮化合物的应用是硝石(硝酸钠或硝酸钾)的使用,尤其是在火药中和作为肥料。1910年,瑞利男爵发现在氮气中放电可以产生“活性氮”,一种氮的单原子同素异形体。由他的仪器中产生的“明黄色的旋转的云”与汞反应后生成爆炸性的氮化汞。[7]
有相当长一段时间内,氮化合物的来源很有限。它们的自然来源要么是生物学,要么是大气反应生成的硝酸盐的沉积。对肥料的需求日益增长促进了氮化合物的工业化生产。工业化的固氮过程(如奥斯特瓦尔德法和氰氨法(英语:Frank-Caro process))消除了氮化合物的短缺。1910年代哈柏法的发现和工业化应用彻底改变了氮化合物的供应,对食品生产产生了很大影响,使得养活全世界日益增长的人口成为可能。[8]
氮是非金属,其电负性为3.04。[9]氮原子的外层有5个电子,因此它在绝大多数化合物中都是三价的。分子氮(

在1个大气压下,分子氮在77K(−195.79°C)时凝结(液化),在63K(−210.01°C)时凝固[10]成为β相的六方密积(英语:Close-packing of equal spheres)结构的晶体形态的同素异形体。在35.4K(−237.6°C)以下,氮被认为是立方晶体形态的同素异形体(被称为α相)。[11]液氮是像水一样的流体,但仅有水密度的80.8% (液氮在其沸点时的密度是0.808g/mL),是常用的制冷剂。[12]
氮的不稳定的同素异形体包含有多于2个氮原子(比如

其他的被预测出得氮的同素异形体有六氮苯(

同位素
已发现的氮的同位素共有十七种,包括





生物介导反应(例如同化,硝化反应和反硝化反应)牢牢地控制着土壤的氮动力学。这些反应一般会导致基质的

地球大气中的氮气的一小部分(0.73%)是同位素体(英语:isotopologue)

同素异形体
氮拥有多种同素异形体。最常见的莫过于氮气(





电磁光谱

分子氮(
氮通过电子碰撞激发的电子流而对地球高层大气里地可见的大气光有所贡献。这种可见的蓝色大气光(在极地的极光中以及返航的航天器的返航光中可见)一般不是来自于分子氮,而是源于自由氮原子结合氧生成一氧化氮(
氮气也会展示出闪烁(英语:Scintillation (physics))。
氮可以形成多种不同的氮氧化物。在氧化物中,氮的氧化数可以从+1到+5,甚至+6(三氧化氮)。其中以NO和NO2较为重要。
氮的氧化物的性质如下表:
| 名称 | 化学式 | 状态 | 颜色 | 化学性质 | 熔点(℃) | 沸点(℃) | 一般用途 |
|---|---|---|---|---|---|---|---|
| 一氧化二氮(笑气) | 
|
气态 | 无色 | 稳定 | -90.8 | -88.5 | 火箭和赛车的氧化剂及增加发动机的输出功率。 |
| 一氧化氮 | 
|
气态 | 无色(固态、液态时为蓝色) | 反应能力适中 | -163.6 | -151.8 | 引起血管的扩张而引起勃起和生产硝酸 |
| 三氧化二氮 | 
|
液态 | 蓝色 | 室温下分解为NO和NO2 | -102 | -3.5(分解) | |
| 二氧化氮 | 
|
气态 | 红棕色 | 强氧化性 | -11.2 | 21.2 | 生产硝酸 |
| 四氧化二氮 | 
|
气态 | 无色 | 强烈地分解为NO2 | -92 | 21.3 | 火箭推进剂组分中的氧化剂 |
| 五氧化二氮 | 
|
固态 | 无色 | 不稳定 | 30 | 47(分解) | |
| 三氧化氮 | 
|
- 元素氮在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 氮(英文)
- 元素氮在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素氮在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 氮(英文)
| 维基共享资源中相关的多媒体资源:氮 |
- 氮族元素
- ^ Common Bond Energies (D) and Bond Lengths (r) (页面存档备份,存于互联网档案馆). wiredchemist.com
- ^ Lavoisier, Antoine Laurent. Elements of chemistry, in a new systematic order: containing all the modern discoveries. Courier Dover Publications. 1965: 15. ISBN 0-486-64624-6.
- ^ Weeks, Mary Elvira. The discovery of the elements. IV. Three important gases. Journal of Chemical Education. 1932, 9 (2): 215. Bibcode:1932JChEd...9..215W. doi:10.1021/ed009p215.
- ^ Elements of Chemistry, trans. Robert Kerr (Edinburgh, 1790; New York: Dover, 1965), 52.
- ^ nitrogen (页面存档备份,存于互联网档案馆). Etymonline.com. Retrieved on 2011-10-26.
- ^ 刘怀乐. 化学鉴源与略考. 化学教育. 1994, (04) [2013-02-25]. (原始内容存档于2013-10-04).
- ^ Lord Rayleigh's Active Nitrogen. Lateral Science. [2013-10-01]. (原始内容存档于2012-11-01).
- ^ Erisman, Jan Willem; Sutton, Mark A.; Galloway, James; Klimont, Zbigniew; Winiwarter, Wilfried. How a century of ammonia synthesis changed the world. Nature Geoscience. 2008, 1 (10): 636. Bibcode:2008NatGe...1..636E. doi:10.1038/ngeo325.
- ^ Lide, D. R. (编). CRC Handbook of Chemistry and Physics 84th. Boca Raton, FL: CRC Press. 2003.
- ^ Gray, Theodore. The Elements: A Visual Exploration of Every Known Atom in the Universe. New York: Black Dog & Leventhal Publishers. 2009. ISBN 978-1-57912-814-2.
- ^ Greenwood, Norman Neill; Earnshaw, Alan. Chemistry of the elements. 2016. ISBN 978-0-7506-3365-9. OCLC 1040112384 (英语).
- ^ Iancu, Cristina V.; Wright, Elizabeth R.; Heymann, J. Bernard; Jensen, Grant J. A comparison of liquid nitrogen and liquid helium as cryogens for electron cryotomography. Journal of Structural Biology (Elsevier BV). 2006, 153 (3): 231–240. ISSN 1047-8477. doi:10.1016/j.jsb.2005.12.004.
- ^ A new molecule and a new signature – Chemistry – tetranitrogen. Science News. 2002-02-16 [2007-08-18]. (原始内容存档于2015-10-16).
- ^ Polymeric nitrogen synthesized. physorg.com. 2004-08-05 [2009-06-22]. (原始内容存档于2012-01-24).
- ^ Fabian, J. and Lewars, E. Azabenzenes (azines)—The nitrogen derivatives of benzene with one to six N atoms: Stability, homodesmotic stabilization energy, electron distribution, and magnetic ring current; a computational study (PDF). Canadian Journal of Chemistry. 2004, 82 (1): 50–69. doi:10.1139/v03-178. (原始内容 (PDF)存档于2005-03-29).
- ^ Muir, B. Cubane (页面存档备份,存于互联网档案馆). (See "further topics" section.)
- ^ Patil, Ujwala N.; Dhumal, Nilesh R. and Gejji, Shridhar P. Theoretical studies on the molecular electron densities and electrostatic potentials in azacubanes. Theoretica Chimica Acta. 2004, 112: 27–32 [2013-10-01]. doi:10.1007/s00214-004-0551-2. (原始内容存档于2020-04-06).
- ^ Bethe, H. A. Energy Production in Stars. Physical Review. 1939, 55 (5): 434–56. Bibcode:1939PhRv...55..434B. doi:10.1103/PhysRev.55.434.
- ^ Audi, G.; Wapstra, A. H.; Thibault, C.; Blachot, J. and Bersillon, O. The NUBASE evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 2003, 729: 3–128. Bibcode:2003NuPhA.729....3A. doi:10.1016/j.nuclphysa.2003.11.001. (原始内容 (PDF)存档于2008-09-23).
- ^ Flanagan, Lawrence B.; Ehleringer, James R; Pataki, Diane E. Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls. 2004-12-15: 74–75 [2013-10-02]. ISBN 9780080525280. (原始内容存档于2017-01-09).
- ^ Atomic Weights and Isotopic Compositions for Nitrogen. NIST. [2013-05-22]. (原始内容存档于2013-03-02).
- ^ Worley, R. Absorption Spectrum of N2 in the Extreme Ultraviolet. Physical Review. 1943, 64 (7–8): 207. Bibcode:1943PhRv...64..207W. doi:10.1103/PhysRev.64.207.
- 元素氮在洛斯阿拉莫斯国家实验室的介绍(英文)
- EnvironmentalChemistry.com —— 氮(英文)
- 元素氮在The Periodic Table of Videos(诺丁汉大学)的介绍(英文)
- 元素氮在Peter van der Krogt elements site的介绍(英文)
- WebElements.com – 氮(英文)
- Nitrogen (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos (University of Nottingham)
- Etymology of Nitrogen (页面存档备份,存于互联网档案馆)
- Why high nitrogen density in explosives? (页面存档备份,存于互联网档案馆)
- WebElements.com – Nitrogen (页面存档备份,存于互联网档案馆)
- It's Elemental – Nitrogen (页面存档备份,存于互联网档案馆)
- Chemistry in its element podcast (MP3) from the Royal Society of Chemistry's Chemistry World: Nitrogen (页面存档备份,存于互联网档案馆)
- Schenectady County Community College – Nitrogen
- Nitrogen N2 Properties, Uses, Applications (页面存档备份,存于互联网档案馆)
- Handling procedures for liquid nitrogen
- Material Safety Data Sheet
- 氮元素的介绍影片 (页面存档备份,存于互联网档案馆)